Генная терапия тяжелого комбинированного иммунодефицита движется на рынок
Результаты генной терапии тяжелого генетического заболевания иммунной системы, в которой для доставки функционального гена используется лентивирусная конструкция, были опубликованы в апреле 2019 года. Сейчас сразу несколько платформ для генной терапии различных видов тяжелого комбинированного иммунодефицита проходят клинические испытания.
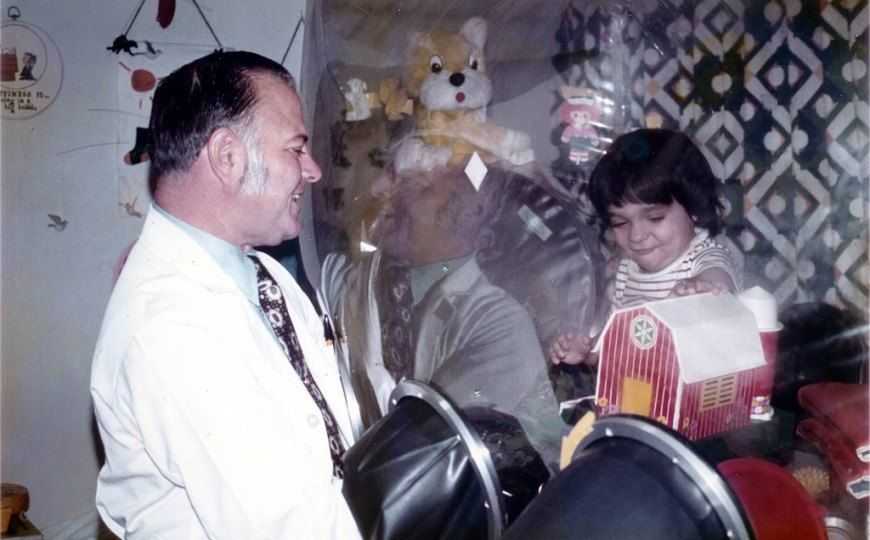
Дэвид Веттер (1971—1984), мальчик, страдавший тяжелым комбинированным иммунодефицитом и с рождения вынужденный жить в стерильной среде, и доктор Джон Монтгомери из Медицинского колледжа Бейлора | commons.wikimedia.org/
В середине апреля New England Journal of Medicine опубликовал промежуточные результаты экспериментальной генной терапии для восьми детей с Х-сцепленным тяжелым комбинированным иммунодефицитом (SCID, или ТКИД). Ученые из Детской исследовательской больницы Св. Иуды и Калифорнийского университета в Сан-Франциско использовали лентивирус для доставки функционального гена гамма-рецептора интерлейкина в гемопоэтические стволовые клеткам пациента ex vivo. После трансплантации клетки восстанавливали иммунную систему пациентов, включая Т-клетки, В-клетки и естественные клетки-киллеры (см. подробности на PCR.news).
Эти успехи сделали генную терапию ТКИД привлекательной областью для инвестиций. В августе 2018 года Mustang Bio лицензировала платформу лентивирусной генной терапии от больницы Св. Иуды, переименовав ее в MB-107. А после апрельской публикации несколько компаний выразили желание обсудить возможность сублицензирования.
Тем временем лондонский стартап Orchard Therapeutics в феврале объявил о своем клиническом успехе с лентивирусным препаратом для терапии ТКИД, связанного с дефицитом аденозин-деаминазы (ADA), — второй наиболее распространенной формы заболевания после Х-сцепленного ТКИД. На конференции по трансплантации и клеточной терапии 2019 года в Хьюстоне Дональд Кон из Калифорнийского университета в Лос-Анджелесе, научный соучредитель Orchard, рассказал, что все 20 молодых людей, получавших терапию OTL-101, разработанную компанией, два года спустя были здоровы, и их иммунная система была полностью функциональной. При этом около трети пациентов в контрольной группе, которым трансплантировали гемопоэтические стволовые клетки, нуждались в дополнительной экстренной трансплантации или заместительной ферментной терапии.
Исследователи впервые начали тестировать генную терапию Х-сцепленного ТКИД в клинике почти три десятилетия назад. Но в первых двух исследованиях у 6 из 20 пациентов развился лейкоз, вызванный активацией протоонкогенов из-за инсерции вектора, один молодой пациент умер. Регуляторы надолго приостановили клинические испытания генной терапии. Дополнительным препятствием для клинических применений стал тот факт, что генная терапия ТКИД первого поколения с использованием гамма-ретровирусных векторов помогла исправить дефекты Т-клеток, но не восстановила другие иммунные функции.
Теперь, благодаря лентивирусным векторам и новым протоколам кондиционирования, которые обеспечивают устойчивое приживление в организме генно-модифицированных клеток, клинические перспективы стали более благоприятными. Лентивирусы считаются наилучшей с точки зрения эффективности и безопасности векторной платформой для генной терапии ex vivo. Эти векторы на основе ВИЧ лучше трансформируют неделящиеся популяции клеток, включая гематопоэтические стволовые клетки костного мозга, чем гамма-ретровирусные системы, полученные из вирусов мышиного лейкоза Молони. Перенос генов также происходит быстрее, экономя день-другой лабораторного культивирования. Что касается безопасности, лентивирусы, как правило, внедряются в гены, в отличие от ретровирусов, которые «предпочитают» стартовые сайты транскрипции (если их интеграция происходит вблизи протоонкогенов, это опасно). Более того, лентивирусные векторы, построенные на основе самоинактивирующегося ВИЧ, содержат делеции длинных концевых повторов, которые, вероятно, стимулировали дисрегуляцию генной экспрессии у пациентов, заболевших лейкозом.
Примечательно, что генная терапия дефицита ADA Strimvelis, принадлежащая GlaxoSmithKline,— первая генная терапия ex vivo, разрешенная в любой точке мира — использует не лентивирусную систему, а гамма-ретровирусный вектор, но при этом не дает таких осложнений. Тем не менее, после того как в 2016 году Strimvelis был одобрен европейскими регуляторами, только пять пациентов получили продукт в течение следующих двух лет. Причины — большая редкость заболевания (около 15 новых случаев в Европе ежегодно) и цена в 594 000 евро (при этом компания Orchard Therapeutics продолжает испытания своей лентивирусной терапии OTL-101, и участие в них бесплатно). Кроме того, для лечения нужно ехать в Милан и оставаться там в течение месяца.
Что касается OTL-101, генно-модифицированные стволовые клетки после лентивирусной трансдукции планируют криоконсервировать и хранить в жидком азоте; в таком виде их можно переводить. «Это означает, что перемещаются клетки, а не пациент, — говорит Бобби Гаспар, руководитель по научной работе Orchard, — и вы кондиционируете пациента и реинфузируете клетки только тогда, когда знаете, что у вас есть оптимальный продукт, который дает пациенту наилучшие шансы на проведение терапии». Orchard ожидает регистрацию в США в 2020 году, с последующей заявкой в Европе.
Терапия Strimvelis тем не менее сыграла важную роль, продемонстрировав преимущество стратегии кондиционирования — низких доз ДНК-алкилирующей химиотерапии бусульфаном, которая стала стандартом для увеличения приживления генно-модифицированных клеток крови. Ранее приживление клеток было настолько низким, что большинство пациентов с ADA-ТКИД оставались на заместительной ферментной терапии.
Клинические испытания генной терапии для других форм SCID только начинаются, и все они используют лентивирусы (список можно посмотреть здесь). Среди них Артемис-дефицитный ТКИД, распространенный среди коренного населения Северной Америки. В ближайшие месяцы в Медицинском центре Лейденского университета в Нидерландах планируют начать испытания терапии RAG-дефицитного ТКИД, вызванного мутациями в RAG1. Оба эти вида ТКИД регулируют сборку сегментов в геноме клетки иммунной системы для генерации разнообразия антигенных рецепторов. Есть основания полагать, что их генная терапия потребует более точной настройки уровней экспрессии трансгена, чем вирусные препараты для ADA - или Х-сцепленного SCID. Возможно, эту задачу смогут выполнить CRISPR-Cas9 или редакторы оснований. Хотя технологии CRISPR тоже не идеальны с точки зрения безопасности, этот подход полностью исключает возможность активации генов, связанной со вставкой вектора. Эксперименты по генной коррекции Х-сцепленной ТКИД с помощью CRISPR уже проводились (2019,2017). Интереса у компаний они пока не вызвали, поскольку было неясно, в чем их преимущество перед MB-107 и зачем вкладывать деньги в ее альтернативу. Однако применительно к другим видам тяжелого комбинированного иммунодефицита преимущество может стать более явным, и ситуация изменится.
Источник
Elie Dolgin // ‘Bubble boy’ gene therapy reignites commercial interest // Nature Biotechnology, 2019, 37, 699-701; DOI: 10.1038/d41587-019-00015-6








 Меню
Меню





 Все темы
Все темы






 0
0