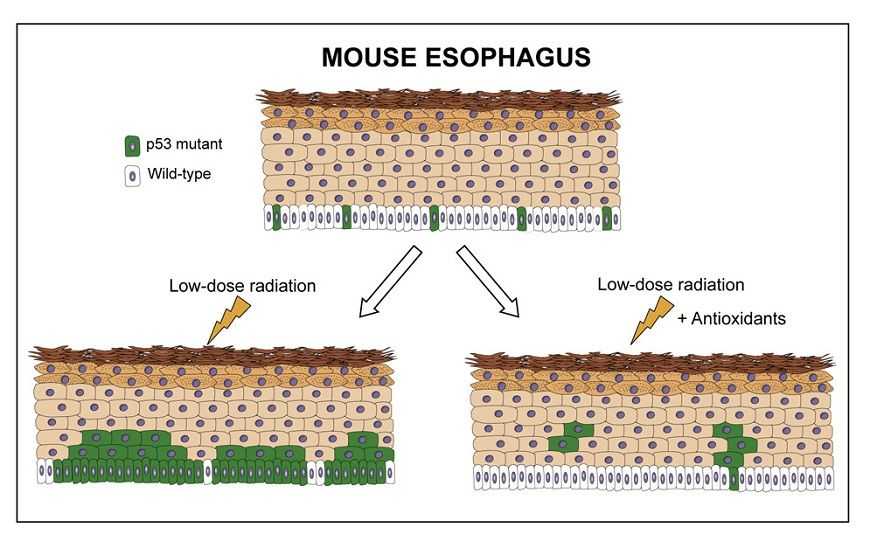
Низкие дозы радиации увеличивают количество клеток с мутациями в р53
Ионизирующее излучение, равное по дозе 3–4 облучениям при компьютерной томографии, обеспечивает преимущество клеткам с мутацией, ассоциированной с развитием рака. Однако, если перед облучением мышам давать антиоксидант, то эффект пропадает. Результаты исследования открывают новые возможности для терапии рака.
Fernandez-Antoran D. et al. // Outcompeting p53-Mutant Cells in the Normal Esophagus by Redox Manipulation. // Cell Stem Cell, 2019.
В работе, опубликованной в Cell Stem Cell, ученые из Великобритании поставили вопрос: будут ли быстрее распространяться клетки с мутацией в гене р53 после окислительного стресса, вызванного низкой дозой радиации? В качестве модельного объекта использовали эпителий пищевода мыши, который состоит из нескольких слоев постепенно дифференцирующихся кератиноцитов. Исследователи сфокусировались именно на гене p53 (у человека — TP53, у мыши — Trp53), так как мутации в нем тесно связаны с трансформацией клеток в раковые: в норме p53 мутирован в 5–10% клеток, но в раковом эпителии такая мутация присутствует практически во всех клетках.
Дозу облучения подбирали экспериментально и остановились на 50 мГр, что эквивалентно 3–4 обследованиям в компьютерном томографе. При такой дозе образовывалось около одного двунитевого разрыва ДНК в расчете на 5 клеток, но не индуцировался апоптоз. Чтобы отличать нормальные клетки от мутантных, авторы использовали желтый флуоресцентный белок (YFP), экспрессия которого индуцировалась при рекомбинации в клетках трансгенных мышей AhcreERTRosa26flEYFP/WT. Меченые клетки передавали свою способность к флуоресценции по наследству, таким образом можно было наблюдать распространение их потомков в эпителии. Спустя неделю после индукции экспрессии YFP ученые облучали мышей 50 мГр ионизирующего излучения и через сутки определяли размеры клонов с помощью 3D конфокальной микроскопии. При этом количество клонов, экспрессирующих YFP, пропорционально увеличивалось благодаря усилению дифференцировки и компенсирующей её пролиферации базальных клеток.
Далее предположили, что за обнаруженные изменения в поведении клеток после облучения ответственны активные формы кислорода (АФК), продуцируемые митохондриями. Это проверили с помощью флуоресцентного биосенсора Mito-Grx1-roGFP, локализующегося в митохондриях и изменяющего характер флуоресценции в ответ на окисление. Изменений не происходило, если клетки обрабатывали восстановителем дитиотрейотолом (DTT), но при воздействии экзогенной АФК H2O2 эффект был таким же, как при облучении 50 мГр.
С помощью перечисленных выше экспериментов установили, что клетки с мутантным p53 устойчивее нормальных в условиях окислительного стресса, поэтому и получают преимущество. Нивелировать это преимущество удалось, вводя мышам антиоксидант N-ацетилцистеин (NAC) перед облучением. Это исследование не только проливает свет на влияние низких доз радиации, но и открывает возможности использования антиоксидантов для терапии раковых заболеваний без побочных эффектов на соседние ткани.
Источник
Fernandez-Antoran D. et al. // Outcompeting p53-Mutant Cells in the Normal Esophagus by Redox Manipulation. // Cell Stem Cell, 2019; DOI: 10.1016/j.stem.2019.06.011








 Меню
Меню





 Все темы
Все темы






 0
0