Скрининг кандидатных препаратов для заболеваний ЦНС станет быстрее
Депрессивные расстройства, эпилепсия и болезнь Альцгеймера — широко распространенные заболевания нервной системы. Успехи в их лечении замедляет большая продолжительность испытаний новых препаратов, а также частые провалы молекул-кандидатов на какой-либо из стадий. Результаты пятилетней работы исследователей из Городского университета Гонконга и Гарвардской медицинской школы, кажется, смогут оптимизировать процесс по самым главным параметрам — времени и ресурсам.
Депрессивные расстройства, эпилепсия и болезнь Альцгеймера — широко распространенные заболевания нервной системы. Успехи в их лечении замедляет большая продолжительность испытаний новых препаратов, а также частые провалы молекул-кандидатов на какой-либо из стадий. Результаты пятилетней работы исследователей из Городского университета Гонконга и Гарвардской медицинской школы, кажется, смогут оптимизировать процесс по самым главным параметрам — времени и ресурсам.
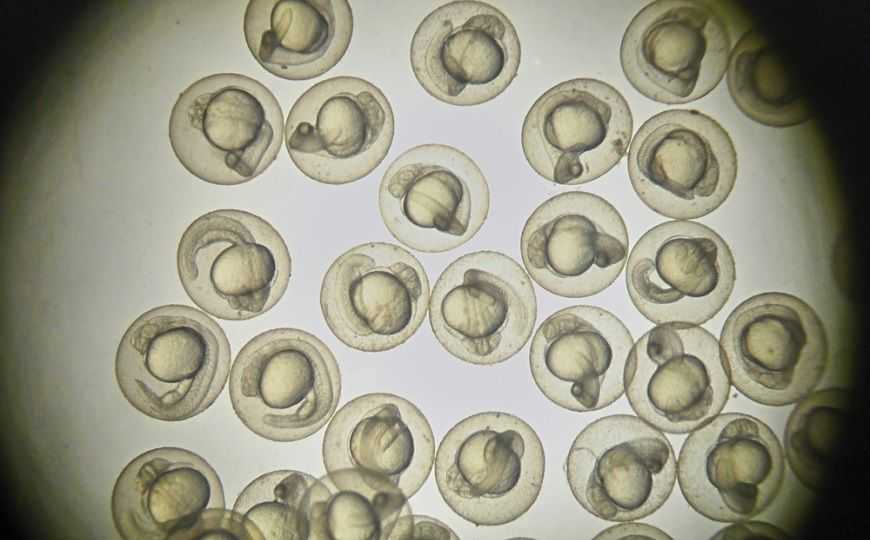
Авторы работы создали технологию высокопроизводительного картирования активности мозга — HT-BAMing (High-throughput brain activity mapping). Достижения современной микроскопии, создание кальций-чувствительных флуоресцентных репортеров, которые экспрессируются в организме трансгенного животного, например рыбки Danio rerio, позволяет регистрировать активность нервной ткани с разрешением на уровне отдельных клеток. Но проблема в том, как наладить масштабное получение данных от большого количества подвижных животных. Авторы разработали микрожидкостный чип, который позволяет всего за 20 секунд иммобилизировать и удобно разместить бодрствующих, не анестезированных личинок данио для записи активности их мозга, возникающей под действием тех или иных лекарственных препаратов.
Используя HT-BAMing, авторы сначала сформировали библиотеку из 179 существующих лекарственных веществ. Этими веществами обработали тысячи личинок рыбок и записали карты активности мозга. Только на основании полученных данных о мишенях воздействия в ЦНС, без учета известной информации о препаратах, эти вещества распределили в 10 групп. Обнадеживало, что группы во многом совпали с существующими терапевтическими категориями (антиэпилептические, антипаркинсонические препараты, аналептики и др.). На основе этой библиотеки исследователи обучили искусственный интеллект, чтобы в дальнейшем он мог выявлять новые молекулы-кандидаты с высоким потенциалом в выбранной области.
Для тестирования взяли 121 вновь синтезированное вещество с предполагаемой противоэпилептической активностью, и нейросеть предсказала успех у 30. Чтобы проверить прогноз, исследователи случайным образом выбрали 14 из них и провели поведенческие тесты на личинках данио, у которых вызывали судороги добавлением пентилентетразола. Семь из 14 молекул снизили частоту судорожных эпизодов без возникновения седативного эффекта, а значит, можно говорить о 50%-ной точности новой разработки. Хотя исследование сосредоточилось на противоэпилептических средствах, по словам ученых, новый подход можно использовать для любых других групп препаратов.
Предполагается, что эта высокоскоростная система скрининга сделает процесс создания препаратов более быстрым и экономичным. Авторы статьи также отмечают, что новый подход способен увеличить разнообразие фармакологических точек приложения, а следовательно, и методов лечения неврологических заболеваний.
Источник
DOI: 10.1038/s41467-018-07289-5








 Меню
Меню





 Все темы
Все темы





 0
0