Улучшенный протокол получения аденоассоциированных вирусов для генной терапии
Ученые из медицинской школы Бостонского университета и их японские коллеги усовершенствовали методику выделения аденоассоциированных частиц всех серотипов. Новый протокол уже успешно используется для получения большого количества вирусных частиц (1010–1011 вирусных геномов на мкл) с чистотой более 90%, что позволит использовать эти вирусы для исследований in vivo.
Аденоассоциированные вирусы (ААВ) используются для внесения генетических модификаций in vivo и in vitro. Их применение относительно безопасно и эффективно, так как ААВ обеспечивают длительную стабильную экспрессию и обладают низкой иммуногенностью. Однако для более широкого использования необходимо увеличить чистоту и количество выделяемых вирусов с нужной генетической конструкцией, поэтому авторы исследования, опубликованного в Scientific Reports, оптимизировали существующие протоколы получения ААВ.
Обычно протокол выделения ААВ состоит из нескольких частей. Сначала получают плазмиды с генами структурных белков для сборки вируса и с той ДНК, которую готовый вирус должен будет доставить в исследуемый объект. Потом проводят одновременную трансфекцию плазмид в стандартную линию клеток (чаще всего используют клетки, полученные из эмбриональных почек человека, HEK293) для самосборки вирусных частиц. На этот процесс может оказывать влияние состав среды, в том числе количество глюкозы, ионов аммония и рН. Далее клетки лизируют, выделяют из них готовые вирусные частицы, измеряют концентрацию и проверяют вирулентность.
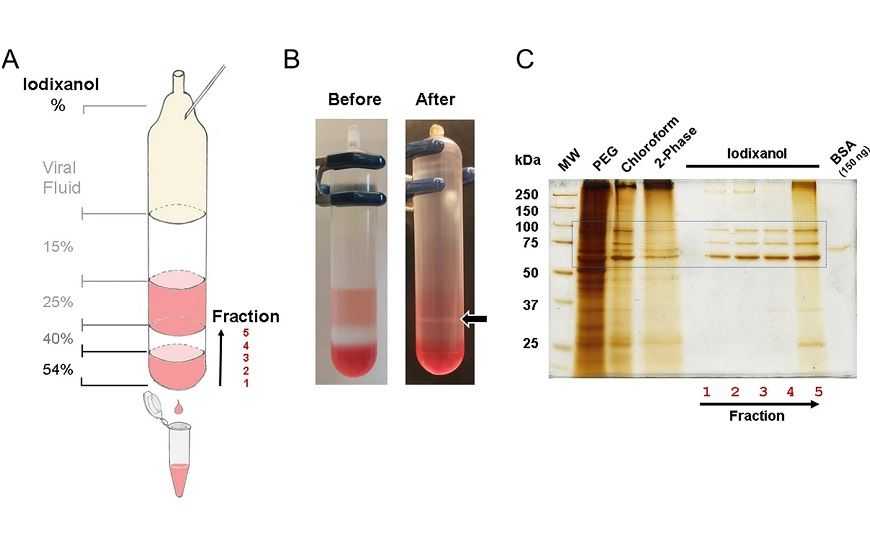
Новый протокол в первую очередь отличается тем, что вирусы выделяли не только из лизированных клеток, но и непосредственно из среды культивирования на 3-й и 5-й дни. Для этого тестировали среды разного состава и пришли к выводу, что лучше всего использовать небольшое количество глюкозы, дополнительные буферы для стабилизации рН и GlutaMAX вместо глутамина, так как глутамин приводит к образованию аммиака в среде. Также снизили количество сыворотки (fetal bovine serum, FBS) до 1% и проводили очистку методом дифференциального центрифугирования в градиенте плотности йодиксанола, так как без дополнительной стадии очистки сохраняется много лишних белков, которые могут вызвать иммунный ответ при введении ААВ in vivo.
Итак, с пользованием улучшенного протокола ученым удалось увеличить чистоту ААВ с нужной генетической конструкцией до 90%, сократить время получения очищенного вируса до семи дней с момента трансфекции и достигнуть высоких титров вируса, затрачивая при этом в 5 раз меньше клеток.








 Меню
Меню





 Все темы
Все темы





 0
0