Вирус с измененным паттерном метилирования генома теряет вирулентность
Вакцины против респираторно-синцитиального вируса не существует, однако новая работа дает надежду на ее создание в недалеком будущем. Предложенный авторами подход связан с модификацией паттерна метилирования вирусной геномной РНК.
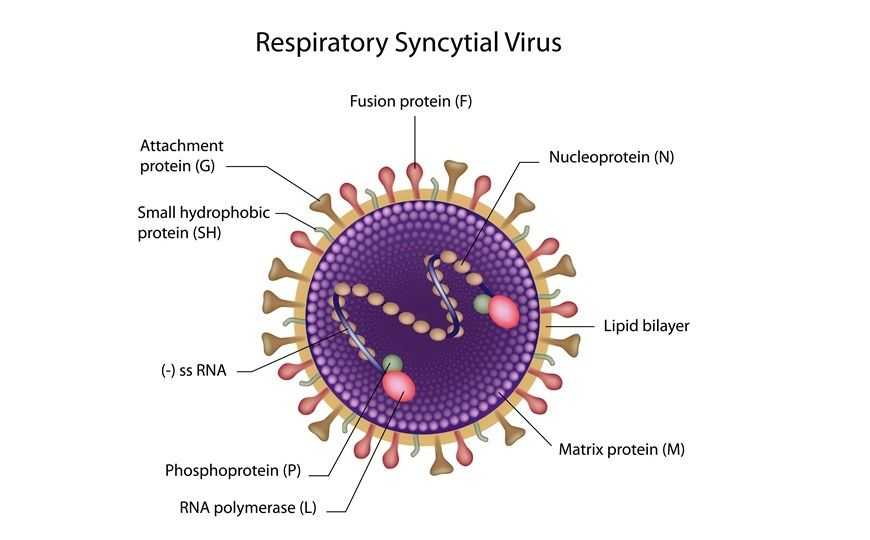
Метилирование РНК по аденозину (m6A) часто встречается в различных организмах. Его функциональное значение понятно не всегда. Очень часто эта модификация встречается в РНК-содержащих вирусах. Исследователи из США и Китая выясняли функцию метилирования аденозина в вирусной РНК на примере респираторно-синцитиального вируса (РСВ). Относительно безобидный для взрослых патоген, вызывающий обычную простуду, РСВ убивает на Земле ежегодно около 80 тысяч детей, и только в США каждый год становится причиной смерти более 14 тысяч пожилых пациентов.
Авторы работы проанализировали взаимодействие метилированных РНК вируса с клеточными белками, связывающимися с метиладенозином. Выяснилось, что при этом усиливается репликация и трансляция вирусных РНК: в клетках, где эти белки были инактивированы РНК-интерференцией, продукция компонентов вируса и репортерных белков, экспрессируемых с вирусных промоторов, значительно снижалась. И наоборот, оверэкспрессия m6A-связывающих белков значительно повышала уровень транскрипции и трансляции компонентов вируса. С другой стороны, оверэкспрессия m6A-деметилирующего белка снижала уровень транскрипции и трансляции РНК вируса. Интересно, что вирусная инфекция изменяла спектр метилированных аденозинов в собственных транскриптах клетки-хозяина.
Исследователи выясняли, какой эффект вызовет полная блокировка метилирования аденозинов в избранных сайтах РНК вируса. «Метил-аденозиновое» секвенирование вирусной РНК, которое анализирует фрагменты нуклеиновой кислоты вируса, «пойманные» антителом, специфичным к m6A, идентифицировало в геноме вируса несколько горячих точек с наибольшим уровнем метилирования аденозина. Для исследования этих сайтов был применен один из вариантов «обратной генетики» — вирусную РНК конвертировали в ДНК, а в ДНК внесли мутации, заменив А или С в интересующих консенсусных сайтах метилирования (последовательность 5-ARm6ACM — см номенклатуру IUPAC) на G или T — комплементарный пурин или пиримидин соответственно. Замены проводили таким образом, чтобы не вносить мутации в аминокислотные последовательности кодируемых белков.
В культуре клеток у мутантных вирусов значительно снижались уровень репликации и количества сформированных вирионов, а также замедлялись различные компоненты жизненного цикла. Испытания на модельных животных показали, что вирусы, дефицитные по метилированию РНК, значительно аттенуированы, вызывают весьма умеренные повреждения инфицированных тканей и индуцируют защитный иммунный ответ против изолятов вируса дикого типа. Один из мутантов оказался практически апатогенным, вызывая, тем не менее, при инфекции высокоэффективный протективный иммунитет. Исследователи также отметили, что мутантные вирусы значительно менее чувствительны к модулирующей активности белков, распознающих m6A. Это позволяет сделать вывод, что влияние клеточных факторов на степень аттенуации вируса невелико, и что ослабление вирулентности практически полностью связано с отсутствием m6A в вирусной РНК.
Механизм взаимодействия клеточных белков и метилированной вирусной РНК в настоящее время изучен недостаточно. Вместе с тем, как показано в данной работе, внесение мутаций в сайты метилирования РНК вируса позволяет создавать вирионы с пониженной инфекционностью, которые могут служить прототипом для новых высокоэффективных противовирусных вакцин. Возможно, это окажется справедливым не только для РСВ, но и для многих других вирусов с РНК-геномом. Авторы работы считают, что тонкая регулировка метилирования вирусного генома позволит нужный баланс между вирулентностью и иммуногенностью, создавая инструменты для разработки новых вакцин и противовирусных препаратов.
Источник
Xue, M, et al. // Viral N6-methyladenosine upregulates replication and pathogenesis of human respiratory syncytial virus.// Nature Communications, 2019; 10 (1) DOI: 10.1038/s41467-019-12504-y


 Меню
Меню





 Все темы
Все темы






 0
0