Онкология XXI века: из лаборатории в клинику и обратно
Что умеет и чего пока не умеет молекулярная онкодиагностика, могут ли клетки опухоли общаться между собой, как правильно моделировать колоректальный рак на мышах и какие меры обеспечат безопасность Т-клеточных терапевтических продуктов.
В апреле 2024 года в ФГБУ ФНКЦ физико-химической медицины им. Ю.М. Лопухина ФМБА России прошла конференция «Экспериментальная и клиническая онкология», приуроченная к 100-летию Ю.М. Лопухина и 40-летию НИИ физико-химической биологии. Рассказываем о некоторых докладах первого дня, посвященного экспериментальной онкологии.
Секцию открыл член-корр. РАН Евгений Имянитов, руководитель отдела биологии опухолевого роста НМИЦ онкологии им. Н.Н. Петрова Минздрава России, с пленарным докладом «Молекулярная диагностика в онкологии».
Молекулярная диагностика, то есть анализ ДНК и РНК, имеет различные применения в онкологии, однако наиболее важные направления — диагностика наследственных опухолевых синдромов (фатальной предрасположенности к тем или иным органоспецифичным видам рака, которые развиваются в более молодом возрасте, чем спорадические раки) и тесты для выбора терапии. Евгений Наумович предположил, что «если бы медицинская генетика формировалась сегодня, начинали бы с наследственных опухолевых синдромов». Это самая распространенная группа наследственных заболеваний у человека, от опухолевых синдромов страдают 2–5% популяции. При этом генов, связанных с наследственными опухолевыми синдромами, относительно немного — существенно меньше, чем, например, генов наследственного иммунодефицита.
Необходимо помнить, что нельзя выполнять диагностику наследственных заболеваний без предварительных популяционных исследований. Этнические группы различаются по частоте и типу мутаций, между тем 80% медицинской генетики делается в США, и полученные там данные не следует бездумно использовать для других регионов. Например, в этнических группах Кавказа имеет свою специфику спектр патогенных вариантов генов BRCA. У нас уникальные условия для подобных исследований, подчеркнул Евгений Наумович; Россия — многонациональная страна, имеющая доступ к необходимым высоким технологиям.
Много говорят о мутациях, ассоциированных с чувствительностью к тем или иным лекарственным препаратам, однако все эти мутации «помещаются на одном слайде», отметил докладчик. Диагностику чувствительности осложняет множество факторов, например, измененная экспрессия гена может быть функциональной или нефункциональной, и во втором случае препарат, нацеленный на эту мишень, не подействует. Выбор терапии на основе результатов анализов — нетривиальная задача, и «компетенцией лаборанта здесь не обойдешься».
Молекулярная диагностика может помочь подобрать не только таргетную, но и цитостатическую терапию. Это малоисследованная область, в то же время способная принести значительную практическую пользу.
Следует учитывать и «немолекулярные» причины, осложняющие анализ, например, тот факт, что в опухоли трансформированные клетки могут находиться рядом с нормальными. Важно, чтобы в команде были морфологи, способные выделять опухолевые клетки.
Еще одна проблема — время, которое занимают исследования. Сроки выполнения теста влияют на результат лечения, в условиях реальной клинической практики важно уложиться в 10 дней. Необходимы наработки, способные ускорить процесс, например, сочетание аллельспецифической ПЦР на наиболее частые мутации и секвенирования для поиска редких мутаций.
Докладчик привел ряд примеров исследований в области молекулярной онкологии, начиная с масштабной работы, опубликованной в прошлом году, в рамках которой были исследованы 8355 образцов колоректального рака на мутации KRAS, NRAS и BRAF (как типичные, так и атипичные), амплификацию и сверхэкспрессию HER2, а также микросателлитную нестабильность. В этой работе обнаружены интересные закономерности, например, географические различия в частоте мутаций BRAF.
NGS — перспективная технология, и в некоторых областях молекулярной диагностики у нее нет альтернатив. Однако необходимо понимать, какие ограничения есть у экзомного NGS-скрининга, — например, не всегда выявляются крупные делеции и дупликации.
Привлекательным представляется агностический подход к диагностике: проанализировать максимальное количество мутаций, без предварительных предположений о наиболее вероятных. Это дает возможность обнаружить мишени, чувствительные к препаратам, которые обычно при данном диагнозе не применяются. Евгений Наумович рассказал о случае из своей практики: у пациентки с карциномой почки была выявлена мутация в гене рецептора эпидермального фактора роста EGFR. Такие мутации чаще всего обнаруживаются при аденокарциномах легких и крайне редки в опухолях других типов, но в данном случае назначение гефитиниба вызвало ответ. Однако не все специалисты понимают ограничения этого подхода; терапия по обнаруженной мишени может и не быть успешной. Важно, чтобы не было завышенных ожиданий, подчеркнул докладчик.
В основе резистентности опухоли к терапии лежат разные механизмы: выкачивание лекарственного препарата из клетки, его ускоренный метаболизм, активация репарации ДНК. Генетические мутации могут вызвать изменения в эпитопе мишени препарата, перестройки нижележащих или вышележащих сигнальных путей или активацию параллельных путей. Доклад Михаила Красильникова (НМИЦ онкологии им. Н.Н. Блохина) был посвящен эпигеномным факторам формирования резистентного фенотипа. Они относятся к таргетным факторам, как и генетические.
Важную роль в эпигенетической регуляции играют микроРНК. В раковых клетках они обеспечивают устойчивость к химиотерапии, гормональную резистентность, радиорезистентность.
Одно из интереснейших направлений современных исследований — кольцевые РНК. Они могут препятствовать транскрипции гена или влиять на его экспрессию, взаимодействовать с белками, играть роль «губки», накапливающей микроРНК и усиливающей их действие на гены-мишени. Примечательно, что некоторые из них способны транслироваться (то есть они не обязательно являются некодирующими). Исследование роли кольцевых РНК в развитии лекарственной устойчивости докладчик назвал первоочередной задачей молекулярной онкологии.
В формировании резистентного фенотипа может участвовать метилирование ДНК и модификации гистонов.
Наконец, опухолевые клетки могут обмениваться регуляторными малыми РНК с помощью экзосом, и как выяснилось, таким образом может распространяться лекарственная устойчивость. Михаил Александрович и его коллеги показали, как делятся резистентностью эстрогеннезависимые клетки MCF-7/T — выделяют экзосомы, подавляющие активность эстрогенового рецептора (ЭР) и снижающие чувствительность к тамоксифену клеток MCF-7. Исследователи обнаружили 6 микроРНК — ингибиторов ЭР, гиперэкспрессированных в этих экзосомах. В частности, miR-181a снижает чувствительность к тамоксифену и подавляет экспрессию ЭР через ингибирование ДНК-метилтрансферазы 3.
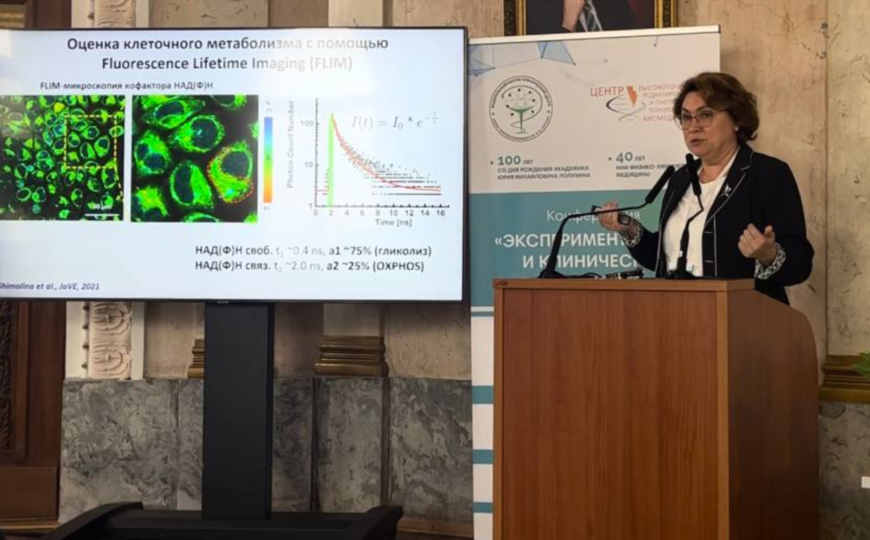
Член-корреспондент РАН, зам. генерального директора по развитию ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России Елена Загайнова рассказала о флуоресцентном время-разрешенном имиджинге метаболизма опухолей. Работы, о которых говорилось в докладе, были выполнены в коллаборации с сотрудниками нижегородского НИИ экспериментальной онкологии и биомедицинских технологий.
Общеизвестно, что опухолевый метаболизм отличается от метаболизма здоровых клеток. Для опухолевой ткани характерны в том числе повышенный уровень гликолиза (как анаэробного, так и аэробного), митохондриальная дисфункция, сниженный уровень клеточного дыхания, а также метаболическая пластичность и гетерогенность. Опухолевым клеткам нужна быстрая энергия, отсюда преобладание гликолиза.
Оптический метаболический имиджинг (FLIM) не единственный метод анализа метаболизма опухоли, есть и другие подходы: ПЭТ с меченой глюкозой, омиксный анализ, иммуногистохимия и биохимия. Но у FLIM есть важные преимущества: высокая молекулярная специфичность, отсутствие контрастных агентов, возможность количественной оценки, неинвазивость и быстрое получение результата. Исследование можно проводить на живых клетках и тканях, в том числе на пациенте, подчеркнула докладчица.
FLIM позволяет оценивать соотношение кофакторов FAD и NAD(P)H в клетке. Чем больше FAD, там активнее идет окислительное фосфорилирование, а высокое содержание свободного NAD(P)H указывает на преобладание гликолиза. Таким образом можно отслеживать метаболический ответ опухоли на химиотерапию.

Говоря о платформах для FLIM, Елена Вадимовна упомянула приборы, работающие на (суб)клеточном уровне (двухфотонная FLIM-микроскопия), на макроуровне (сканеры, позволяющие изучать операционное поле) и на тканевом уровне (приборы с зондом-иглой для оптоволоконной время-разрешенной спектроскопии). Вольфганг Беккер, руководитель компании Becker&Hickl, где была изобретена технология FLIM, — соавтор работ Елены Вадимовны и ее коллег.
На изображениях, полученных с помощью FLIM, хорошо видно отличие опухоли от нормальной ткани. Исследователи показали это на интракраниальных моделях глиом крыс, проведены и пилотные работы на образцах глиомы пациентов. Также были исследованы мышиные модели карциномы легких, меланомы и колоректального рака. Примечательно, что колоректальные опухоли Т4 оказлись более гликолитичными, чем опухоли Т3, которые хуже отличаются по этому показателю от нормы, — фактически у последних был более окислительный метаболизм, чем у нормальных тканей.
С помощью FLIM можно изучать ответ на химиотерапию. Например, в клеточной культуре (на клетках HeLa) видно, через какой промежуток времени после начала терапии появляются характерные изменения метаболизма, насколько гетерогенны клетки по реакции, можно сравнить ответ на разные препараты. Макро-FLIM in vivo показывает, как происходит сдвиг в сторону окислительного метаболизма в опухоли мыши, получающей цисплатин.
Метод также позволяет оценивать чувствительность и резистентность к различным препаратам опухолевых клеток, полученных от конкретного пациента: клетки-«ответчики» меняют метаболизм, в резистентных картина соответствует контролю. Чтобы ускорить перенос метода в клинику, есть «мягкий» путь: исследовать вне организма опухолевый материал, извлеченный при операции. При этом нет необходимости в длительном культивировании клеток, ответ можно получить через несколько дней.
Наконец, FLIM позволяет обнаружить метаболическую гетерогенность опухоли, которая может быть причиной резистентности к терапии.
В заключение Елена Вадимовна перечислила проблемы, которые нужно решить для внедрения технологии. Среди них стандартизация методов анализа изображений, внедрение методов на основе машинного обучения и валидация на большом объеме клинического материала.
Терапевтическая вакцина против опухоли неспециалисту кажется идеальным решением. Однако не следует рассматривать неоантигенные противоопухолевые вакцины как панацею или «волшебную пулю», подчеркнул Василий Лазарев, зам. генерального директора по научной работе ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России. Наилучший результат дает сочетание вакцины с ингибиторами контрольных точек, химиотерапией или облучением.
Персонифицированная медицина ассоциируется в первую очередь с онкологией; нет двух одинаковых опухолей и двух одинаковых пациентов. В первую очередь это касается разработки терапевтических неоантигенных (то есть содержащих антигены, которых нет в здоровых тканях) вакцин.
Василий Николаевич перечислил ключевые звенья противоопухолевого иммунного ответа: мутации в клетках опухоли, ведущие к появлению неоантигенов, Т и В-клеточные рецепторы, особенности микроокружения опухоли, белки главного комплекса гистосовместимости (HLA, ГКГС).
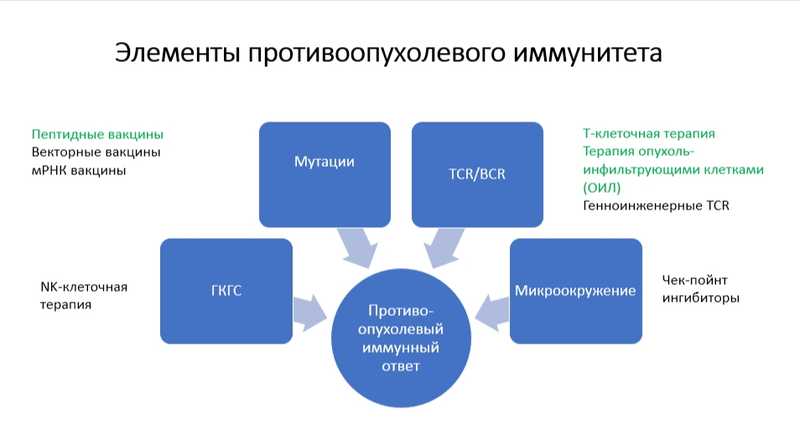
Противоопухолевый ответ могут вызвать вакцины, содержащие неоантигены. Рассматриваются также подходы, основанные на Т-клеточной терапии или терапии опухоль-инфильтрующими клетками.
Представление о том, что иммунная система реагирует на опухолевые антигены, появилось уже в середине ХХ века. Однако резкий рывок в этой области произошел во второй половине 2010-х, после успешных исследований неоадъювантных вакцин против меланомы.
Неоантигены возникают в результате мутаций, которые затрагивают кодирующие последовательности — замены нуклеотида, сдвига рамки считывания или транслокации. Белок с измененной последовательностью подвергается деградации в протеасоме, а затем его фрагменты экспонируются на белках ГКГС.
Для создания вакцины необходимо найти неоантиген, который продуцируется клетками опухоли, но не здоровыми клетками. Вакцина может содержать мРНК или ДНК, синтетические пептиды или нагруженные антигеном дендритные клетки.

Помимо анализа мутаций опухоли, необходимо провести HLA-типирование; от того, какие варианты генов HLA присутствуют у пациента, зависит эффективность вакцины.
Первое клиническое исследование неоантигенной вакцины началось еще в 1997 году. А в 2022 году в базе данных ClinicalTrials.gov было уже 147 КИ 1-2 фазы. Лидировали рак легкого (26%), глиомы (22%), меланома (12%). В 41% КИ изучались пептидные вакцины, дендритные клетки — в 17%, по 10% пришлось на мРНК- и ДНК-вакцины.
Затем докладчик подробнее рассказал о высокоцитируемой работе, опубликованной в Nature в 2017 году. Вакцина против меланомы содержала несколько пулов пептидов, различающихся по длине. У четырех из шести пациентов 25 недель не было рецидива, у двух остальных рецидив произошел, но после анти-PD-1-терапии наблюдалась полная регрессия опухоли.
Самая важная критическая точка в создании терапевтической вакцины — предсказание неоантигенов. Чтобы найти их, можно анализировать геном, экзом, транскриптом или протеом; стоимость в этом ряду последовательно убывает. Необходимо найти неоэпитопы, которые присутствуют в опухоли в большом количестве и связываются с HLA пациента.

Эффективность вакцины можно проверить экспериментально до введения пациенту с помощью тетрамерного анализа или ELISPOT — методов, которые показывают, насколько активны иммунные клетки человека против определенных антигенов.
Докладчик рассказал об экспериментах на мышах, в которых была показана способность вакцины с пептидными неоэпитопами замедлять рост опухолей и увеличивать выживаемость. В опытах с гуманизированными мышами huNOG (Taconic), которым трансплантировали клетки человеческого колоректального рака, возникли сложности; эти знаменитые мыши в большом количестве погибали из-за реакции «трансплантат против хозяина». Тем не менее исследователям удалось получить многообещающие результаты и предложить подходы, которые могут оптимизировать подбор пептидов для терапии.
Неоантигенные вакцины хорошо переносятся пациентами, просты в производстве и стабильны в хранении. Недостатком их остается продолжительное время изготовления (два-три месяца, что критично для онкобольных) и ограниченная иммуногенность. Поэтому необходимо сдвинуть парадигму — начинать применение на ранних стадиях, а не на поздних, а также повышать иммуногенность с помощью адъювантов.
В заключение Василий Николаевич рассказал про альянс TESLA, созданный в 2016 году для создания алгоритма поиска неоантигенов с использованием ИИ, в которой вошло более 36 государственных и коммерческих организаций. Успехи в этом направлении пока остаются скромными, но работа продолжается.
Темой доклада Алексея Горбачева, зав. лабораторией ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, была разработка платформы Экзом.ру для прецизионной онкологии на основе таргетного секвенирования.
Все лекторы любят рассказывать о драматическом снижении себестоимости секвенирования, о том, что стоимость генома человека падает быстрее, чем ожидалось согласно закону Мура, отметил докладчик. Однако с медицинскими применениями все не так радужно, как представлялось. В частности, геномный анализ образцов не сильно повысил эффективность прецизионной онкологии. Далеко не всегда удается обнаружить действенную мутацию (например, в исследовании 843 пациентов с прогрессирующими солидными опухолями — менее чем у половины). Только небольшая доля пациентов после генетического тестирования получает рекомендации об изменении схемы лечения, а среди тех, кто получает, новая схема эффективна далеко не у всех. Наконец, средняя коммерческая стоимость генетического тестирования для подбора терапии при онкозаболевании — 85 000 рублей при медианной зарплате в РФ около 52 000 рублей.
Повышению эффективности генетического тестирования препятствуют недостаточность открытых баз данных, нехватка данных по протеомике и транскриптомике, не всегда высокое качество входящего материала. Проблему гетерогенности опухоли и недостаточного количества материала поможет преодолеть переход к анализу единичных клеток. Но есть и другие проблемы — отсутствие единых стандартов анализа и интерпретации, высокая доля «ручного» анализа и субъективных выводов. Поэтому важна стандартизация подходов.
Докладчик напомнил основные этапы генетического тестирования: сбор материала, подготовка ДНК-библиотек, секвенирование выявление геномных вариантов, и наконец, автоматизированная подготовка заключения для врача. Соответственно, разработка включала создание протокола приготовления ДНК библиотек и создание IT-системы для анализа данных, веб-приложения для пользователей и инфраструктуры для хранения и обмена данными.
В качестве платформы для секвенирования был выбран MGISEQ-G400 (MGISEQ-2000) — высокопроизводительный прибор без проблем с поставками и с перспективой получения регистрационного удостоверения Росздравнадзора.
Докладчик подробнее остановился на протоколе подготовки библиотек, включающим фрагментацию, репарацию концов и аденилирование 3’-конца (ERAT) и АТ-лигирование адаптеров. Из нескольких полимераз для протокола выбрали собственную разработку iPhusion, которая обеспечивала качество, близкое к золотому стандарту Kapa HiFi (Roche), а также подобрали оптимальные условия для целевого обогащения.
Затем Алексей Юрьевич вкратце рассказал о биоинформатическом конвейере для анализа данных, управлении вычислениями на exome.ru. В заключении, которое получает врач, будут перечислены найденные геномные варианты, мутационные сигнатуры, CNV и слияния генов, патогенные варианты зародышевой линии, ассоциированные с наследственными онкозаболеваниями, и приведен перечень потенциально эффективных препаратов. Регистрационное удостоверение пока в планах, но пилотное внедрение начато, отметил докладчик. Сейчас разработчики собирают отзывы от онкологов по удобству, быстроте и релевантности.
Доклад Виктории Шендер, зав. лабораторией молекулярной онкологии ФНКЦ ФХМ ФМБА России, был посвящен удивительному феномену — передаче химиорезистентности от погибающих клеток злокачественной опухоли к еще живым. Межклеточная коммуникация с участием внеклеточных везикул — один из механизмов адаптации клеток опухоли к лечебному воздействию, наряду с клональной селекцией, активацией компенсаторных сигнальных путей и прочими.
Первые указания на возможность такого явления были получены еще в 1956 году на модели рака груди, но в то время, конечно, еще не было представления о молекулярных механизмах. Виктория Олеговна и ее коллеги исследовали межклеточную коммуникацию рака яичников (2014) и глиобластомы (2018). Совсем недавно они подготовили статью, которая принята к публикации в Nature Communications. В ней рассказывается о передающих резистентность везикулах с компонентами сплайсосом.
Исследовалась коллекция асцитов (излишней жидкости в брюшной полости), полученных от пациентов с аденокарциномой яичника до и после химиотерапии. Эти жидкости содержат естественный секретом опухолевых клеток. Выяснилось, что инкубация культивируемых клеток с асцитной жидкостью, собранной после терапии, повышает их резистентность, а также вносит вклад в формирование более агрессивного фенотипа клеток-реципиентов.
Протеомный анализ показал, что опухолевые асцитные жидкости после химиотерапии обогащены белками сплайсососмы — иными словами, клетки секретируют сплайсосомы в ответ на терапию. Следует ли их рассматривать как мусор, или они выполняют какую-то функцию в клетках-реципиентам?
Для ответа на этот вопрос использовали аминокислоты с изотопной меткой. После обработки клеток цисплатином можно получить из культуральной среды везикулы с мечеными белками, и эти белки будут «видимы» в клетках-реципиентах по сдвигу в массах. Результаты говорят о том, что молекулы из погибающих клеток способны подготовить оставшиеся клетки к терапевтическому воздействию, например, за счет ускорения репарации ДНК. Известно, что обработка ингибиторами сплайсинга делает опухолевые клетки чувствительными к агентам, повреждающим ДНК.
Елена Шарова, младший научный сотрудник лаборатории молекулярной генетики человека ФНКЦ ФХМ ФМБА России, сравнила в своем докладе различные мышиные модели индуцированного колоректального рака. В настоящее время используются спонтанные модели, модели с химически индуцированным раком, генетически модифицированные животные, а также сингенные модели (трансплантация мышиных опухолевых клеток) и ксенографтные модели (трансплантация человеческих опухолевых клеток специальным линиям мышей).
Спонтанные модели недостаточно управляемы, отметила докладчица. Популярны в последнее время гуманизированные, то есть «очеловеченные» ксенографтные модели — мыши, которым после облучения вводят внутривенно человеческие стволовые гемопоэтические клетки, заменяющие мышиные клетки иммунной системы. Например, уже упоминавшиеся мыши huNOG рекламируются как «HLA-matched». Однако у этой модели есть широко обсуждаемые проблемы: спонтанное развитие лимфом, недостаточность презентации антигенов и иммунного ответа (поэтому животным дополнительно имплантируют фрагмент фетального тимуса и фетальной печени для лучшего созревания Т и В-клеток), а также отсутствие информации о полном HLA-профиле. Елена Ивановна напомнила и о проблеме, упомянутой Василием Лазаревым, — спонтанной гибели 21 мыши из 130 в возрасте 6–7 месяцев, хотя производитель обещает работоспособность модели до года.
Затем докладчица рассказала о сингенных моделях рака толстого кишечника, с которыми работают в их лаборатории. У этого подхода есть свои особенности. Например, существует по крайней мере две стабильные популяции клеточной линии MC38 — MC38-L и MC38-K. Они отличаются мутационными сигнатурами («лейденская» MC38-L гипермутирована по сравнению с MC38-K). При этом не всегда понятно, какая из двух линий находится в вашем распоряжении. Поэтому исследователи взяли линию CT26, но выяснилось, что существуют «быстрая» и «медленная» СТ26, резко различающиеся темпами роста опухолей. Пригодность «быстрой» линии ограниченна, так как животное приходится слишком быстро выводить из эксперимента.
С учетом всего сказанного индуцированные модели с использованием воспалительных агентов или канцерогенов в итоге могут оказаться более подходящими. Но необходимо было проверить их воспроизводимость по рекуррентным мутациям и неоантигенам и возможность использования неоантигенной терапии в сочетании с ингибиторами контрольных точек иммунного ответа.
Оказалось, что рекуррентные мутации в 3-м экзоне бета-катенина, подобные тем, что отвечают за 7% случаев спорадического колоректального рака у человека, воспроизводятся на двух разных линиях мышей. Модель подходит для проверки эффективности антител против Vtcn1, Nectin1, Lif, но не подходит для проверки эффективности ингибитора PD-1 пембролизумаба.
Каждая этническая группа имеет специфический спектр онкогенных мутаций, еще раз напомнил Алексей Молоков (НИИ онкологии ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук»). При этом в сельских популяциях груз доминантных заболеваний в полтора раза выше, чем в городских, рецессивных — более чем в два раза, а молекулярно-генетическое тестирование развито недостаточно.
В России более 200 этнических групп: коренное население Сибири — это 1,4 млн человек и более 45 национальностей. Однако золотым стандартом выявления наследственных форм рака молочной железы и яичников остается определение методом ПЦР-РВ восьми мутаций генов репарации BRCA1/2, характерных для славянского населения РФ.
Целью исследования Алексея Юрьевича с коллегами был поиск наследственных молекулярных нарушений при раке молочной железы в этнических группах Сибири с применением экзомного секвенирования. В исследование были включены 150 пациенток монголоидного происхождения (бурятки, тувинки, хакаски, алтайки, якутки) с морфологически подтвержденным РМЖ, отягощенным семейным анамнезом и без вышеупомянутых «славянских» мутаций. Проводилось таргетное секвенирование по 27 генам. Наиболее значимые результаты получены по тувинскому этносу, но и для других этнических групп есть интересные находки. По тувинским пациенткам также готовы результаты полноэкзомного секвенирование, причем обнаружено несколько перспективных мутаций.
Гены, связанные с заболеваниями, являются маркерами этногенетических процессов в популяциях и приносят информацию об эволюции генома человека и об этногенезе в целом, сказал в заключение докладчик.
Адоптивная клеточная терапия, то есть введение пациенту иммунных клеток, чаще всего Т-лимфоцитов — одно из важнейших направлений современной онкологии. В частности, из опухолевой ткани получают TIL — инфильтрирующие опухоль Т-лимфоциты, культивируют в присутствии интерлейкина-2 и вводят обратно пациенту. Остается актуальным вопрос о безопасности Т-клеточных продуктов, и этому вопросу был посвящен доклад Татьяны Петровой (ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России).
В ноябре прошлого года FDA инициировало проверку сообщений о злокачественных Т-клеточных новообразованиях у пациентов после CAR-T терапии (подробнее на PCR.NEWS). Были также сообщения о спонтанной реактивации в терапевтических клетках вирусов герпеса 4 типа (вирус Эпштейна–Барр, EBV) и 6 типа. Татьяна Владимировна с коллегами наблюдали спонтанную B-клеточную пролиферацию в линии TIL in vitro. Клетки продуцировали EBV, но при трансплантации мышам не образовывали опухолей. Анализ генетической идентичности подтвердил, что эти клетки — производные клеток пациента.
Очевидно, Т-лимфоциты не всегда могут элиминировать EBV-положительные лимфобластоидные В-лимфоциты. Проверенные Т-клеточные продукты, к счастью, не содержали маркера В-клеток CD19. По-видимому, эта линия опознавалась Т-лимфоцитами, но так бывает не во всех случаях, подчеркнула докладчица: зараженная EBV линия может культивироваться. Хотя спонтанная реактивация EBV — крайне редкое событие, необходимо тестировать Т-клеточные продукты на вирусы герпеса 4 и 6 типа и наличие примеси В-лимфоцитов. Сейчас ведутся дискуссии о необходимости противовирусной обработки адоптивных Т-клеточных продуктов перед инфузией, в том числе CAR T-клеток.
Информация о докладчиках
Евгений Наумович Имянитов, член-корр. РАН, д.м.н., профессор, руководитель отдела биологии опухолевого роста ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Михаил Александрович Красильников, д.б.н., профессор, директор Научно-исследовательского института канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Елена Вадимовна Загайнова, д.м.н., профессор, член-корр. РАН, зам. генерального директора по развитию ФГБУ ФНКЦ физико-химической медицины им. Ю.М. Лопухина ФМБА России, Москва
Василий Николаевич Лазарев, д.б.н., доцент, зам. генерального директора по научной работе ФГБУ ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, Москва
Алексей Юрьевич Горбачев, к.б.н., зав. лабораторией протеомного анализа ФГБУ ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, Москва
Виктория Олеговна Шендер, к.х.н., зав. лабораторией молекулярной онкологии ФГБУ ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, Москва
Елена Ивановна Шарова, младший научный сотрудник лаборатории молекулярной генетики человека ФГБУ ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, Москва
Алексей Юрьевич Молоков, младший научный сотрудник лаборатории молекулярной онкологии и иммунологии НИИ онкологии ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук», Томск
Татьяна Владимировна Петрова, ФГБУ ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, Москва








 Меню
Меню





 Все темы
Все темы






 0
0