Ученые нашли сходство между атеросклерозом и раком
Авторы статьи в журнале Circulation показали, что атеросклеротические бляшки, закупоривающие кровеносные сосуды, в своем развитии похожи на раковые опухоли: гладкомышечные клетки, участвующие в формировании бляшки, становятся склонны к гиперпролиферации, инвазии, в них активируются генные регуляторные сети, связанные с раком, наблюдается геномная нестабильность, накапливаются повреждения ДНК и т. п. При этом противораковый препарат нирапариб показал многообещающие результаты — он уменьшал масштабы атеросклеротического поражения у модельных мышей. Исследователи считают, что можно говорить о новом направлении в изучении и терапии атеросклероза — атероонкологии.

Credit:
Columbia University Irving Medical Center (Pan et al.) | пресс-релиз
Атеросклероз — основная причина сердечно-сосудистых заболеваний (ССЗ) и одна из ведущих причин смерти во всем мире. Болезнь развивается при нарушениях липидного обмена; при этом несколько типов клеток начинают проявлять патологическую активность: иммунные клетки (Т-лимфоциты и макрофаги), клетки гладкой мускулатуры (smooth muscle cell, SMC), образующие стенки артерий, и клетки эндотелия, выстилающего кровеносные сосуды. Ключевым событием, способствующим прогрессированию заболевания, выступает фенотипическое переключение SMC, их гиперпролиферация, миграция и трансдифференцировка с образованием SDC-клеток (SMC-derived cell).
Ранее проведенные исследования указывают на потенциальное сходство между атеросклерозом и раком. В частности, значимым фактором риска развития атеросклеротических ССЗ является клональный гемопоэз — ассоциированное с возрастом состояние, при котором из-за соматических мутаций в различных генах (DNMT3A, TET2, ASXL1, JAK2 и др.) происходит клональная экспансия гемопоэтических стволовых клеток. Для атеросклеротических процессов подтвержден феномен клональной экспансии SMC, и выдвинута гипотеза об их опухолеподобном поведении. Ученые из Колумбийского университета проверили эту гипотезу на мышах и на клетках, полученных от людей с атеросклерозом.
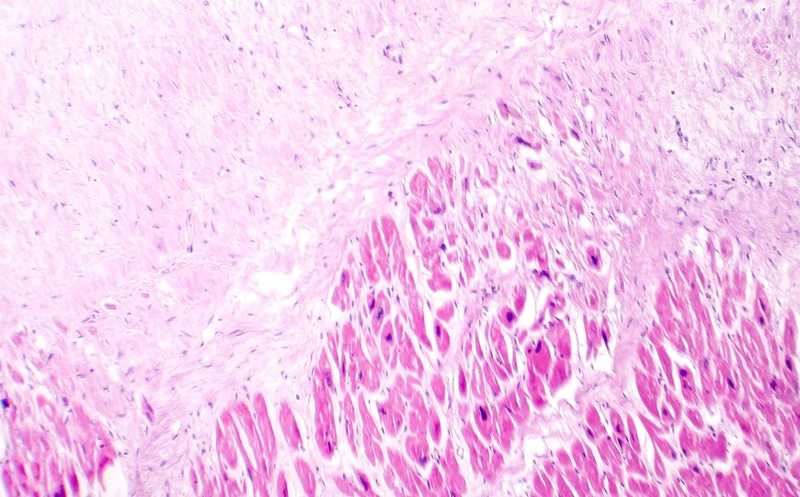
Эксперименты проводились на различных мышиных моделях, в которых атеросклероз развивался на фоне получения корма с высоким содержанием жиров (западная диета). Животным также добавляли в корм тамоксифен для индукции флуоресцентного маркера ZsGreen1 в SMC. По сравнению со здоровыми клетками уровень маркеров перекисного окисления липидов и окислительного стресса был заметно выше в атеросклеротических клетках, особенно в ZsGreen1+ SMC. Маркеры окислительного повреждения ДНК появлялись уже на ранних стадиях фенотипического переключения SMC-клеток и со временем накапливались; на фоне ингибирования путей восстановления возникали одно- и двуцепочечные разрывы ДНК в существенно большем количестве, чем в клетках здоровых сосудов — как у молодых, так и у старых мышей. Это говорит о том, что повреждение ДНК в SMC связано именно с атеросклерозом, а не с возрастом; аналогичные повреждения ДНК наблюдались в атеросклеротических клетках человека.
Накопление повреждений ДНК приводит к нестабильности генома. Анализ целостности генома показал почти во всех типах клеток из области атеросклеротических поражений значительные вариации числа копий хромосомных сегментов (CNV), что говорит об увеличении геномной нестабильности по мере прогрессирующей трансдифференцировки, более выраженной в SMC-клетках. Ряд хромосомных областей с повышенным числом копий включает в себя гены, связанные с ишемической болезнью сердца (CCM2 и PALLD) и с онкозаболеваниями (EGFR, FAT1, KRAS и UBR5). То есть, геномная нестабильность при атеросклерозе связана с амплификацией генов, задействованных в развитии рака и ишемической болезни сердца.
Эксперименты с маркерами старения клеток показали, что SDC-клетки обладают повышенным пролиферативным потенциалом и быстро пролиферируют, а также обладают способностью к инвазии, то есть могут распространяться через внеклеточный матрикс. В культуре SDC-клетки из атеросклеротических бляшек вели себя аналогично типичным раковым стволовым клеткам и демонстрировали повышенную экспрессию специфических опухолевых маркеров (CD24 и CD44).
Секвенирование РНК единичных клеток выявило, что в основе трансформации SMC- в SDC-клетки лежит активация основных сигнальных путей, ассоциированных с раком. В том числе оказалось, что в SDC-клетках активируются фактор некроза опухоли α (TNFα) и транскрипционный ядерный фактор NF-kB (связаны с воспалением), цитокин TRAIL (способствует выживанию клеток), фактор роста эндотелия сосудов, рецептор эпидермального фактора роста (EGFR) и сигнальные пути MAPK и JAK-STAT (приводят к усилению пролиферации), а также пути PI3K (способствует инвазии) и WNT (стимулирует обновление как у раковых стволовых клеток). При этом доля клеток с единственным активированным онкогенным путем снижается, но увеличивается доля клеток с тремя и более активированными путями. То есть, фенотипическая трансформация SMC в SDC при атеросклерозе приводит к активации генных регуляторных сетей, связанных с раком.
Авторы также показали, что онкогенная мутация KrasG12D ускоряет фенотипическое переключение SMC-клеток и способствует прогрессированию атеросклероза. Однако сама по себе данная мутация не индуцирует атеросклероз, а лишь усиливает уже имеющиеся патогенные процессы.
Если в основе атеросклероза лежат процессы, приводящие к развитию опухолей, значит, какие-то противораковые лекарства можно использовать для лечения атеросклеротических поражений сосудов. Исследователи проверили эффективность нирапариба — ингибитора поли(АДФ-рибоза)-полимеразы (PARP), подавляющего репарацию повреждений ДНК. Этот препарат используют для лечения разных типов рака. Введение нирапариба мышам с атеросклерозом практически не влияло на массу тела животных и на уровень циркулирующего холестерина, однако уменьшало масштабы атеросклеротического поражения, снижало количество бляшек и повышало их стабильность. Препарат подавлял экспрессию маркерных генов стволовых клеток, то есть мог блокировать трансформацию SMC в SDC внутри бляшек; он также уменьшал количество SDC с поврежденной ДНК. Таким образом, противораковый препарат может быть эффективен при атеросклерозе за счет ингибирования фенотипического переключения гладкомышечных клеток артерий.
Исследователи приходят к выводу, что процессы, происходящие при атеросклерозе в клетках гладкой мускулатуры, составляющих стенки артерий, имеют значительное сходство с процессами развития опухолей. В их числе — гиперпролиферация, инвазия клеток, активация генных регуляторных сетей, связанных с раком, геномная нестабильность, накопление повреждений ДНК; при этом атеросклеротические клетки отвечают на противораковую терапию. Метастазов, правда, при атеросклерозе не образуется. Однако полученные данные, считают ученые, позволяют рассматривать атеросклероз в рамках принципиальной новой интегративной концепции заболевания — атероонкологии (athero-oncology), что также дает возможность использовать новые варианты терапии.
Превращение гладкомышечных клеток защищает сосуды от последствий атеросклероза








 Меню
Меню





 Все темы
Все темы





 0
0