Антитела к змеиному яду усиливают его токсичность
Укусы ядовитых змей способны убивать людей или приводить к инвалидности. Один из недавно разработанных способов защиты — введение нейтрализующих токсин антител. Этот метод показал многообещающие результаты в доклинических испытаниях, однако авторы статьи в Nature Communications выяснили, что некоторые варианты антител к компонентам яда копьеголовой змеи Bothrops asper не нейтрализуют, а, напротив, усиливают их токсичность. Это явление впервые описано для токсинов животных.
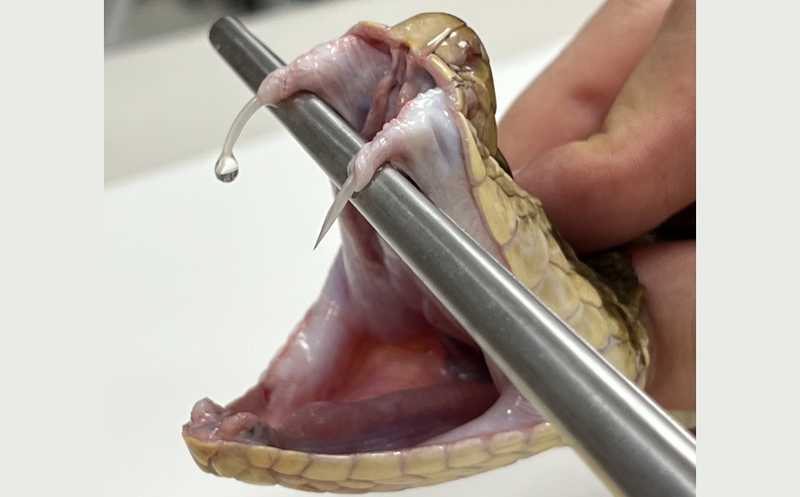
Укусы ядовитых змей ежегодно приводят к смерти и инвалидности тысяч людей, и необходимо разрабатывать эффективные способы борьбы с отравлениями змеиным ядом. Недавно разработанные нейтрализующие моноклональные антитела против нескольких змеиных токсинов показали свою эффективность на доклинических моделях грызунов. Однако авторы работы, опубликованной в Nature Communications, обнаружили, что антитела к компонентам яда копьеголовой змеи Bothrops asper способны усиливать его токсичность.
Яд B. asper содержит значительное количество миотоксических фосфолипаз A2 (PLA2) и PLA2-подобных белков, действие которых вызывает некроз скелетных мышц, иногда приводящий к ампутации и пожизненной инвалидности. Кроме того, в яде содержится миотоксин II, и именно на нем сосредоточились авторы работы. Они разработали моноклональное антитело, нацеленное на миотоксин II, и протестировали его на животной модели.
Чтобы получить антитела, специфичные к миотоксину II, ученые воспользовались фаговым дисплеем. Из 276 вариантов scFv они отобрали 184, специфично связывавших миотоксин II, и выбрали шесть из них с наиболее высокой аффинностью. Последовательности этих scFv-фрагментов затем использовали для получения разных вариантов антител.
Нейтрализующий эффект полноразмерных антител авторы работы проверили in vitro. Оказалось, что два из них (E02 и F04) в присутствии токсина снижали жизнеспособность фибробластов, еще два (G08 и B04) демонстрировали дозозависимую нейтрализующую способность, и, наконец, еще два (B12 и A03) обеспечивали полную нейтрализацию токсина и сопоставимую с контролем выживаемость клеток даже в низкой концентрации антител. Из каждой группы ученые отобрали по одному варианту для дальнейшего изучения.
Все три варианта антител — B12, E02 и G08 — исследователи испытали на модели грызунов. Они проводили преинкубацию миотоксина II с антителом, после чего внутримышечно вводили животным полученную смесь (в качестве контроля использовали сам миотоксин II, буферный раствор или сочетание миотоксина с сывороткой против яда гадюки, которая используется в настоящее время при укусах B. asper). Через три часа после инъекции у мышей собирали кровь и измеряли уровень креатинкиназы в плазме как показатель повреждения мышц. Опыты с преинкубацией показали, что введение миотоксина II повышала активность креатинкиназы по сравнению с контрольной группой, которой вводили буферный раствор. Сыворотка показала нейтрализующую тенденцию, хотя уровень креатинкиназы оставался достаточно высоким. Антитело G08 не подавляло индуцированную токсином активность креатинкиназы — авторы работы предполагают, что наблюдаемая картина может объясняться связыванием антитела с ненейтрализующим эпитопом либо его более низкой аффинностью к токсину. А вот два других антитела полностью предотвратили повышение уровня креатинкиназы, вызываемое миотоксином II.
Затем ученые протестировали нейтрализующие антитела на другой модели — они вводили мышам токсин змеиного яда, после чего проводили внутривенную инъекцию антитела B12, которое показало успешную нейтрализацию токсина при преинкубации. Результат оказался неожиданным — вместо того, чтобы предотвратить повышение уровня креатинкиназы, вводимое после инъекции яда антитела приводило к его возрастанию. Подопытные животные в таком случае погибали в течение 24 часов. При этом введение антитела без токсина не давало такого эффекта.
Кроме того, у мышей, получавших антитела к миотоксину II, наблюдались морфологические изменения в почках — и это может объяснять неожиданное усиление токсичности вместо ее нейтрализации. Когда авторы работы провели гистологический анализ почек, они обнаружили, что капсулы Боумена были намного сильнее повреждены у мышей, получавших антитела после токсина, по сравнению с животными, которым вводили только токсин.
Чтобы детальнее изучить обнаруженную смену функции антитела, исследователи модифицировали его Fc-фрагмент, убрав одну из двух мутаций, препятствующих связыванию антитела с Fc-рецептором и увеличивающих время его циркуляции в организме. Такое изменение устранило повышение уровня креатинкиназы, которое наблюдалось в предыдущем опыте.
Наконец, авторы проверили нейтрализующую активность Fab фрагмента вместо полноразмерного антитела. В опытах с преинкубацией Fab-фрагмент значительно снижал уровни креатинкиназы в плазме крови животных; аналогичный эффект наблюдался при последовательном введении миотоксина II и антитела.
Таким образом, некоторые варианты нейтрализующих антител могут усиливать токсическое действие змеиного яда вместо того, чтобы защитить от него. Это явление называется антителозависимым усилением токсичности (ADET), и оно никогда ранее не было описано для токсинов, которые встречаются у животных.Пептиды из яда пауков защищают сердце при ишемии
Источник
Sørensen, C.V., et al. Antibody-dependent enhancement of toxicity of myotoxin II from Bothrops asper. // Nat Commun 15, 173 (2024). DOI: 10.1038/s41467-023-42624-5








 Меню
Меню





 Все темы
Все темы





 0
0