Двенадцать удивительных клонов
В сентябре 2023 года не стало Иэна Уилмута, одного из «создателей» овечки Долли. Первое клонированное из соматической клетки млекопитающее появилось на свет почти 28 лет назад. Вспоминаем знаменитых клонированных животных и обсуждаем, зачем нужно клонирование в XXI веке.

DEED
Клонирование ДНК и клонирование овцы
Прежде чем мы начнем рассказ о клонах, уточним для неспециалистов одну важную деталь: клонирование бывает разное. Клоны — это, по определению, идентичные копии чего-то: организмов, клеток или молекул.
Молекулярное клонирование — это когда исследователь выделяет конкретную последовательность нуклеотидов, внедряет ее в организм-хозяин и многократно реплицирует в жестко контролируемых условиях in vitro. Молекулярное клонирование применяется в исследовательских целях, а также в биотехнологии, например, для наработки рекомбинантного белка клонируют его ген в бактерии. Оно лежит в основе создания генно-модифицированных организмов, клеточной и генной терапии.
Клеточный клон — совокупность генетически идентичных клеток, происходящих от одной клетки. Например, в нашем организме есть клоны Т-лимфоцитов, распознающие тот или иной антиген. Т-лимфоциты одного человека, в отличие от большинства клеток, из которых мы состоим, не идентичны друг другу, жизнь их меняет, но это отдельная история.
В 2000-е годы ученые и врачи всерьез заговорили о терапевтическом клонировании — массовом получении человеческих клеток для медицинских целей. Терапевтическое клонирование представлялось универсальным методом персонализированной терапии, новой медицины постгеномной эпохи. Терапевтическому клонированию прочили большую роль в коррекции серьезных системных патологий, в лечении наследственных болезней, в реабилитации после травм и операций и многом другом. Этот тип клонирования предполагалось осуществить методом переноса ядра соматической клетки пациента в реципиентную эмбриональную клетку, с ее последующим нормальным делением. Далее клеточный материал должны были размножать, тестировать и создавать панели пациентоспецифичных клеточных линий. На клетках животных подобные манипуляции делались.
Но в 2006 году Синъя Яманака с коллегами создали эффективную методику получения индуцированных плюрипотентных стволовых клеток (иПСК). В основе методики лежит дедифференцировка клеток пациента в стволовые клетки, которые, свою очередь, можно управляемо дифференцировать в другие типы клеток. Это принципиально новое технологическое решение сняло многие этические проблемы и открыло новые возможности. Сам Иэн Уилмут в 2007 году заявил, что больше не хочет добиваться лицензии на клонирование человеческих эмбрионов в медицинских целях, потому что технология иПСК выглядит перспективнее.
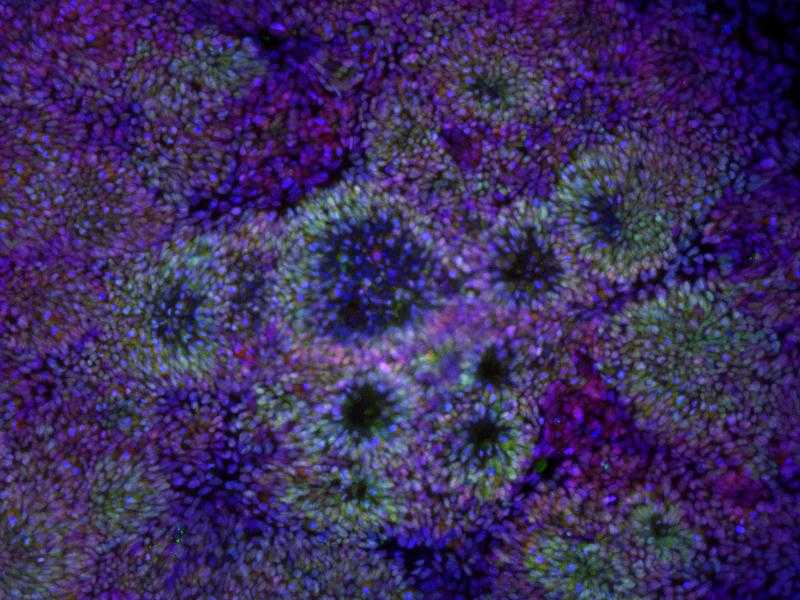 Индуцированные стволовые клетки на пути дифференцировки в нейроны. Credit: K. Francis, NICHHD, NIH |
flickr.com |
CC BY-NC 2.0 DEED
Индуцированные стволовые клетки на пути дифференцировки в нейроны. Credit: K. Francis, NICHHD, NIH |
flickr.com |
CC BY-NC 2.0 DEED
И, наконец, репродуктивное клонирование. Это когда исследователь стремится получить живую особь с таким же геномом, как у другой особи (или эмбриона). В качестве примеров «естественного клонирования», то есть получения генетически идентичных особей, приводят монозиготных близнецов, вегетативное размножение растений или деление одноклеточных.
Но дальше мы будем говорить только о клонировании организмов в лаборатории. И только о млекопитающих. Клонирование амфибии — сравнительно простая задача, которая впервые была осуществлена за десятилетия до овечки Долли. Это сделал в 1958 году Джон Гердон (кстати, разделивший Нобелевскую премию 2012 года с Синъя Яманакой). А клонировать животных, откладывающих яйца, — птиц и рептилий — наоборот, крайне сложно, к огорчению тех, кто мечтает о возрождении динозавров и птиц моа.
Как клонируют млекопитающих
Эмбриологи предпочитают говорить не «клонирование», а «реконструкция зиготы» (ZR, zygote reconstruction). Также используется аббревиатура SCNT — somatic cell nuclear transfer. Для этого соматическое ядро переносят или в зиготу, или в неоплодотворенный ооцит. Собственный хромосомный материал реципиентной яйцеклетки предварительно убирают (такая яйцеклетка называется энуклеированной). После переноса донорского ядра реконструированную зиготу «подталкивают» к дроблению в условиях in vitrо с помощью электрического импульса или специальных «активирующих» сред. Ну а дальше нормально развивающийся эмбрион переносят в суррогатную мать, стимулированную к беременности.
Важное напоминание: клонированный организм наследует только ядерный геном донора, митохондрии вместе с мтДНК он получает от энуклеированной яйцеклетки. И тут есть дополнительные сложности. Мы сказали «перенос ядра», но корректнее говорить, что переносится кариопласт — ядро или веретено деления с прилежащей цитоплазмой, заключенные в клеточную мембрану, — в цитопласт (клетку, из которой извлечено ядро). Практически это означает, что может получиться клон с гетероплазмией, то есть с двумя различными типами митохондрий: основная часть митохондрий придет из цитопласта яйцеклетки, а минорная фракция митохондрий неизбежно попадет с кариопластом.
Существует немало вариаций основного протокола ZR. Остановимся подобнее на трех основных протоколах.
1. HT (The Honolulu Techniques; названа по месту создания, о чем будет рассказано дальше). Соматические ядра выделяют непосредственно из живых тканей, например, из клеток крови, клеток миокарда, фибробластов кожи, кумулюсных клеток, бластомеров и т.д., а затем вводят в яйцеклетку.
2. RT (The Roslin Techniques; названа, как нетрудно догадаться, в честь Рослинского института в Шотландии). В качестве доноров ядер используются клетки из первичной тканевой культуры, например, эмбриональные или фетальные фибробласты и т.д. Выделенные соматические ядра «загоняются» в ооцит, из которого предварительно убрали его собственный хромосомный материал, с помощью сильного электрического импульса.
3. HMC (handmade cloning). Зигота реконструируется из соматического кариопласта и двух цитопластов синхронных (находящихся на одной стадии развития) ооцитов. Их разрезают пополам вручную, чтобы получить половинки без хромосом (такой «хирургический» метод эффективнее, чем энуклеация с помощью химических веществ). Слияние двух половинок и донорского ядра создает яйцеклетку с достаточным для нормального развития объемом цитоплазмы. В этом случае клонированная особь неизбежно будет дважды химерной по материнским митохондриям, так как цитопласты происходят из разных ооцитов. Эта технология не требует дорогостоящего оборудования, однако требует филигранного владения мануальными техниками микродиссекции и микрокомпозиции живых объектов.
ZR не единственный метод репродуктивного клонирования. Клоны млекопитающих можно успешно создать, используя метод «искусственной близнецовости» (AT, artificial twinning), основанный на микрохирургическом разделении бластомеров до стадии активации зародышевого генома. Этот метод хорошо работает только для тех видов млекопитающих, у которых бластомеры сравнительно долго сохраняют тотипотентность. Например, для парнокопытных AT очень эффективен, а вот для мышевидных грызунов он практически бесполезен.
Сколько в мире лабораторных клонов
После Долли были клонированы тысячи особей млекопитающих. По данным на 2022 год, одних клонов собак получено не менее 1500. Но, вероятно, больше всего клонировано мышей.
Сколько клонировано сельскохозяйственных животных, трудно сказать. В XXI веке на арену клонирования вышли инновационные фирмы, фонды, агропромышленные компании и даже транснациональные биотехнологические корпорации, которые проводят и финансируют исследования в этой области.
Из-за высокой стоимости и низкой успешности клонирования использование клонов для производства пищевой продукции нереалистично, но клонирование ценных представителей пород может окупиться. Вспомогательные репродуктивные технологии, от искусственного оплодотворения до переноса эмбрионов, в животноводстве используются давно, а клонирование дало возможность получать молодые копии старых и кастрированных животных — в том числе меринов с выдающимися скаковыми качествами. Международная организация коневодства (FEI) в 2012 году отменила запрет на участие клонов в состязаниях (хотя и некоторые заводчики, и организаторы скачек, и любители испытывают по этому поводу противоречивые чувства). Продукты питания, полученные из клонов или их потомков, признаны безопасными, но продавать их, как правило, не рекомендовано или прямо запрещено.
Так или иначе, клонов лошадей и крупного рогатого скота совершенно точно много. Про некоторых выдающихся представителей своих пород известно, что они были клонированы десятки раз.
Вся эта огромная «армия клонов» создана разными методами, в разное время и с разными целями: для решения научных задач, ради получения прибыли, чтобы увеличить численность редкого вида, наконец, из эмоциональных побуждений, если речь идет о домашних питомцах. (В последние недели с новостных страниц не сходят шесть клонированных собак нового президента Аргентины Хавьера Милея.) Поэтому, размышляя о клонировании, важно понимать, что мы наблюдаем причудливую и пеструю картину причин, следствий, побочных эффектов и случайных совпадений.
Человечеству удалось успешно клонировать представителей по меньшей мере 25 видов плацентарных млекопитающих.
Долли
Овечка Долли (1996–2003) — самый известный в мире клон, первое клонированное млекопитающее, полученное из соматических клеток взрослого животного. Именно в этом проекте был предложен базовый протокол ZR RT. В основу этого достижения легли работы сотрудников Рослинского института (Кейта Кэмпбелла, Иэна Уилмута и коллег) и компании PPL Therapeutics.
Для ясности: Долли не «первая клонированная овечка». Годом ранее в Шотландии были получены клоны Меганн и Мораг из ядер дифференцированных эмбриональных стволовых клеток. А самым первым в этом списке был безымянный клон, полученный в 1984 году из ядер недифференцированных эмбриональных клеток.
Особенности эксперимента. Клетки молочной железы донора — овцы породы финн-дорсет — выращивали в культуре изначально для другой цели. Бизнес-идея PPL Therapeutics, в итоге не принесшая прибыли, состояла в том, чтобы получать в молоке генно-модифицированных животных ценные белки, отсюда и опыты именно с этим типом клеток. Доктор Уилмут так объяснил выбор имени для новорожденной: «Долли произошла из клетки молочной железы, а мы не могли вообразить более впечатляющей пары желез, чем у [актрисы и певицы] Долли Партон». (Сейчас такая шутка вряд ли бы понравилась широкой публике — еще одно напоминание о том, как длинна история клонирования.)
Чем еще замечательна. Долли родила шесть ягнят. С возрастом начала страдать от артрита, к нему добавилось заболевание легких, и в институте было принято решение об эвтаназии. Шесть с половиной лет — короткая жизнь: овцы ее породы могут прожить более 10 лет. Версия о том, что жизнь Долли сократило клонирование, не подтвердилась: патанатомическое исследование показало, что у нее была аденокарцинома легких, вызванная ретровирусом, и та же болезнь убила других овец в стаде. Действительно, теломеры Долли вроде бы были укорочены, но больше никаких аномалий, связанных с быстрым старением, у нее не удалось обнаружить. Другие клонированные овцы, включая полученных из той же клеточной линии, жили долго и счастливо.
 Четыре «близняшки» Долли из той же линии клеток, в возрасте 8 лет. Credit: Nat Commun. 2016; 7: 12359. DOI: 10.1038/ncomms12359 | CC BY 4.0 DEED
Четыре «близняшки» Долли из той же линии клеток, в возрасте 8 лет. Credit: Nat Commun. 2016; 7: 12359. DOI: 10.1038/ncomms12359 | CC BY 4.0 DEED
Мышь Кумулина
Кто клонировал: Гавайский университет
Особенности эксперимента. Кумулина была клонирована из кумулюсных клеток — это клетки, участвующие в питании и созревании ооцита. Именно в этой работе был предложен один из базовых протоколов клонирования —The Honolulu Techniques, который в дальнейшем с успехом применялся для самых разных объектов и моделей.
Чем еще замечательна. Кумулина — второе после Долли клонированное млекопитающее и первое, клонированное неоднократно в нескольких поколениях. Она прожила долгую для мыши жизнь (1997–2000), произвела на свет детенышей.
 Кумулине два года
Кумулине два года
«Размороженные» мыши
Кто клонировал. Факультет биологии развития RIKEN, Кобе, Япония
Особенности эксперимента. В 2008 году японские исследователи представили миру мышей, клонированных из материала, пролежавшего в замороженном состоянии 16 лет. Это был первый случай успешного посмертного клонирования из замороженных клеток.
Ядра клеток головного мозга переносили в энуклеированные ооциты. Прямой перенос не привел к успеху, хотя с более «свежими» замороженными мышами все получалось. Тогда исследователи перенесли ядро нейрона в эмбриональную стволовую клетку, а из клеток полученной таким образом линии уже перенесли ядра в ооциты. Родилось двое самцов, и оба они оставили потомство при спаривании с обычными самками.
Чем еще замечательна эта история. Авторы выдвинули любопытное предположение, объясняющее, почему ядра клеток мозга могут лучше перенести замораживание и оттаивание, чем клетки других тканей. Известны криопротекторные свойства сахарозы и трегалозы, возможно, аналогичным свойством обладает и глюкоза, критически важная для активности нейронов.
Эта команда и сейчас продолжает эксперименты с клонированием из лиофилизированных клеток. Один из результатов — на фото ниже.
 Мышь Дорами (черная), клонированная из замороженного ядра, принесла нормальное потомство. Credit: Nat Commun, 2022. DOI:
10.1038/s41467-022-31216-4 | CC BY 4.0 DEED
Мышь Дорами (черная), клонированная из замороженного ядра, принесла нормальное потомство. Credit: Nat Commun, 2022. DOI:
10.1038/s41467-022-31216-4 | CC BY 4.0 DEED
Мышь Маша из Пущино
Кто клонировал: Пущинский научный центр
Особенности эксперимента. Мышь Маша и ее клоносестры — легендарные персонажи, СМИ часто пишут о них что-то вроде «советские ученые опередили шотландцев на десять лет». Однако эти мыши не были клонами в современном понимании, поскольку при реконструкции зиготы использовалось не соматическое ядро, а пронуклеусы (ядра яйцеклетки и сперматозоида) из другой синхронной зиготы. Мы включили мышь Машу в наш список, чтобы внести ясность в этот вопрос.
В данной экспериментальной системе никакой реактивации соматического генома не было и не могло быть, потому что не было инактивации. Не создавалась копия взрослого животного. Авторы работы и не ставили такой задачи! Тем не менее это был важный результат уже потому, что он демонстрировал возможности клеточной инженерии, на тот момент почти фантастические.
Статья об эксперименте была опубликована в журнале «Биофизика» (1987, т. 32, вып. 5). Ее текст, хотя не очень аккуратно распознанный, можно прочитать здесь.
 Мышь Маша (белая, в центре)
Мышь Маша (белая, в центре)
Крыса Ральф
Кто клонировал: Национальный институт сельскохозяйственных исследований Франции, компания genOway
Особенности эксперимента. Казалось бы, крыса мало отличается от мыши, но клон крысы удалось получить только в 2003 году. Проблема заключалась в том, что ооциты крысы спонтанно активируются и начинают стремительно фрагментироваться, как только покидают яйцевод. Чтобы предотвратить фрагментацию, манипуляции с ооцитами проводили в среде с ингибитором, останавливающим деление. Затем ингибитор удаляли и через полчаса выполняли перенос ядра.
Двум суррогатным матерям имплантировали 130 эмбрионов, у одной родилось три крысенка (один умер вскоре после рождения, осталось двое), и старшего назвали Ральфом. К моменту публикации статьи он сам уже стал отцом.
Корова Дейзи
Кто клонировал: Университет штата Коннектикут
Чем замечательна эта история. В 1999 году из ядер клеток кожи, взятой с уха черной коровы голштинской породы, были получены четыре клона — Дейзи, Эми, Бетти и Кэтти. Черная корова по имени Аспен славилась молочной продуктивностью, но на момент клонирования ей было 13 лет, у нее давно уже не было телят. Тем не менее возраст донора ядер не помешал получить четверку здоровых клонов. А в 2001 году Дейзи благополучно родила теленка мужского пола. Это пополнило копилку фактов, подтверждающих, что клоны старых животных сами не обязаны быть старыми.
Кошка CC
Кто клонировал: Техасский университет A&M, компания Genetic Savings & Clone
Особенности технологии. Кошачьи яйцеклетки (в отличие от крысиных и собачьих) не доставляли проблем с культивированием. Для клонирования использовали ядро кумулюсной клетки, так как опыты с фибробластами из слизистой полости рта не привели к успеху. Суррогатной матери имплантировали пять эмбрионов — три с ядрами кумулюсных клеток, два с ядрами из клеток слизистой, и в 2001 году родился один котенок. Матери делали кесарево сечение. Донором клетки была кошка по имени Рэйнбоу.
Чем еще замечательна. Сиси (CC) — сокращение от Carbon Copy или Copy Cat (copycat по-английски «подражатель»). Однако самым обсуждаемым вопросом стало именно то, что Копи-Кошка не очень-то похожа на донора ядра. Генетический анализ подтвердил, что она клон, но Рэйнбоу была трехцветной — белой с рыжими и бурыми полосатыми пятнами. А Сиси получилась буро-полосатой с белой грудкой и лапами.
Причина в том, что рыжий или бурый цвет кошачьей шерсти определяется локусом в Х-хромосоме. Но у самок млекопитающих, как известно, Х-хромосом две, и в ходе развития в каждой клетке случайным образом инактивируется одна из двух — обычно в соотношении 1:1, если взять все клетки организма. Когда аллели, отвечающие за цвет, в Х-хромосомах разные, на нынешнем уровне знаний о кошачьем индивидуальном развитии невозможно предсказать, будет ли конкретный участок шкуры темным или рыжим. Что касается генов белых пятен, их фенотипическое проявление возникает за счет нарушения миграции меланоцитов — клеток, продуцирующих пигмент, — во время эмбрионального развития. Процесс тоже не строго детерминированный, но, кстати, белые участки меха у Рэйнбоу и Сиси расположены довольно сходно. Так что генетика, конечно, великая сила, но не следует забывать и об эпигенетике, и о прочих факторах, влияющих на эмбриональное развитие.
Сиси взял к себе домой один из авторов статьи о ней, Дуайн Кремер, и она благополучно прожила в его семье 18 лет.
Лошадь Прометеа
Кто клонировал: Итальянский экспериментальный институт Ладзаро Спалланцани, Италия
Особенности эксперимента. Первая клонированная лошадь Прометеа родилась в итальянском городе Кремона в 2003 году. Источником ядер служили две клеточные линии фибробластов, от кобылы и от жеребца. Из девяти суррогатных матерей благополучно доносила беременность только одна кобыла — та самая, которая была донором фибробластов. Иными словами, она родила собственного близнеца, с ядерным геномом, идентичным своему (митохондриальный геном, конечно, принадлежал другой лошади — донору яйцеклетки). Учитывая все, что было известно об иммунологии беременности, о сложном взаимодействии иммунной системы матери с антигенами плода, это был довольно озадачивающий результат.
Ожидаемо, Прометеа оказалась вполне здоровым животным, в 2008 году сама родила жеребенка.
Пес Снаппи
Кто клонировал: Сеульский национальный университет, Южная Корея
Особенности эксперимента. Первый клон собаки — афганская борзая Снаппи, клонированная в Южной Корее в 2005 году. Имя Snuppy происходит от SNU (Seoul National University). Собачьи яйцеклетки удалось получить только во время эструса, вымыванием из яйцеводов с помощью специального раствора — были проблемы с созреванием яйцеклетки in vitro. Донором клетки кожи, из которой взяли ядро, был пожилой пес, а суррогатной матерью Снаппи — золотистый лабрадор-ретривер, возможно, самая непохожая на детеныша суррогатная мать за всю историю клонирования
Чем еще интересна эта история. В первою очередь — личностью лидера команды. Клонированием первой собаки руководил профессор Хван У Сок, завкафедрой териогенологии и биотехнологии в SNU, который в 2006 году был уволен после громкого скандала. В двух его статьях, 2004 и 2005 года, сообщалось о получении нескольких линий эмбриональных стволовых клеток человека из клонированной бластоцисты для модного в то время терапевтического клонирования. Но сначала выяснилось, что человеческие яйцеклетки были получены с этическими нарушениями, а потом экспериментальные данные оказались фальсифицированными. (Подробности этой некрасивой истории в коллекции статей Nature.)
Казалось бы, карьера Хван У Сока окончена. Но в том же 2006 году он основал фонд биотехнологических исследований Sooam и занялся клонированием животных в научных и коммерческих целях, поставив это дело на поток. Он снова стал публиковаться в рецензируемых журналах, сотрудничать с крупными научными центрами, даже получил государственную поддержку. Именно он — один из авторов статьи 2022 года о клонированных собаках, на которую мы ссылались ранее. Да и собственно Снаппи был настоящим клоном.
Российские читатели могут помнить Хван У Сока и Sooam по начатому в 2012 году сотрудничеству с якутским НИИ прикладной экологии Севера СВФУ — разумеется, чтобы клонировать мамонта. В рамках сотрудничества вывезены килограммы биоматериалов. Хван У Сок добродетельно оговаривался, что «шансы очень малы», но шумихе это не помешало.
Чжун Чжун и Хуа Хуа
Кто клонировал: Институт нейронаук в Шанхае и другие учреждения Китайской академии наук
Особенности эксперимента. С приматами было сложно. Лишь в 2018 году китайские исследователи опубликовали статью о двух идентичных клонах макаки-крабоеда (Macaca fascicularis), которых назвали Чжун Чжун и Хуа Хуа (от «Чжунхуа» — Китай). Они использовали протокол SCNT-ZR, ядра получали из фетальных фибробластов.
Китайская команда не только усовершенствовала технологию переноса ядра, но использовала методы эпигенетического репрограммирования. В ооцит вводили матричную РНК фермента — гистоновой деметилазы, а также обрабатывали его ингибитором гистоновой деацетилазы. Иначе говоря, сняли «репрессирующие» активность генов метиловые метки и помешали снятию «активирующих» ацетиловых меток. Это повысило эффективность клонирования. Из 127 ооцитов получили 109 эмбрионов; 79 эмбрионов подсадили суррогатным матерям, получили шесть беременностей, родились два детеныша. Для сравнения — Долли была единственным ягненком на 227 попыток.
До этой работы многократные попытки клонировать приматов методом SCNT заканчивались неудачей. С другими методами все было не так безнадежно: макака резус по имени Тера была впервые клонирована в 1999 году по протоколу искусственной близнецовости.
Чем еще замечательна эта история. Прежде всего — перспективами для фундаментальных исследований. Через год та же команда сообщила о клонировании макак с CRISPR-отредактированным геномом — нокаутом гена BMAL1, важного элемента циркадных часов. Таких животных авторы предложили использовать для исследования расстройств циркадных ритмов. Подобную модификацию можно получить и без помощи клонирования, но клоны будут генетически идентичны.
Много говорят о клонировании вымерших и вымирающих видов, но успехи пока скромные. Как мы видим, даже при использовании свежего клеточного материала эффективность клонирования млекопитающих невысока. А если ядро получено из давно хранящегося биоматериала, к тому же донор ядра и суррогатная мать принадлежат к другому виду или подвиду, все многократно усложняется. О клонировании вымершего подвида горного козла — пиренейского козерога (Capra pyrenaica pyrenaica) мы писали. Клон родился в Испании, в 2003 году и погиб практически сразу после рождения из-за тяжелой врожденной патологии легких. Пока это единственная попытка клонирования вымершего таксона.
Здесь в заключение мы рассмотрим две вдохновляющие истории: с замороженным биоматериалом и межвидовым клонированием.
Курт, лошадь Пржевальского
Кто клонировал: проект Revive & Restore, ViaGen Pets and Equine и зоопарк Сан-Диего (San Diego Zoo Global - SDZG).
Особенности эксперимента. Курт родился в августе 2020 года. Он был клонирован из клеточного материала жившего в неволе жеребца, который заложили на хранение в криобанк SDZG в 1980 году — специалисты уже тогда тревожились о снижении биоразнообразия лошади Пржевальского. Из замороженной кожи культивировали фибробласты. Донором яйцеклетки и суррогатной матерью были домашние лошади. В феврале 17 февраля 2023 года из той же клеточной линии клонировали второго жеребенка, которого назвали Олли. Когда Курт и Олли вырастут, они присоединятся к табуну в зоопарке и вернут в генофонд вида утраченные гены.
Элизабет Энн, черноногий хорек
Считалось, что американский черноногий хорек Mustella nigripens вымер из-за сокращения численности луговых собачек (его основной пищевой базы), инфекционных болезней и последствий накопления DDT-подобных пестицидов в трофических цепочках прерийных экосистем. Однако в 1981 году была обнаружена последняя дикая популяция. Энтузиасты отловили 18 хорьков и запустили программу разведения в неволе. К 2018 году хорьков было около 300, и в их геномах были явные признаки инбридинга. В такой ситуации даже одна новая особь — большая ценность.
Кто клонировал: проект Revive & Restore, ViaGen Pets and Equine и зоопарк Сан-Диего (San Diego Zoo Globa).
Особенности эксперимента. Элизабет Энн родилась в 2020 году. В качестве донорского ядерного материала использовались замороженные клетки самки по кличке Уилла, которая не оставила живых потомков. Геном Уиллы характеризуется почти в три раза более высоким генетическим разнообразием, чем вся нынешняя популяция черноногих хорьков. Суррогатной матерью была самка обычного домашнего хорька фуро. Беременность проходила непросто, детеныш появился на свет в результате кесарева сечения.
В отличие от других черноногих хорьков, Элизабет Энн никогда не выпустят в естественное местообитание. У нее не будет детенышей, так как ее пришлось стерилизовать из-за гидрометры — распространенного у животных заболевания матки. Но теперь появился дополнительный шанс вернуть эту генетическую линию к жизни. Также у участников проекта есть клетки самца черноногого хорька.
 Элизабет Энн в возрасте одного года |
wikimedia.org
Элизабет Энн в возрасте одного года |
wikimedia.org
Какой же опыт получило человечество, имея почти сорокалетнюю историю создания клонов? К каким заключениям пришло научное сообщество?
Во-первых, полная генетическая идентичность при репродуктивном клонировании — принципиально недостижимая цель, поскольку митохондриальный геном репродуктивного клона так или иначе происходит от реципиентного ооцита. Но и ядерный геном клона не будет полностью идентичен геному донора по причине спонтанного мутационного процесса и сестринских хроматидных обменов. Эпигеном клонов тоже ожидаемо различается.
Эффективность репродуктивного клонирования остается низкой. Обычно это считаные проценты от числа оперированных зигот. Клонированные особи часто погибают в перинатальный период (то есть непосредственно перед родами, во время родов и в первые недели после рождения). Причины гибели — тяжелые врожденные патологии нервной, дыхательной, пищеварительной и эндокринной систем. Пороки развития возникают из-за ошибок в процессе репрограммирования соматического генома, а также из-за эпигенетических сбоев при последующем «включении» тканеспецифичных или времяспецифичных (time- and stage-specific) генов.
Однако несмотря на все биотехнологические и биоэтические трудности, человечество продолжает клонировать млекопитающих. Возникает естественный вопрос: зачем? Рассмотренные выше примеры могут подсказать ответы.
Клонирование позволяет получить особей с ценными генетическими характеристиками, которых нельзя или сложно получить иным способом — будь то сельскохозяйственное животное или представитель вымирающего вида.
Животные с идентичными ядерными геномами могут быть ценным объектом исследований.
Сама процедура клонирования, разработка новых протоколов важна для фундаментальной науки, поскольку приносит информацию о механизмах эмбрионального развития, регуляции генома и эпигенома и т.д. В процессе клонирования возникают новые исследовательские контексты и формулируются новые исследовательские задачи.
Наконец, клонирование может приносить прибыль независимо от того, насколько оно практически полезно. Люди готовы платить большие деньги за копию скаковой лошади или обожаемого домашнего питомца, а где спрос, там и предложение.
С другой стороны, сделать трудное или невозможное (также независимо от того, насколько это практически полезно) — важная мотивация для исследователя. Может быть, когда-нибудь клонируют и мамонта, и тасманийского волка — именно потому, среди прочих причин, что это очень трудно.








 Меню
Меню





 Все темы
Все темы






 0
0