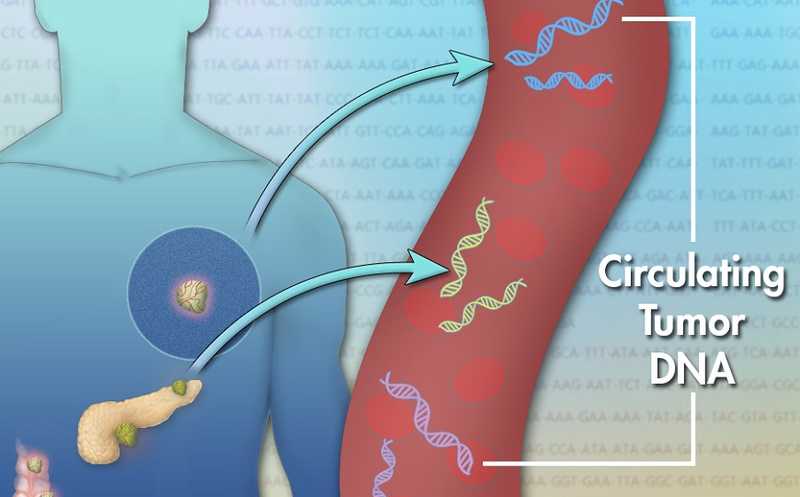
Итоги-2023. Лекарство от ожирения и прикладная эмбриология
На первый взгляд итоги скучноватые: ни ксенотрансплантации, ни младенцев с отредактированными геномами. Зато есть долгосрочные проекты, которые созрели и приносят плоды, от «нобелевских» мРНК-вакцин до полезных препаратов, снижающих вес, генной CRISPR-терапии и прецизионных методов лечения, основанных на иммунных механизмах. И есть проекты, от которых можно ждать чудес в будущем, например, клеточные атласы мозга или пангеном человека. А еще вспоминаем мышь, рожденную от двух отцов, и новый способ хранения и обработки данных в ДНК.

Некомплементарная коммутация олигонуклеотидов
Год начался с бурного обсуждения сольной статьи Максима Никитина (МФТИ, НТУ «Сириус») в журнале Nature Chemistry — о возможности хранения, обработки и передачи информации за счет слабого взаимодействия частично комплементарных цепей нуклеиновых кислот, которое Никитин назвал «коммутацией». «…Возникает вопрос, хранятся ли какие-либо другие данные в ДНК в нетрадиционной форме, т.е. вне современной парадигмы двойной спирали, комплементарности и генетического кода? Если да, то каковы будут основные механизмы? Поскольку за последние 65 лет такая форма не была идентифицирована in vivo, возможно, прежде всего ее необходимо воссоздать искусственно in vitro».
 Максим Никитин во время лекции на химическом факультете МГУ. Фото: Наталья Демина
Максим Никитин во время лекции на химическом факультете МГУ. Фото: Наталья Демина
В рамках подхода, предложенного Никитиным, рассматриваются континуумы аффинности — олигонуклеотид образует комплексы с разными олигонуклеотидами, причем у этих комплексов различные значения константы диссоциации. Например, цепь А взаимодействует с цепью В прочнее, чем с цепью M; она может обратимо образовывать комплекс АМ в отсутствие более «подходящих» партнеров, но появление В разрушит этот комплекс. Подобная система может быть описана набором нелинейных уравнений, при этом число молекул, вовлеченных во взаимодействия, может быть очень велико. Термин «коммутация» подразумевает, что две цепи, не комплементарные друг другу, взаимодействуют через цепи, комплементарные им обеим.
Максим Никитин продемонстрировал в экспериментах in vitro, что принцип коммутации позволяет создавать логические элементы, выполнять вычислительные операции быстрее и проще, чем известные системы для ДНК-компьютинга. Но главное, работа Никитина дает повод задуматься о коммутации в живой клетке. В принципе, таким путем любой олигонуклеотид может быть превращен в специфический сигнал, контролирующий экспрессию того или иного гена, независимо от того, комплементарен ли он его последовательности. Низкоаффинные взаимодействия олигонуклеотидов могут быть ответственны и за нецелевые эффекты лекарств, и за всевозможные естественные процессы — «от кратковременной памяти до рака, старения и эволюции», говорится в статье.
Пангеном человека
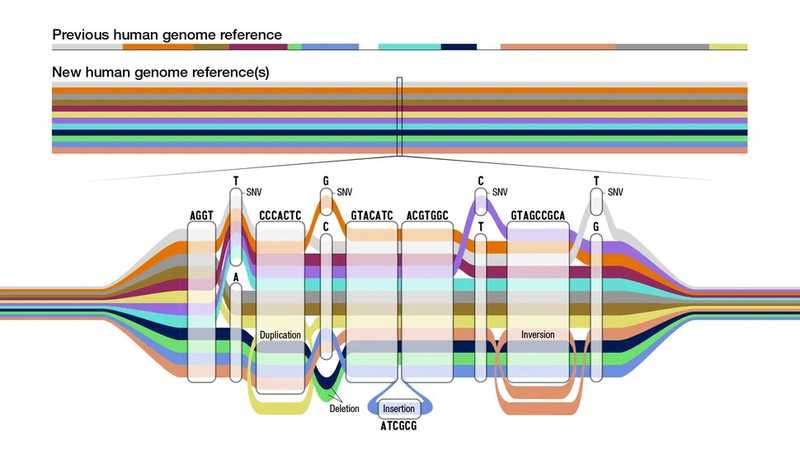
Консорциум референсного пангенома человека (Human Pangenome Reference Consortium, HPRC) опубликовал в журналах Nature первый черновик человеческого пангенома.
Пангеномные подходы призваны восполнить недостатки, свойственные геномным методам. Так, референсные последовательности человеческого генома зачастую имеют одно и то же происхождение — и потому не отражают всего генетического разнообразия человека. Его можно учесть при помощи пангеномного графа, который содержит различные варианты последовательности ДНК. Такой граф, основанный на геномах людей из разных уголков планеты, создали исследователи HPRC.
 Сredit: Darryl Leja, NHGRI
Сredit: Darryl Leja, NHGRI
Сейчас он основан на 47 диплоидных сборках геномов разных людей, а в 2024 году их число планируют расширить до 350, чтобы достовернее отобразить генетическое разнообразие человека и включить редкие аллельные варианты.
Ученые не только создали референсный пангеном человека, но и предложили ряд его возможных применений. Так, картирование на него позволит более точно обнаруживать малые геномные вариации. Генотипирование структурных вариаций и анализ тандемных повторов — еще два направления, в которых мог бы пригодиться пангеном. Применение пангенома ценно и для секвенирования РНК: частота ложных картирований на пангеномный граф существенно ниже, чем на линейный референс. Кроме того, пангеном человека уже применили в качестве референса при изучении рекомбинаций между негомологичными хромосомами.
Развивается и геномика других видов приматов. Специальный выпуск журнала Science посвящен исследованию геномов 233 видов обезьян и полуобезьян (в общей сложности 86% всех существующих на сегодняшний день родов).
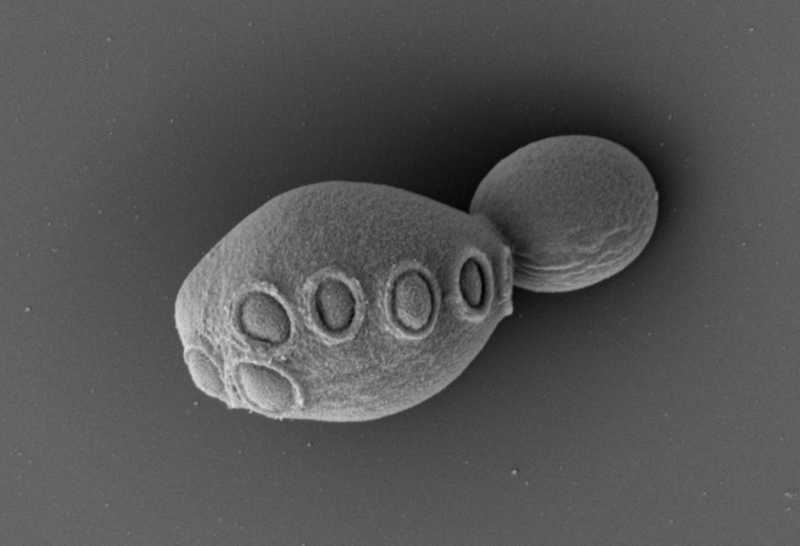
Дрожжи с синтетическим геномом
Международный консорциум Sc2.0 (Saccharomyces cerevisiae, версия 2) собрал все 16 хромосом пекарских дрожжей. Кроме того, ученым удалось объединить семь с половиной синтетических хромосом в одной функциональной клетке.
 Credit: Cell/Zhao et al. | CC BY-SA
Credit: Cell/Zhao et al. | CC BY-SA
«Мы решили, что важно создать что-то сильно измененное по сравнению с замыслом природы», — комментирует Джеф Буке, руководитель Sc2.0 и специалист по синтетической биологии из NYU Langone Health (Нью-Йорк). Для создания синтетического дрожжевого генома ученые удалили из него «мусорные» участки — мобильные элементы, интроны, повторы, а также добавили фрагменты ДНК, позволяющие отличить синтетический участок генома от нативного.
Сначала исследователи получили каждую из 16 синтетических хромосом дрожжей по отдельности. С их помощью они создали 16 штаммов, каждый из которых содержал 15 природных хромосом и одну синтетическую. Эти штаммы затем скрещивали между собой. Таким способом ученые получили дрожжевую клетку, содержащую шесть полных синтетических хромосом и плечо еще одной — это более 31% генома.
Авторы работы протестировали и другой подход — двухэтапную замену хромосомы. Сначала в штамм вводили синтетическую хромосому, а затем дестабилизировали нативную. Это позволило исследователям заменить более 50% генома дрожжей на синтетический — всего 7,5 хромосом. Повысить приспособленность дрожжевой клетки с синтетическим геномом им удалось при помощи CRISPR — так ученые удалили «ошибки кода», снижающие жизнеспособность.
Атласы мозга человека и мыши
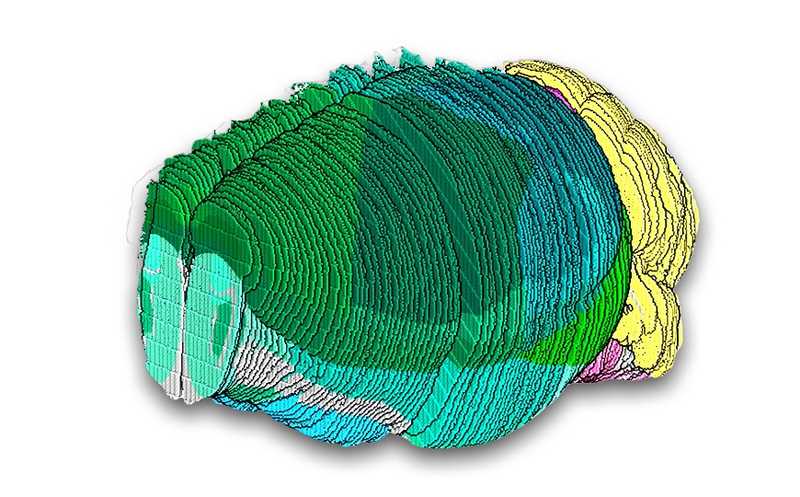
Секвенирование единичных клеток изобрели не вчера, но в 2023 году начали приносить плоды долговременные проекты, такие как Атлас клеток человека (Human Cell Atlas). Его задачи — типировать каждую клетку человека, идентифицировать новые типы клеток и создать новое понимание их функций. Аналогичные проекты есть для макаки-крабоеда, дрозофилы и других модельных объектов.
«Первый черновик» атласа мозга человека, по словам Стена Линнарссона из Каролинского института, уже используют ученые всего мира. Это результат работы международной инициативы BRAIN (Brain Research Through Advancing Innovative Neurotechnologies), которая является частью пятилетнего проекта BRAIN Initiative Cell Census Network (BICCN). Результаты работы представляет серия статей, вышедшая в октябре в журналах группы Science. Участники проекта охарактеризовали типы, функции и разнообразие клеток в мозге взрослого человека и показали, как мало мы знаем об областях за пределами коры — ведь именно там обнаружили две трети типов клеток. Они также скомбинировали анализ метилирования ДНК и конформации хроматина на уровне единичных клеток, изучили паттерны метилирования ДНК, лежащие в основе нейропсихиатрических состояний, проследили процесс эмбрионального развития мозга. В атлас вошла информация не только о клетках мозга человека, но и других приматов.
Проект BICCN представил также атлас мозга мыши. В задачи проекта входила классификация клеток мышиного мозга по подтипам, определение их точной локализации и отслеживание изменений в течение жизни. Атлас включил транскриптомные, эпигеномные и пространственные характеристики более 32 миллионов клеток. Исследователи показали ассоциации между геномной идентичностью клеток и их локализацией, различия между «молодыми» и «старыми» структурами мозга, проследили связи головного мозга со спинным, сравнили регулировку генной активности в мозге разных видов млекопитающих, составили атлас кандидатных цис-регуляторных элементов ДНК, атлас метиломов и многое другое.
 Credit: Macosko and Chen labs, Broad Institute of MIT and Harvard |
Пресс-релиз
Credit: Macosko and Chen labs, Broad Institute of MIT and Harvard |
Пресс-релиз
Оземпик и компания: новые препараты против нарушений метаболизма
Семаглутид (Оземпик, Вегови) и другие агонисты рецептора глюкагоноподобного пептида-1 (GLP-1R) постоянно оказывались в центре внимания в 2023 году. Изначально препараты этого типа были одобрены для контроля уровня глюкозы при диабете 2 типа и для снижения веса, однако по мере того как завершаются клинические испытания, ученые находят у них все больше преимуществ.
 Credit: 123rf.com
Credit: 123rf.com
Клинические испытания показали, что семаглутид уменьшает частоту серьезных неблагоприятных сердечно-сосудистых событий, включая смерть от сердечно-сосудистых заболеваний, несмертельные инфаркты миокарда и инсульты, как у людей с диабетом, так и без.
Этого можно было ожидать от лекарства для похудания, но есть данные поинтереснее. Так, люди, принимающие семаглутид, рассказывали, что их меньше тянет к алкоголю. Клинических исследований пока не проводили, но опыты на крысах подтверждают эти анекдотические свидетельства. Животные, получавшие препарат, потребляли в два раза меньше алкоголя. Он также уменьшал частоту «срывов», когда после периода без алкоголя крыса пьет больше, чем раньше. Вероятнее всего, дело в том, что семаглутид влияет на систему вознаграждения мозга. Алкоголь активирует эту систему, вызывая выработку дофамина, а препарат блокирует процесс, что снижает тягу к алкоголю.
Более того, семаглутид обладает противовоспалительным действием. Его механизмы исследовала группа под руководством Дэниэла Друкера, одного из пионеров в этой области и председателя Banting & Best Diabetes Centre компании Novo Nordisk, производящей Оземпик и Вегови. Оказывается, агонисты GLP-1R ослабляют опосредованное Т-клетками кишечное воспаление, взаимодействуя с рецепторами-мишенями на внутриэпителиальных лимфоцитов кишечника. Но воспаление в других органах и тканях они снижают через GLP-1R нейронов центральной нервной системы.
Много пишут и о побочных эффектах этих препаратов, в первую очередь о тех, что затрагивают желудочно-кишечный тракт. Например, было показано, что риск панкреатита при приеме агонистов GLP-1R в девять раз выше, чем при приеме бупропиона, препарата для похудения предыдущего поколения. Риск непроходимости кишечника выше в четыре раза, а гастропареза — более чем в три раза. Однако эти осложнения встречаются редко, а преимущества для людей с ожирением в большинстве случаев перевешивают риски.
Давнее исследование показало, что долговременное воздействие агонистов GLP-1R ассоциировано с C-клеточной гиперплазией и опухолями щитовидной железы. Повышение риска наблюдался у грызунов, но не у макак и людей. Тем не менее Оземпик не рекомендуется принимать людям с медуллярным раком щитовидной железы в анамнезе или семейной истории.
В ноябре 2023 года в Бельгии запретили продажу Оземпика для людей без диабета на фоне недостатка препарата. Это показывает, насколько востребованы агонисты GLP-1R среди людей, надеющихся сбросить вес.
Нобелевская премия и мРНК-вакцины
Нобелевскую премию по физиологии или медицине 2023 года вручили Каталин Карико и Дрю Вайсману (Пенсильванский университет) «за их открытия, касающиеся модификаций нуклеозидов, использованных для разработки эффективных мРНК-вакцин против COVID-19».
 Credit: 123rf.com
Credit: 123rf.com
Если поместить в клетку немодифицированную мРНК, то мы получим небольшое количество белка, который быстро деградирует. Однако мРНК с модифицированным уридином, например, с псевдоуридином, транслируется намного эффективнее и не вызывает воспалительный ответ. Об этом открытии подробно рассказала Каталин Карико во время Нобелевской недели. Дрю Вайсман же напомнил историю создания вакцин, перечислил особенности мРНК-вакцин и перспективы их применения.
 Credit: Скриншот
канала Нобелевского комитета
Credit: Скриншот
канала Нобелевского комитета
 Credit: Скриншот
канала Нобелевского комитета
Credit: Скриншот
канала Нобелевского комитета
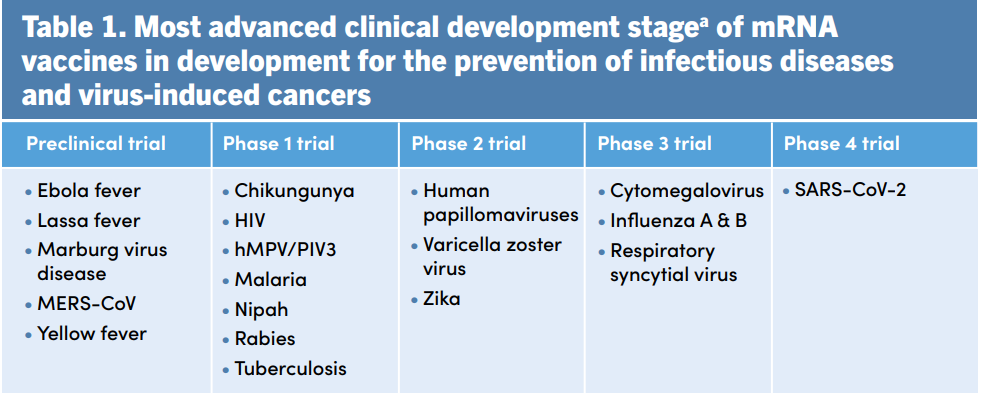
Что касается перспектив — ВОЗ одобрила только использование вакцин против коронавирусной инфекции, но на подходе целый ряд вакцин, многие из которых дошли до стадии клинических испытаний. Это в основном вакцины против вирусов и ассоциированных с вирусами раков. На стадии доклиники находятся вакцины от вирусов Эболы, Ласса и Марбурга, фазу 1 прошли или проходят вакцины от вирусов чикунгунья, бешенства, Нипах, ВИЧ, фазу 2 — вакцина против вируса Зика, фазу 3 — против вируса гриппа, цитомегаловируса и респираторно-синцитиального вируса (РСВ). В январе 2023 года компания Moderna объявила, что вакцина mRNA-1345 против РСВ защитила людей старшего возраста от по крайней мере двух симптомов заболевания с эффективностью 83,7%. Будем внимательно следить за прогрессом в этой области.
 Credit:
WHO
Credit:
WHO
CRISPR-Cas терапия: первые одобрения
В Великобритании, а затем и в США одобрили CRISPR-Cas9-терапию серповидноклеточной анемии. Препарат компаний CRISPR Therapeutics и Vertex получил название Casgevy (exa-cel). Терапия заключается в ex vivo редактировании аутологичных гемопоэтических стволовых клеток и клеток-предшественников (CD34+). С помощью CRISPR-Cas9 в них редактируют энхансер гена BCL11A (он кодирует транскрипционный фактор, блокирующий экспрессию фетального гемоглобина) и затем возвращают клетки в организм. Благодаря этому в эритроцитах, которые развиваются из этих клеток, появляется фетальный гемоглобин.
В августе 2019 года компании сообщили о начале экспериментального лечения, а сейчас в клиническом исследовании принимают участие 45 человек. Для 29 из них уже проанализировали промежуточные результаты — у подавляющего большинства не менее чем на год прекратились характерные болевые приступы (вазооклюзионные кризы). Обнадеживающие результаты получены и для терапии бета-талассемии при помощи Casgevy: 39 из 42 участников исследований как минимум год не нуждались в переливании эритроцитов, а у остальных эта потребность существенно снизилась.
В Великобритании Casgevy получил «условное разрешение на продажу» (аналог временного регистрационного удостоверения) для лечения серповидноклеточной анемии и бета-талассемии. В США он одобрен пока только для первого из двух заболеваний, а решение FDA по применению Casgevy против бета-талассемии ожидается к 30 марта 2024 года.
 Credit: 123rf.com
Credit: 123rf.com
Фазу 1-2 клинических исследований прошла и другая генная терапия серповидноклеточной анемии. Она также основана на ex vivo редактировании с помощью CRISPR-Cas9, однако изменению подвергались участки связывания BCL11A на промоторах генов гамма-гемоглобина. Терапевтический продукт под названием OTQ923 вводили трем пациентам. Процент фетального гемоглобина после такой трансплантации возрос с 0,4–4,2% до 19–26,8%.
Новая вакцина от малярии — R21/Matrix-M
В XXI веке все еще не побеждена малярия, болезнь, от которой ежегодно умирает около полумиллиона детей, главным образом в Африке южнее Сахары. Создать эффективную вакцину против малярийного плазмодия долгое время не удавалось. В октябре ВОЗ рекомендовала широкое использование второй вакцины против малярии, R21/Matrix-M (R21/MM). Еще в 2021 году фаза 2 клинических испытаний показала, что она может стать первой вакциной, соответствующей ключевому требованию ВОЗ (эффективность в предотвращении заболевания не менее 75%): эффективность R21/MM составила 77%. Такого результата помогла достичь высокая доза адъюванта Matrix-M на основе сапонина, разработанного компанией Novavax. Этот адъювант содержит и противоковидная вакцина Novavax — первая успешная белковая вакцина от инфекции SARS-CoV-2. Третья фаза КИ подтвердила приемлемую эффективность R21/MM; в младшей возрастной группе во время сезона она достигла 79%.
Не менее 28 стран разработали планы по внедрению вакцин в рамках своих программ борьбы с малярией. Одобренной в 2021 году вакцины Mosquirix (RTS,S) не хватает: ожидается, что до 2025 года будет доступно всего около 18 миллионов доз, к тому же она существенно уступает R21/MM в эффективности. Новая вакцина недорогая; Индийский институт сыворотки заявил, что сможет производить до 100 млн доз в год.
Обе вакцины, и R21/MM, и Mosquirix, — белковые. Вакцина R21, разработанная в Оксфордском университете, содержит поверхностный антиген гепатита B, сшитый с участками белка CSP (NANP), который секретирует спорозоит малярийного плазмодия. Вакцинный белок нарабатывают в дрожжах Hansenula polymorpha, где он собирается в вирусоподобные частицы.
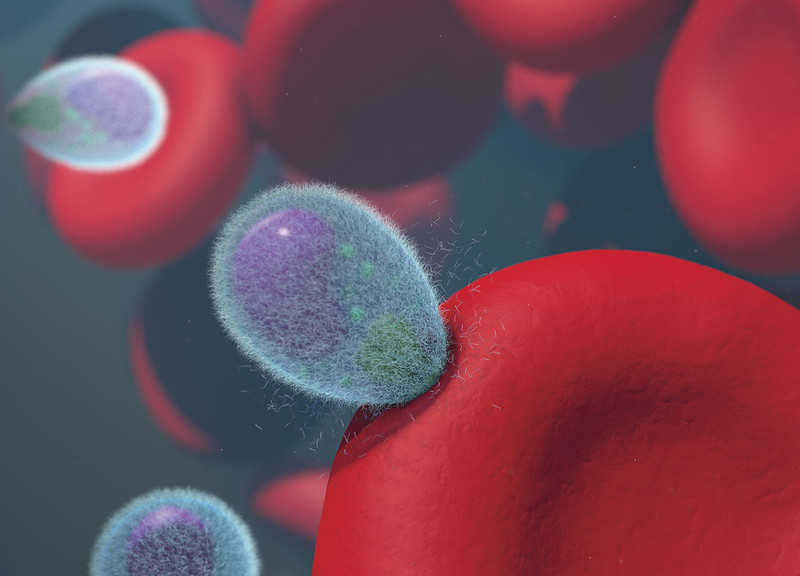 Мерозоит малярийного плазмодия проникает в эритроцит. Credit:
NIAID
Мерозоит малярийного плазмодия проникает в эритроцит. Credit:
NIAID
Конъюгаты антитело-лекарство (ADC)
Сравнительно новый класс противораковых лекарств, сочетающих высокую эффективность и высокую специфичность — конъюгаты антитело-лекарство (antibody-drug conjugates, ADC). Моноклональные антитела, к которым пришиты цитотоксические молекулы, действуют как «волшебные пули», избирательно убивающие раковые клетки. С одобренными к середине 2023 года ADC можно познакомиться в обзоре Nature. Об их перспективности лучше всего говорит интерес крупнейших фармкомпаний, таких как GlaxoSmithKline, Bristol-Myers Squibb, MSD.
Успех этого года — PADCEV (энфортумаб ведотин, Astellas Pharma). В октябре, когда Томас Паулз, исследователь рака в больнице Святого Варфоломея и Лондонском университете королевы Марии, представил результаты клинических исследований на Конгрессе Европейского общества медицинской онкологии в Мадриде, его дважды прерывали аплодисментами. Комбинация PADCEV и Китруды (пембролизумаба) компании Merck почти удвоила среднюю продолжительность жизни людей с запущенным раком мочевого пузыря после лечения по сравнению с традиционной химиотерапией — с 16 до 31,5 месяцев. При данном диагнозе стандартное химиотерапевтическое лечение применялось с 1980-х годов, и улучшить результат не удавалось, так что это действительно долгожданный прорыв. ( Результаты других КИ на сайте препарата.)
Про энфортунаб ведотин PCR.NEWS писал два года назад. Препарат состоит из антитела, нацеленного на белок нектин-4, экспрессия которого повышена в раковых клетках некоторых типов, и химического вещества, нарушающего деление клеток.
Пятнадцатого декабря FDA США одобрило PADCEV в сочетании с Китрудой для пациентов с местно-распространенным или метастатическим уротелиальным раком. Ранее FDA предоставило ускоренное одобрение этой комбинации для пациентов с данными типами рака, которым не показана химиотерапия цисплатином.
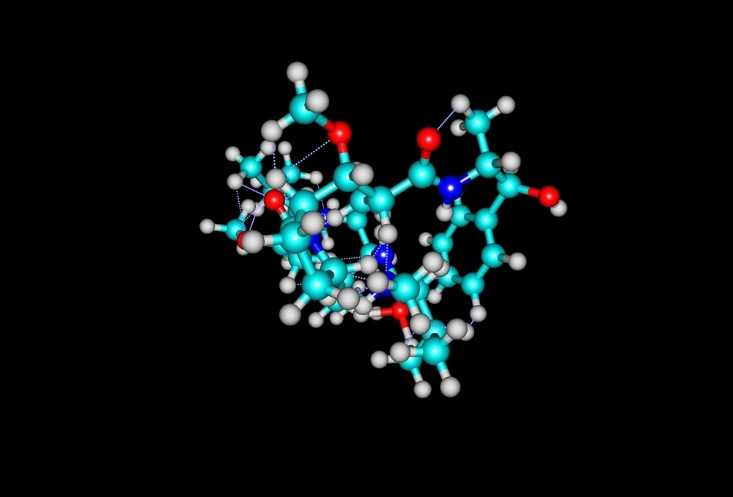 Монометил-ауристатин Е — агент, нарушающий образование микротрубочек и подавляющий деление, — входит в состав PADCEV. Credit: 123rf.com
Монометил-ауристатин Е — агент, нарушающий образование микротрубочек и подавляющий деление, — входит в состав PADCEV. Credit: 123rf.com
Терапия аутоимммунных заболеваний
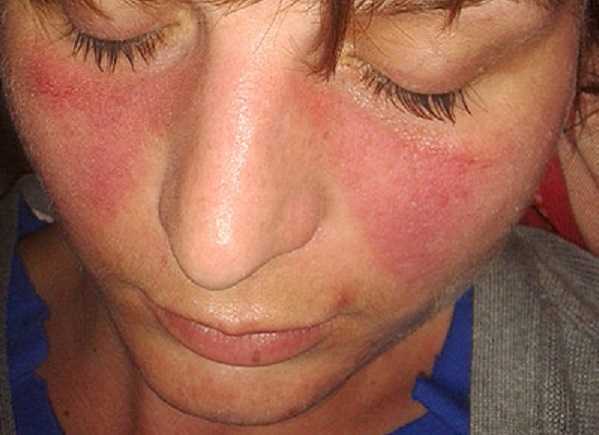
Системная красная волчанка — тяжелое аутоиммунное заболевание, преимущественно поражающее молодых женщин. Надежной стратегии для достижения безмедикаментозной ремиссии до сих пор не было.
 Credit: Doktorinternet. CC BY-SA 4.0,
wikimedia.org
Credit: Doktorinternet. CC BY-SA 4.0,
wikimedia.org
Команда под руководством Георга Шетта из Университета Эрланген-Нюрнберг (Германия), разработала CAR-T-терапию, нацеленную на CD19+-клетки (В-лимфоциты, производящие антитела). В 2021 году они описали ремиссию у 20-летней женщины с тяжелой рецидивирующей формой волчанки. В 2022 году опубликовали результаты исследований уже шести пациентов; у всех удалось добиться стабильной ремиссии.
В этом году Георг Шетт с коллегами представили новый интересный результат на ежегодном собрании Американского колледжа ревматологии (позднее он был опубликован). Оказалось, что лечение волчанки CAR-T-клетками, подавляющими образование аутоантител, не «стирает» ответ на вакцины, несмотря на то, что при терапии из крови исчезают В-лимфоциты. Как объясняет Георг Шетт, некоторые долгоживущие клетки, способные продуцировать антитела (в том числе антитела против вакцинных антигенов), являются CD19-негативными, поэтому CAR-T-клетки их не убивают. Пациентов теперь восемь, и на момент доклада у всех продолжалась ремиссия.
А российские исследователи (РНИМУ им. Н.И.Пирогова, Институт биоорганической химии РАН, компания BIOCAD) описали случай длительной ремиссии при болезни Бехтерева. Пациент получал инфузии моноклонального антитела против семейства Т-клеток TRBV9; в состав этого семейства входят агрессивные клоны, вызывающие заболевание. До этого были испытаны различные терапевтические подходы, вплоть до аутологичной трансплантации гемопоэтических стволовых клеток, но стойкой ремиссии добиться не удавалось. Теперь она продолжается четыре года. На основании данной разработки создан терапевтический препарат, и для него одобрена фаза 3 клинических исследований.
Плюс такого подхода в том, что терапия не подавляет иммунную систему в целом. Но поиск клонов иммунных клеток, вовлеченных в заболевание, — сложная задача, требующая специальных биоинформатических подходов. Болезнь Бехтерева с этой точки зрения — наиболее «простое» аутоиммунное заболевание, отмечает один из соавторов работы Дмитрий Чудаков.
Антитела против болезни Альцгеймера
В начале года леканемаб — моноклональное антитело к протофибриллам бета-амилоида от компаний Eisai и Biogen — получил одобрение FDA. Этот препарат призван замедлить прогрессирование болезни Альцгеймера. В фазе 3 КИ, которая продолжалась 18 месяцев, он снижал уровень амилоида на ранней стадии развития заболевания, ограничивал снижение когнитивных и функциональных показателей у пациентов. Первичная конечная точка в исследовании — изменение баллов по шкале оценки клинической деменции (CDR-SB). Баллы по этой шкале лежат в диапазоне от 0 до 18, более высокий балл указывает на более серьезное ухудшение. За 18 месяцев среднеквадратичное отклонение от исходного уровня составило 1,21 при использовании леканемаба и 1,61 в группе плацебо.
 Credit: 123rf.com
Credit: 123rf.com
Несмотря на достижение статистически значимого эффекта, радоваться рано. Препарат способен вызывать серьезные нежелательные явления, включая отек мозга и кровотечения. Побочные эффекты леканемаба стали причиной смерти минимум трех участников КИ.
Другое моноклональное антитело против болезни Альцгеймера — донанемаб от компании Eli Lilly — также прошло фазу 3 клинических исследований. В январе сообщалось, что FDA не будет одобрять донанемаб из-за недостатка данных о пациентах, принимавших его более года. Однако тогда речь шла о результатах фазы 2 КИ — 40% ее участников избавлялись от амилоидных бляшек за полгода и прекращали терапию.
Третья фаза КИ длилась 19 месяцев. Изменение баллов CDR-SB за это время составило 1,72 при использовании донанемаба и 2,42 в группе плацебо. При исключении из выборки пациентов с высоким уровнем тау-белка численные показатели были чуть ниже (1,20 и 1,88, соответственно), значимая разница между ними сохранялась. Тем не менее у пациентов также отмечались связанные с амилоидом нарушения в виде отека или выпота, которые чаще встречались в группе донанемаба, а три смерти в этой группе (и одну — в группе плацебо) признали связанными с лечением.
В начале года компания Eli Lilly сообщала, что планирует подать заявку на одобрение препарата по результатам фазы 3.
Чудеса эмбриогенеза
Группа Кацухико Хаяси, который сейчас работает в Университете Осаки, получила мышь от двух отцов.
Ранее эта же команда исследователей вырастила из плюрипотентных стволовых клеток мыши ооцитоподобные клетки, а затем и зрелые яйцеклетки. При оплодотворении из них развивались здоровые мышата. Но кто сказал, что исходные клетки должны принадлежать только самке?
Первичные зародышевые клетки с набором XY могут проходить начальные стадии дифференцировки в ооциты, однако на поздних стадиях оогенез нарушается из-за неправильного спаривания половых хромосом при мейозе и ингибирующего действия генов Y-хромосомы. Нужно избавиться от Y-хромосомы и удвоить X-хромосому. К счастью (в этом случае к счастью, обычно это проблема), при выращивании плюрипотентных стволовых клеток in vitro часто возникает анеуплоидия. Эмбриональные стволовые клетки многократно пассировали, и в конце концов удалось получить клетки с кариотипом XX, а дальше по уже проверенному протоколу из них вырастили яйцеклетки. Затем опыты повторили с индуцированными плюрипотентными стволовыми клетками (иПСК), которые образовались из фибробластов с кончика хвоста самцов мыши. Яйцеклетки оплодотворили, двухклеточные эмбрионы перенесли суррогатным матерям и получили здоровое и фертильное потомство. Правда, эффективность процесса невысока: 7 на 630 трансплантаций.
 Credit: 123rf.com
Credit: 123rf.com
Пока не удалось вырастить жизнеспособные эмбрионы из сперматозоидов и яйцеклеток, полученных из клеток одного самца, возможно, из-за специфических для пола импринтинговых меток в ДНК. Тем не менее эта технология может помочь, например, спасти вымирающий вид, даже если остался один самец (при условии, что есть самка близкородственного вида, которая выносит эмбрион).
Еще одно достижение 2023 года — получение химерных макак-крабоедов, часть клеток которых светится зеленым благодаря экспрессии зеленого флуоресцентного белка (GFP). Классический способ проверки того, насколько иПСК похожи на клетки эмбриона, — получение химер, у которых часть клеток замещают иПСК. До сих пор опыты на приматах были не слишком успешными, доля генетически отличных клеток в химерах оставалась крайне низкой (0,1–4,5%). Авторы оптимизировали протоколы культивирования, чтобы получить плюрипотентные клетки, более сходные с клетками эмбриона, и тем самым предотвратили их элиминацию.
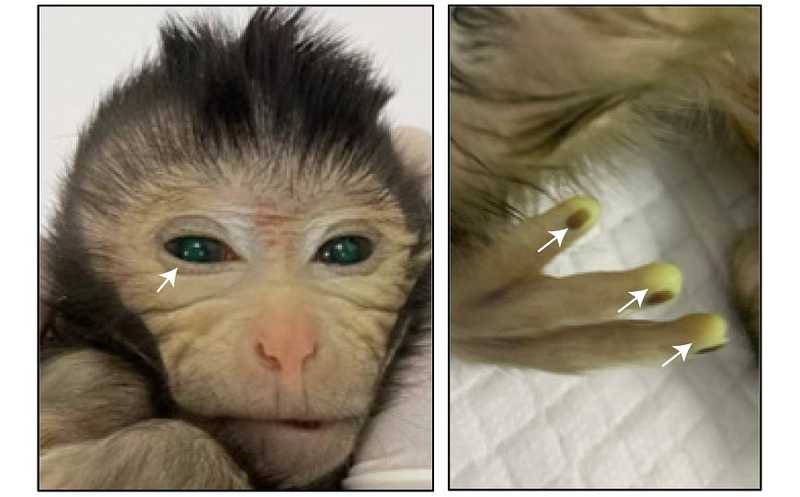 Зеленая флуоресценция в организме детеныша. Credit: Cell/Cao et al. |
Пресс-релиз
Зеленая флуоресценция в организме детеныша. Credit: Cell/Cao et al. |
Пресс-релиз
Химерных эмбрионов было 206, в итоге удалось получить 4 абортированных плода и 6 живорожденных детенышей. Экспрессия GFP наблюдалась у двух плодов, у одного из живорожденных — во всем теле, особенно на кончиках пальцев, в хвосте и глазах. Средний вклад донорских клеток составил 63–67%; они присутствовали и в тканях семенников. Однако через десять дней после рождения детеныша пришлось усыпить из-за плохого состояния. Авторы предполагают, что причиной низкой выживаемости химер может быть различие в метилировании клеток разного происхождения.
А израильские исследователи под руководством Якоба Ханны из Вейцмановского института в Реховоте разработали модель человеческого эмбриона после имплантации. Она получена из стволовых клеток (то есть не требует использования оплодотворенных яйцеклеток или абортивного материала) и успешно развивается до стадии, соответствующей 13–14 дням после оплодотворения. Исследовать эмбриогенез после имплантации в матку технически сложно, кроме того, это противоречит этическим нормам. В то же время именно на начальных стадиях чаще всего происходит прерывание беременности. Поэтому для исследований нужны синтетические модели эмбрионов. Их выращивают в специальном вращающемся барабане с контролируемыми давлением и уровнями газов, который опробовали на мышах еще в 2021 году. В модели присутствуют все характерные клеточные линии, и они своевременно и адекватно формируют основные эмбриональные структуры.
Итоги-2022. Древняя ДНК и генная терапия
Итоги-2021. мРНК-вакцины и судебные процессы
Итоги-2020. COVID-19 и AlphaFold








 Меню
Меню





 Все темы
Все темы






 0
0