Нобелевская неделя 2023. Дрю Вайсман: «Потому что мы были сумасшедшими, и все это знали»
«Он ворвался ко мне в офис и спросил: “Что вы сделали с этими образцами? Невозможно получить настолько высокий титр”. Он обвинил меня в том, что я дал ему фальсифицированные образцы, чтобы подпортить ему жизнь». — Лекция лауреата Нобелевской премии 2023 года по физиологии или медицине Дрю Вайсмана.

Дрю Вайсман начинал свою карьеру ученого с исследования дендритных клеток. Во время этой работы зародился его интерес к вакцинам — дендритные клетки, будучи антигенпрезентирующими, являются одной из основных мишеней вакцин. «Я хотел разработать метод, который позволил бы “загружать” [антигены] в дендритные клетки и таким образом создать более эффективные вакцины, — говорит Вайсман. — У меня в распоряжении были все методы, которые я только мог придумать, кроме мРНК. И вот тогда мне посчастливилось встретить Каталин у копировальной машины».
Лектор кратко рассказал об истории вакцин. Первую в мире вакцину создал с XVIII веке Эдвард Дженнер. Он заметил, что доярки не заболевали оспой. Когда Дженнер осмотрел коров, он обнаружил на них пустулы, очень похожие на человеческую оспу; это наблюдение позволило создать технологию вакцинации на основе вируса коровьей оспы. В дальнейшем были разработаны вакцины с применением инактивированного вируса (например, вакцина от гриппа), белковые вакцины (вакцина от столбняка), вакцины на основе аденовирусных векторов (вакцина от COVID-19) и, наконец, ДНК- и РНК-вакцины.
Первый раздел лекции был посвящен вакцинам на основе мРНК с модифицированными нуклеозидами и липидных наночастиц (mRNA-LNP вакцины). Группа Вайсмана начала исследование mRNA-LNP вакцин около десяти лет назад. Вайсман рассказал о разработке вакцины от вируса гриппа: «Мы выбрали грипп, потому что это ежегодная инфекция, охватывающая весь земной шар и которая меняется каждый год. Это значит, что необходимо менять и вакцину. А это, к сожалению, значит, что нам нужно угадать, как будет выглядеть вирус в следующем году. Иногда у нас получается, но часто нам это не удается».
Когда Вайсман и его коллеги начали разрабатывать вакцину от гриппа, титр антител (максимальное разведение сыворотки, при котором в ней все еще обнаруживаются антитела) в 1:100 считался хорошим показателем для вакцины. Группа Вайсмана решила закодировать белок гемагглютинина вируса гриппа в мРНК, ввести ее животным и сравнить результаты с вакцинами, содержащими живой и инактивированный вирус.
«Я занимался этим с коллегой, который заведовал лабораторией по изучению гриппа, — рассказывает Вайсман. — Ему потребовался месяц чтобы получить результаты по нашей вакцине, потому что приходилось разводить образцы все больше и больше. В конце концов он ворвался ко мне в офис и спросил: “Что вы сделали с этими образцами? Невозможно получить настолько высокий титр”. Он обвинил меня в том, что я дал ему фальсифицированные образцы, чтобы подпортить ему жизнь».
Полученные титры для мРНК вакцины были в 50 раз выше, чем для вакцин с инактивированным вирусом и в пять раз выше, чем для вакцин с живым вирусом. Для сравнения, на тот момент фармкомпании считали очень хорошим результатом удвоение значения титра при разработке новой вакцины.
Такой успех только подогрел исследовательский интерес Вайсмана: «Будучи иммунологом, я хотел понять — почему мы получили такие огромные титры». Фолликулярные B-клетки узнают и захватывают инородные молекулы, активируются и при содействии CD4+ Т-клеток, превращаются в B-клетки герминативного центра. Эти клетки являются критичными для формирования иммунитета — появления долгоживущих клеток плазмы и B-клеток памяти. Группа Вайсмана измерила численность различных B-клеток с учетом антигенспецифичности — они пометили гемагглютинин вируса гриппа флуоресцентной меткой и добавили его в панель для проточной цитометрии. Это позволило оценить, сколько B-клеток каждого типа в селезенке или лимфатическом узле способно узнавать вакцинный антиген. Оказалось, что применение мРНК вакцины повышает численность всех трех видов B-клеток (клеток герминативного центра, памяти и долгоживущих клеток плазмы) примерно в 50 раз по сравнению с другими типами вакцин.
Это объясняло, откуда взялись такие огромные титры антител, однако все ещё не было понятно, за счет чего происходит рост популяции B-клеток. Длительность эффекта была оценена благодаря случайности: «Мы забыли про некоторых мышей. И вспомнили про них только спустя тринадцать месяцев». Измерение численности антигенспецифичных долгоживущих клеток плазмы в костном мозге «забытых» мышей показало, что 0,05% клеток в костном мозге производили антитела к гемагглютинину вируса гриппа — огромное и невиданное ранее значение.
Однако для защиты от вируса нужно не просто много антител — эти антитела должны хорошо нейтрализовать вирус. Существует большое число подтипов вируса гриппа, многие из которых заражают преимущественно животных, однако могут передаваться человеку (как, например, вирус свиного гриппа H1N1, вызвавших пандемию в 2009 году). Даже если уче ным удается правильно предсказать, какие сезонные вирусы будут циркулировать в следующем году, эти вакцины не обеспечивают защиты от нового подтипа вируса, перешедшего от животных к человеку. Такие вирусы обычно и становятся причиной пандемий.
Группа Вайсмана иммунизировала животных мРНК вакциной против вируса гриппа H1, после чего заражали их достаточно удаленным подтипом H5 (геном подтипов совпадал примерно на 60%). Оказалось, что мРНК вакцина от вируса подтипа H1 обеспечивает полную защиту от подтипа H5. В настоящее время универсальные мРНК вакцины от гриппа находятся в первой стадии клинических исследований. В случае удачи эти разработки смогут и обеспечить защиту от потенциальных пандемических вирусов, и убрать необходимость в ежегодной вакцинации.
Тем не менее у Вайсмана все еще оставались вопросы к собственной разработке — мРНК с модифицированными нуклеозидами не имеет свойств адъюванта, т.е. не провоцирует выработки воспалительных цитокинов. Для липидных наночастиц на тот момент также не было описано адъювантной активности. Тогда группа обратила внимание на один конкретный тип CD4+ Т-хелперов — Т-фолликулярные хелперы (Tfh). Эти клетки необходимы для формирования герминативного центра и способствуют созреванию B-клеток. Без Tfh клеток крайне сильно снижается интенсивность иммунного ответа, связанного с антителами.
Исследования на макаках-резусах показали, что после mRNA-LNP вакцины численность Tfh клеток (как общая, так и антигенспецифичных клеток) в разы выше, чем при использовании белковой вакцины даже с сильным Tfh-индуцирующим адъювантом — двухцепочечной РНК. При использовании мРНК-вакцины процент Tfh в общей популяции Т-клеток составил более 50%, в то время как для других типов вакцин это значение составляло около 5%. Именно эти механизмы лежат в основе эффективности мРНК вакцин против COVID-19 — титры антител после вакцинации обычно в 3-5 раз выше, чем после инфекции.
Теперь нужно было установить компонент вакцины, который обеспечивает такой активный Tfh-ответ. Эксперименты показали, что введение животным липидных наночастиц, несущих белок, значительно повышало численность Tfh-клеток и концентрацию антител. Таким образом, оказалось, что именно LNP выполняют функцию адъюванта. При этом они не вызывали типичный цитокиновый ответ (с выделением интерферонов первого типа), а индуцировали секрецию интерлейкина-6 (IL-6), который и стимулировал рост популяции Tfh-клеток.
Основываясь на полученных результатах, группа разработала более 30 вакцин, однако на этом не остановилась. «Мы попробовали кое-что необычное. Что-то, что, по нашему мнению, никто в мире не решился бы попробовать. Потому что мы были сумасшедшими, и все это знали. Мы создали вакцину, в которую вошло по одному гемагглютинину от каждого известного подтипа вируса гриппа. (…) Никто не верил, что это сработает. Я не верил, что это сработает, но я все равно это сделал».
Тесты на мышах и хорьках показали, что вакцина действительно вызывает выработку сходных уровней антител против всех включенных подтипов гриппа. Для сравнения, вакцинация только против подтипа H1 приводила к умеренной кроссреактивности внутри группы (на подтипы H2, H5 и проч.), но полное отсутствие иммунитета к подтипам второй группы (H3, H4 и проч.). Исследователей удивило не только то, что им удалось получить ответ на все 20 антигенов, но и отсутствие доминирования какого-либо из антигенов (преобладания ответа на один из антигенов). В перспективе можно представить, как подобные универсальные вакцины заменят множество разных вакцин из календаря прививок, и дети будут проходить всего две-три вакцинации за весь период взросления.
Вайсман кратко описал различия между mRNA-LNP вакцинами и разрабатываемыми персонализированными мРНК вакцинами от рака. Последние содержат немодифицированную РНК и липоплексы вместо липидных наночастиц. При этом липоплексы не обладают адъювантными свойствами, функцию адъюванта исполняет сама РНК: немодифицированная РНК вызывает более активный Т-клеточный ответ, но меньшую выработку антител.
Группа Вайсмана также экспериментировала с добавлением цитокиновых адъювантов в вакцину. Они вводили мышам смесь мРНК, кодирующих овальбумин и IL-12. При этом у мышей появлялись в значительных количествах CD8+ Т-клетки, специфичные к овальбумину. Добавление в вакцину мРНК, кодирующую IL-12, повышало процент CD8+ Т-клеток после иммунизации примерно в 10 раз в сравнении с одной мРНК овальбумина. Более того, мРНК IL-12 провоцировала дифференциацию эффекторных CD8+ Т-клеток, при этом не снижалась численность Т-клеток памяти.
Этот подход сейчас используется при разработке новых типов противораковых вакцин для пациентов с генетической предрасположенностью к раку. Такие вакцины должны предотвращать появление опухоли: поскольку раковые клетки обычно впервые появляются за 5–10 лет до развития полноценного новообразования, введение вакцины, стимулирующей выработку только эффекторных Т-клеток, каждые 5 лет может «вычистить» все раковые клетки и предотвратить развитие опухоли. Кроме того, добавление в вакцину IL-12 не только не ухудшает выработку антител (в отличие от немодифицированной РНК), но даже повышает титры антител после вакцинации.
В Институте РНК-разработок Пенсильванского университета, которым руководит Дрю Вайсман, сейчас исследуют вакцины от ВИЧ, ВПЧ, вакцины против пищевых аллергий, аутоиммунных заболеваний и многого другого.
Во второй части лекции Вайсман рассказал о там, каким видит будущее мРНК-вакцин. По его словам, главная проблема — это таргетинг, то есть доставка препарата в желаемые клетки. Так, LNP вакцины сами по себе попадают в печень и дендритные клетки, но не в легкие, сердце, мозг и другие органы и ткани. Группа Вайсмана разработала метод добавления таргетирующих молекул на поверхность LNP. Такое добавление практически не влияет на свойства наночастиц, за исключением небольшого увеличения в размерах. Не изменяется и функциональная активность LNP. Однако у мышей такие модифицированные наночастицы гораздо успешнее проникают в легкие.
Большой интерес представляет модификация Т-клеток при помощи мРНК. Однако Т-клетки не способны к эндоцитозу, следовательно, не могут захватывать нуклеиновые кислоты из окружения. Вайсман с коллегами разработали метод, сочетающий таргетинг и индукцию эндоцитоза. Модифицированные липидные наночастицы успешно доставляют мРНК в CD4+ клетки. Когда их ввели мышам, активность появилась в селезенке, в которой содержится около 20% CD4+ клеток, а также в лимфоузлах. Следовательно, наночастицы смогли попасть из кровотока в ткани, а затем в лимфатическую систему, в которой успешно таргетировали CD4+ клетки.
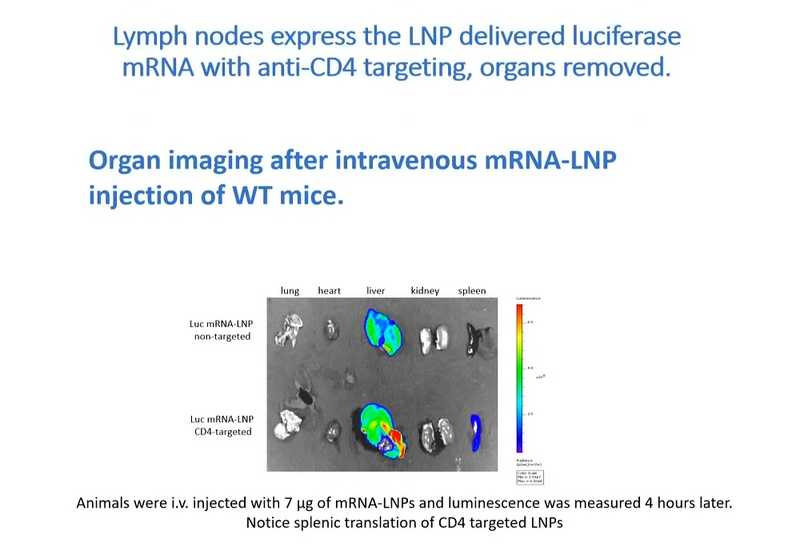
Это было подтверждено и анализом изолированных CD4+ клеток. Исследователи использовали модель Cre-Lox — мышей с генетическим элементом, который кодирует флуоресцентный белок, контролируемый стоп-кодоном, окруженным lox-сайтами. При доставке Cre-рекомбиназы в клетку она вырезает стоп- кодон и позволяет клетке экспрессировать флуоресцентный белок. Эта модель позволила продемонстрировать, что модифицированные LNP успешно таргетируют спленоциты и клетки лимфатических узлов. Более того, удалось доставить мРНК в иммунные клетки, находящиеся в состоянии покоя — этот результат важен для разработки вакцин против ВИЧ. Уже начаты эксперименты на макаках по удалению ВИЧ из генома инфицированных клеток.
Вайсман также затронул тему CAR-Т клеточной терапии. CAR-T клетки —модифицированные CD8+ Т-киллеры с рецепторами, узнающими определенный антиген. Они способны эффективно и избирательно уничтожать определенные типы клеток, однако процесс их производства клеток крайне трудозатратен и дорог. Он требует изоляции Т-клеток пациента, их модификации и стимуляции ex vivo и трансплантации обратно пациенту. Одна доза CAR-T клеточной терапии может стоить до полумиллиона долларов. Группа Вайсмана решила проверить, смогут ли они создать CAR-T клетки in vivo. Идея заключалась в получении LNP-частиц, доставляющих в Т-клетки мРНК для химерного рецептора (CAR). Механизм протестировали с CAR, узнающими активированные фибробласты в модели сердечного фиброза. Введение модельным животным одной дозы модифицированных LNP, несущих CAR мРНК, вернуло сердечную функцию к норме. «Таким образом, десять дней лабораторной работы и полмиллиона долларов можно заменить готовым препаратом, — объясняет Вайсман. — Кто-то приходит с сердечным фиброзом, получает инъекцию, возвращается домой, и его сердце работает лучше».
Ещё один потенциальная область применения mRNA-LNP препаратов — воздействие на стволовые клетки костного мозга. Существуют тысячи различных генетических заболеваний костного мозга. Серповидноклеточную анемию (СКА) каждый год диагностируют примерно у 300 тысяч новорожденных, преимущественно в тропической Африке. В США ожидается одобрение препарата для генной терапии СКА. «Проблема в том, что он стоит от миллиона до четырех миллионов долларов. Умножьте миллион на 300000, и вы обанкротите мир». Существует острая необходимость в других подходах к лечению генетических заболеваний костного мозга.
Таргетировать стволовые клетки костного мозга сложно, так как они очень редки. Группа Вайсмана использовала тот же подход, что и с таргетингом Т-клеток, на этот раз выбрав в качестве маркера CD117. В опытах с флуоресцентными метками введение мышам одной дозы модифицированных наночастиц позволило доставить мРНК более чем в 90% стволовых клеток костного мозга. Через несколько недель 100% красных и белых кровяных телец и гранулоцитов экспрессировали флуоресцентный белок. Таким образом, одна доза наночастиц позволила достичь 100%-ной эффективности в генной модификации клеток крови. Более того, модификация сохранялась и после вторичной трансплантации. «Это дает нам потенциал для излечения [серповидноклеточной анемии]. Притом лекарством, с которым мы можем выстроить людей прямо на улице, ввести им одну дозу mRNA-LNP и излечить их заболевание. Без миллиона долларов, без крутой лаборатории, просто готовыми инъекциями».
Метод может применяться и в других областях. Так, некоторые виды рака лечат при помощи трансплантации костного мозга, которая сопровождается высокими дозами химиотерапии, приводящими к 5%-ной смертности. Модифицированные LNP могут напрямую доставить токсичные гены в стволовые клетки костного мозга и селективно убить их. «Мы можем доставлять терапевтические протеины для стимуляции гранулоцитов или тромбоцитов или другие типы клеток. Мы можем таргетировать широкий спектр тканей и клеток — мозг, сердце, легкие, Т-клетки, другие иммунные клетки. Мы продолжаем расширять список того, что мы можем таргетировать. Так что теоретически в будущем генетическая терапия может стать настолько простой, что вы сможете прийти к врачу, он достанет из холодильника ампулу, введет вам ее содержимое и излечит ваше заболевание. (…) Я иногда шучу со своими сотрудниками — “мы еще не придумали все, что можно сделать с РНК”. Но это их работа, я свою работу сделал».


 Меню
Меню





 Все темы
Все темы




 0
0








