Терапевтическое редактирование РНК: как это работает
Wave Life Sciences объявила, что ее подход, основанный на редактировании матричной РНК, повысил выработку нормального белка у людей с опасным для жизни генетическим заболеванием — дефицитом альфа-1-антитрипсина (AAT). Разбираемся, как работает этот вид терапии и какое место он занимает среди других генотерапевтических методов.

Что произошло?
Компания Wave Life Sciences 16 октября сообщила об успешном терапевтическом редактировании РНК при дефиците альфа-1-антитрипсина. В фазе фазы 1b/2a исследования RestorAATion-2 препарат, обозначенный WVE-006, получили два пациента.
AAT (альфа-1-антитрипсин) — белок из надсемейства серпинов, ингибитор протеаз, прежде всего тех, которые выделяют клетки иммунной системы, например, эластазы нейтрофилов; он защищает ткани от чрезмерной воспалительной реакции. При дефиците AAT ткани легких теряют эластичность, серьезные патологические изменения могут развиться еще в раннем возрасте, до 20 лет. ААТ вырабатывается в печени, белок, имеющий дефект из-за мутации, накапливается в ней, что приводит к циррозу и другим патологиям. Без лечения заболевание может быть смертельным. В США около 200 тысяч человек страдает дефицитом AAT, отмечается в пресс-релизе компании.
Препарат WVE-006 вводится подкожно и содержит олигонуклеотид, комплементарный участку мРНК АТТ, который имеет мутацию почти у 95% пациентов с тяжелыми формами дефицита этого белка. Это вызывает замену аденозина на инозин (A-I) в молекуле мРНК. Олигонуклеотид конъюгирован с N-ацетилгалактозамином (GalNAc), который связывается с рецептором ASGPR на клетках печени и обеспечивает таргетную доставку.
В прошлом году Wave начала тестирование безопасности WVE-006 на здоровых людях. теперь в исследовании участвуют лица с двумя дефектными копиями гена ATT, у которых не вырабатывается нормальный белок. У обоих пациентов, получивших одну дозу WVE-006, через 15 дней более 60% (6,9 мкм) белка AAT в крови были нормальными. Белок дикого типа все еще присутствовал в их крови через 57 дней после лечения. Акции компании за месяц выросли на 70%.
Чем известна Wave Life Sciences?
Компания с головным офисом в Кембридже (Массачусетс) разрабатывает терапевтические препараты на основе РНК. Особенности ее платформы РНК-препаратов PRISM включают модификацию фосфодиэфирных связей в молекуле РНК (PN-химия) и модификацию уридиновых оснований (N3U). Компания испытывает различные методы воздействия на мРНК — как редактирование и сплайсинг, так и РНК-интерференцию и сайленсинг с помощью антисенсов.
Среди разработок Wave, дошедших до КИ, помимо терапии дефицита ААТ, — препараты для лечения миодистрофии Дюшенна (WVE-N531, управление сплайсингом) и болезни Гентингтона (WVE-003, аллель-селективный сайленсинг). Препарат для терапии ожирения на основе РНК-интерференции WVE-007 находится на доклинической стадии.
В 2021 году сообщалось об остановке КИ двух других препаратов Wave Therapeutics против болезни Гентингтона — WVE-120101 и WVE-120102, но WVE-003 оказался более успешным, у пациентов снизились уровни патогенного варианта хантингтина в спинномозговой жидкости.
Что у нас сейчас с генотерапевтическими препаратами?
Одобрено уже более десятка методов терапии, связанных с введением в клетку активного гена (Zolgensma, препарат против спинальной мышечной атрофии, Beqvez и Hemgenix против гемофилии В и др.), а также с редактированием ДНК в организме человека или в клетках вне организма. Например, здесь можно посмотреть список технологий генной и клеточной терапии, разрешенных в США по состоянию на 2024 год (включая CAR T-терапию и другие подходы к лечению рака, косметические технологии и т.п.). Пример CRISPR-редактирования ДНК — препарат Касгеви (серповидноклеточная анемия и бета-талассемия). Более 40 стратегий на основе CRISPR сейчас проходят клинические испытания.
Редактирование или уничтожение мРНК, кодирующей определенный белок, имеет ряд преимуществ по сравнению с редактированием ДНК. Оно более безопасно, так как срок жизни РНК в клетке ограничен (с другой стороны, это означает, что пациент должен постоянно получать лекарство, обычно дорогостоящее). Кроме того, для манипуляций с РНК существуют подходы, не связанные с доставкой в клетку чужеродного белка, такого как бактериальный Cas9. Нужно ввести только олигонуклеотид, комплементарный участку мРНК, а дальше все сделают белки, уже присутствующие в клетке. Для доставки могут использоваться вирусы, липидные наночастицы или конъюгирование с углеводами, как у Wave.
На октябрь 2024 года, как отмечает автор комментария в Science, одобрены шесть препаратов на основе коротких интерферирующих РНК (киРНК, small interfering RNA, siRNA) и 18 препаратов на основе антисмысловых (антисенс) олигонуклеотидов. В числе лидеров по разработке препаратов на основе РНК-интерференции — Alnylam Pharmaceuticals (Кембридж, Массачусетс, США). Пример антисмысловой терапии — нусинерсен (Спинраза) для лечения СМА.
В РФ зарегистрирован ингаляционный препарат МИР-19 против коронавируса SARS-CoV-2, разработанный в Институте иммунологии ФМБА России, — он содержит короткую интерферирующую РНК, нацеленную на вирусный геном.
Эти технологии связаны с Нобелевской премией по физиологии или медицине 2024 года?
Пока скорее нет, чем да. Как микроРНК (миРНК), за открытие которых присудили премию Виктору Эмбросу и Гэри Равкану, так и короткие интерферирующие РНК участвуют в РНК-интерференции — клеточном механизме подавления экспрессии гена путем воздействия на его мРНК.
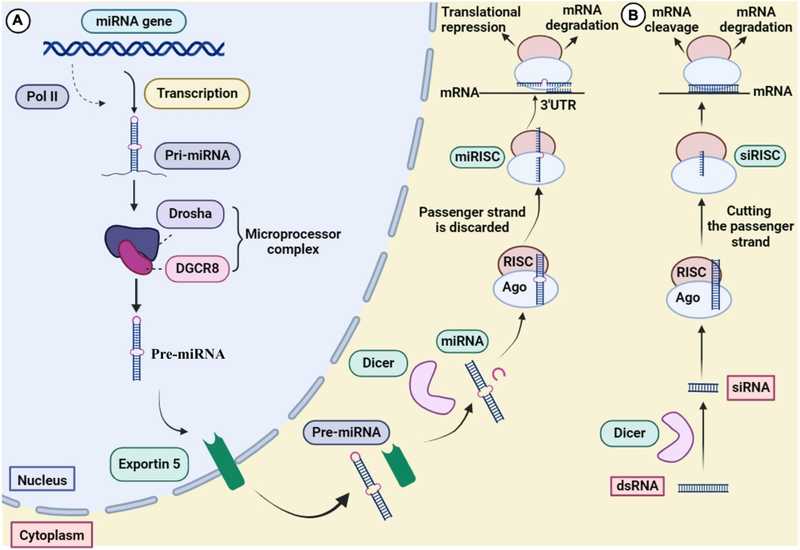 Механизм сайленсинга генов, опосредованного микроРНК и короткой интерферирующей РНК. Frontiers in Microbiology, 15, 2024. DOI: 10.3389/fmicb.2024.1393646 | CC BY 4.0
Механизм сайленсинга генов, опосредованного микроРНК и короткой интерферирующей РНК. Frontiers in Microbiology, 15, 2024. DOI: 10.3389/fmicb.2024.1393646 | CC BY 4.0
Но микроРНК, как правило, регулируют процессы, протекающие в норме на разных этапах онтогенеза (правда, они вносят вклад и в развитие рака). Одна микроРНК может регулировать несколько генов, регуляция не всегда чувствительна к однонуклеотидным заменам. Короткие интерферирующие РНК чаще участвуют в ответе на экстренную ситуацию, такую как бактериальная или вирусная инфекция, и отличаются высокой специфичностью, следовательно, при их применении меньше вероятность подобных эффектов. Возможно, поэтому ни один препарат на основе микроРНК еще не прошел третьей стадии клинических исследований, хотя считается, что они имеют большой потенциал.
Так или иначе, эти препараты снижают уровни нежелательных мутантных мРНК (препараты Alnylam) или модулируют ее сплайсинг (нусинерсен). Среди препаратов, редактирующих РНК, продукт Wave оказался первым.
Какой природный механизм использует WVE-006? Зачем клетке заменять аденозин на инозин?
РНК — одноцепочечные молекулы, но они склонны к образованию вторичных и третичных структур, содержащие двухцепочечные участки. А двухцепочечная РНК воспринимается клеткой как сигнал о присутствии вируса и активирует иммунный ответ. (Кстати, микроРНК и киРНК в своем цикле развития тоже проходят через двухцепочечную стадию. Очевидно, этот механизм регуляции активности генов произошел от антивирусных защитных механизмов.)
Как обнаружили Бренда Басс из Университета Юты и ее коллега еще в конце 1980-х годов, аденозины в клеточных РНК заменяются на инозины. Это происходит преимущественно в некодирующих участках и не влияет на продукцию белка, однако мешает образованию дуплексов. Без этих инозинов в РНК «у всех было бы аутовоспалительное заболевание», — говорит Басс. Замену A-I осуществляют ферменты ADAR (adenosine deaminase acting on RNA), способные распознавать двухцепочечную РНК.
Соответственно, если ввести в клетку направляющую РНК, комплементарную участку, в котором гуанозин из-за мутации заменен на аденозин, ADAR свяжется с РНК-дуплексом и заменит этот аденозин на инозин. Тем самым ошибка будет скорректирована, поскольку при синтезе белка инозин в мРНК «считывается» рибосомой как гуанозин. Понятно, что этот механизм может исправлять только замены G-A.
Именно такую замену корректирует препарат WVE-006 в гене альфа-1-антитрипсина у людей с дефицитом AAT. Результат лечения первых двух пациентов воодушевляет. «Уровень редактирования мРНК, который мы наблюдаем при однократной дозе, превзошел наши ожидания, и мы ждем, что уровни [нормального белка] продолжат расти при повторном дозировании», — говорит президент и генеральный директор Wave Пол Болно.
Кроме Wave Life Sciences, кто-то еще использует этот подход?
Нидерландская компания ProQR Therapeutics планирует применять редактирование A-I в РНК для лечения холестатических расстройств — группы состояний, при которых в печени накапливаются желчные кислоты. В ProQR разработали направляющую РНК, комплементарную мРНК рецептора, через который желчные кислоты доставляются в гепатоциты. Замена A-I в определенном сайте ухудшает функцию рецептора и избавляет гепатоциты от «отравления» Компания планирует начать испытание своего олигонуклеотида в конце этого года или в начале следующего.
А минусы у этой технологии есть?
Ожидаемые: недостаточная эффективность редактирования и нецелевое редактирование. Для повышения эффективности в 2022 году было предложено использовать циклические направляющие РНК (circular ADAR-recruiting guide RNAs, cadRNAs), которые дольше сохраняются в клетке. Нецелевое редактирование можно снизить c помощью 4′-C-метилирования рибозы или помещая в определенные положения направляющей РНК LNA (locked nucleic acids).
Какие еще существуют способы редактирования РНК, кроме замены A-I?
Теоретически с помощью направляющих РНК и ADAR можно исправить около 20 000 мутаций G-A, которые вызывают генетические заболевания. Но для исправления других однонуклеотидных замен, а также делеций и инсерций нужны другие подходы. Например, CRISPR-редактирование РНК или транс-сплайсинг, удаляющий экзон с мутацией и соединяющий две разных РНК.
Ascidian Therapeutics использует транс-сплайсинг (компания названа в честь асцидий, у которых этот вид редактирования РНК широко распространен). Летом Ascidian начала клинические испытания препарата для транс-сплайсинга при болезни Штаргардта, наследственной формы макулярной дегенерации, вызванной дефектами в гене белка ABCA4. Болезнь Штаргардта могут вызывать более 1000 мутаций, и лечение «может помочь примерно 75% пациентов», говорит Майкл Элерс, президент Ascidian. Испытания на обезьянах и образцах сетчатки человека прошли успешно. Кроме того, летом представитель компании объявил о сотрудничестве с Roche по разработке терапии трудноизлечимых неврологических заболеваний.
Южнокорейская компания Rznomics (ribozyme and omics) проводит два клинических испытания транс-сплайсинга в качестве терапии гепатоцеллюлярной карциномы и глиобластомы. В следующем году она начнет исследование терапии наследственного заболевания глаз, приводящего к потере зрения — пигментного ретинита. А компания HuidaGene (Шанхай) начала клинические испытания препарата против возрастной дегенерации сетчатки.
Что касается CRISPR-редактирования РНК, весной интересную работу опубликовали исследователи из Университета Монтаны (biorXiv). Они исправляли одну из мутаций, связанных с муковисцидозом, — возникновение преждевременного стоп-кодона в мРНК белка CFTR, из-за которой производится укороченная версия белка. В культуре клеток создание разрывов в РНК по стоп-кодону комплексами CRISPR типа III привело к успеху: некоторое количество мРНК было восстановлено клеточной РНК-лигазой RtcB, и клетки начали вырабатывать функциональный CFTR. Руководитель работы Блейк Уиденхефт говорит, что на самом деле для муковисцидоза это не оптимальный подход, но для десятков других заболеваний он перспективен.


 Меню
Меню





 Все темы
Все темы




 0
0