Нобелевская неделя 2024. Гэри Равкан: «Обширный и древний тайный мир микроРНК эукариот»
«В биологии черви были исключением, но нам это даже нравилось. Те, кто занимались червями, стояли немного в стороне. История микроРНК о том же: мы думали иначе, чем остальные, и иногда это очень помогает». — Лекция лауреата Нобелевской премии по физиологии или медицине Гэри Равкана. Стокгольм, 07.12.2024.

Черви как исключение, или первые открытия
Нобелевскую лекцию Гэри Равкан начал с рассказа о lin-14 — гетерохронном гене нематоды C. elegans, который регулирует время событий в ходе развитии личинки. Говоря о ранних днях работы с этим модельным объектом и о выступлениях на конференциях, Гэри Равкан вспоминает, что для биологов, изучающих развитие, их исследования были в новинку: «В биологии черви были исключением, но нам это даже нравилось. Те, кто занимались червями, стояли немного в стороне. История микроРНК о том же: мы думали иначе, чем остальные, и иногда это очень помогает».
Работа Гэри Равкана была сосредоточена на мутациях приобретения функции в гене lin-14, причем наиболее интересной частью этого гена оказалась не белок-кодирующая, а некодирующая часть. Активирующие мутации в lin-14, которые давали тот же фенотип, что и нокаут lin-4, находились в 3'-нетраслируемой области (UTR), которая насчитывает 1,7 т.п.н. Всего таких мутаций было две: одна — делеция 600 нуклеотидов, а вторая — транслокация этого участка гена.
После получения антитела к белку LIN-14 команда Равкана показала, что это ядерный белок, экспрессия которого уменьшается примерно в 50 раз на первой стадии развития личинки — L1. При мутациях приобретения функции в гене lin-14, а также при нокауте lin-4 наблюдалась обратная картина: он накапливался вплоть до второй стадии, L2. Так исследователи заключили, что существует какой-то регуляторный механизм, который по мере развития «выключает» lin-14, причем в этом как-то замешан lin-4.
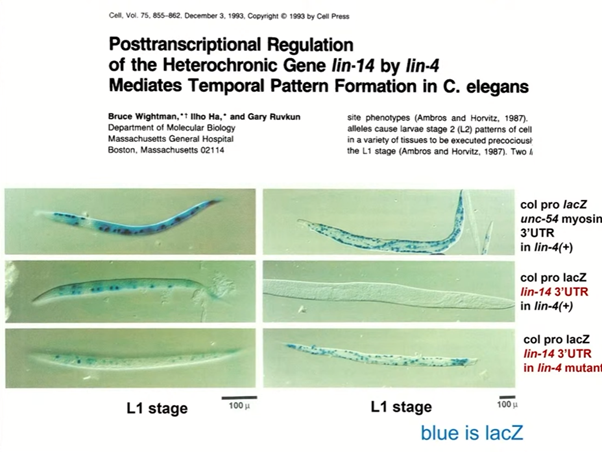
В 1993 году Виктор Эмброс с коллегами показал, что продукт lin-4 — это РНК длиной в 22 нуклеотида, которая образует структуру «стебель-петля». По мере развития нематоды уровень ее экспрессии растет. РНК lin-4 комплементарна семи участкам в 3' UTR lin-14, а при активирующих мутациях эти участки пропадают, поэтому lin-4 не с чем больше связываться. Эти данные подвели к выводу о том, что РНК lin-4 подавляет экспрессию белка LIN-14 — так была открыта первая микроРНК.
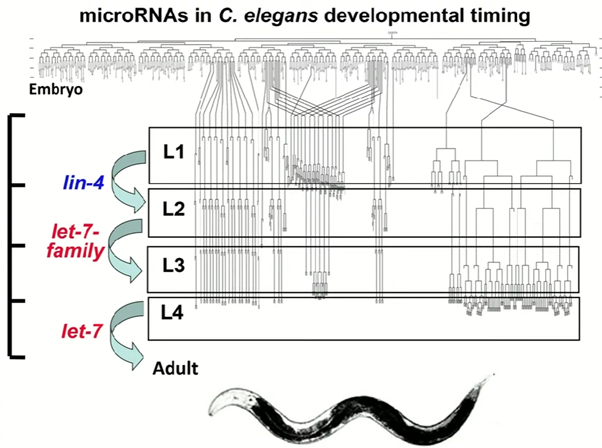
Позднее оказалось, что по мере развития C. elegans встречаются другие похожие регуляторные механизмы. В одном из них оказались замешаны гены let-7 и lin-41. Ген let-7 регулирует поздние стадии развития организма (L4) — в частности, паттерны деления клеток латерального эпидермиса нематоды. Такие клетки в конце концов должны переставать делиться, в результате чего на эпидермисе нематоды образуются полоски. При нокауте let-7 этого не происходит, и нематода так и не достигает зрелости. «Некоторым из нас это очень знакомо», — пошутил Равкан. Оказалось, что lin-41 кодирует белок группы RING finger, вероятная функция которого — контроль трансляции.
Продукт гена let-7 — еще одна РНК длиной 21–22 нуклеотида, экспрессия которой начинается на стадии L4. Гэри Равкан вспомнил: «Хотя lin-4 открыли пятью годами ранее, мы не ожидали, что let-7 окажется микроРНК. Мы ожидали, что это будет регуляторный каскад с очередной кучей транскрипционных факторов». На самом деле оказалось, что let-7 регулирует экспрессию lin-41 так же, как lin-4 — экспрессию lin-14: за счет частично комплементарного связывания в 3' UTR.
Гомологи у животных и их функции
Команда Равкана решила отыскать гомологи микроРНК let-7 в геномах других животных. Оказалось, что эта микроРНК консервативна: она встречается в геномах, например, мышей, данио-рерио, приматов и людей. Процесс поиска гомологов в геномах тогда был необычным: «BLAST тогда не было, но я просто спросил: “А в той трети генома человека, которая уже получена, есть что-нибудь, что похоже на вот это?” Я делал это с модема из дома. Я сидел за своим столом, раздается “дзынь!”, я получаю данные назад, и там написано: “Да! В геноме человека есть идеальный гомолог”. На тот момент был только геном человека, через пять лет появились геномы приматов. А сейчас есть 20 тысяч эукариотических геномов и еще полмиллиона бактериальных геномов. Вы хоть понимаете, как чудесно быть молекулярным биологом сейчас? В доступе столько данных, в которых можно копаться».
Найдя гомологи, ученые захотели проверить, сохранились ли их функции в других организмах. «Часть этого проекта заключалась в том, что я вел себя очаровательно и умолял других людей дать мне образцы РНК», — пошутил Равкан. В результате эксперимент с РНК дрозофилы, полученной на разных стадиях ее развития, показал, что гомолог let-7 в ней тоже подчиняется определенному паттерну экспрессии. Эта микроРНК начинает экспрессироваться только в конце межличиночного периода и экспрессируется всю стадию куколки и у зрелых дрозофил. Тот же паттерн экспрессии let-7 исследователи обнаружили и у данио-рерио. У человека let-7 экспрессируется в мозге, почках, легких и в других органах, но отсутствует в костном мозге, в делящихся и тотипотентных клетках. Экспрессию гомологов let-7 ученые подтвердили у множества разных организмов, получая образцы РНК от разных лабораторий, а вот гомологов lin-4 не нашлось ни у дрозофил, ни у данио-рерио, ни у человека.
На сегодняшний день известно, что микроРНК очень много, и некоторые из них консервативны среди животных. МикроРНК еще не были найдены у дрожжей и некоторых других грибков, но у растений они тоже существуют. Равкан отметил, что, как правило, эквивалентов микроРНК растений нет у животных. Это значит, что у общего предка растений и животных были микроРНК, но в итоге в процессе эволюции у них появились разные микроРНК. По мнению Равкана, разница может быть в том, какое временное разрешение регуляции генов требуется животным и растениям: если у животных она должна происходить за миллисекунды, растениям такая скорость не требуется.
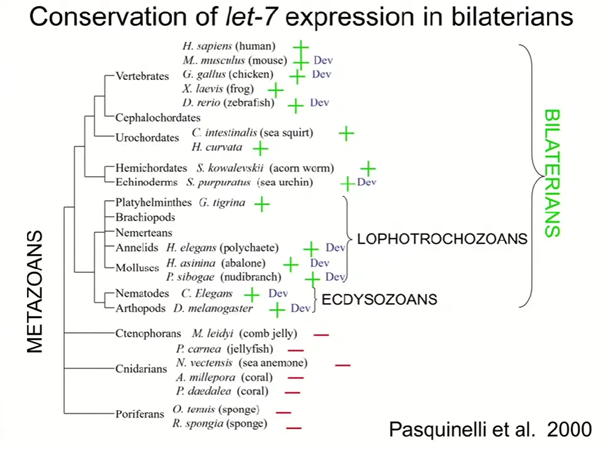
Еще один пример микроРНК, которая встречается у многих организмов, — это mir-1, которая была открыта под руководством Виктора Эмброса. У дрозофил эта микроРНК важна для развития мышц, а у мышей — конкретно для развития сердечной мышцы. Команда Равкана также показала, что у C. elegans эта микроРНК в основном экспрессируется в фаринксе и мышцах стенки тела. Мишенью mir-1 является 3'-UTR гена unc-29, который кодирует субъединицы ацетилхолинового рецептора. Это было доказано экспериментально: у нематод дикого типа этот рецептор экспрессируется на низком уровне, но его экспрессия повышается, если нокаутировать mir-1.
Исследователи ожидали, что такие мутантные нематоды будут более чувствительны к левамизолу — антигельминтному средству, агонисту ацетилхолиновых рецепторов. На самом деле такие мутанты оказались резистентны к нему, в отличие от особей дикого типа. Одно из объяснений этого явления — то, что mir-1 регулирует экспрессию и других ацетилхолиновых рецепторов, и от этого может зависеть чувствительность к левамизолу.
В 2004 году в коллаборации с лабораторией американского невролога Кена Косика команда Равкана занялась поиском микроРНК в нейронах млекопитающих. Всего в нейронах коры мозга крыс ученые нашли 48 новых микроРНК и 38 уже известных. Среди них оказалась, например, микроРНК mir-124, гомологи которой встречаются в определенных нейронах у C. elegans и у мышей. Эта микроРНК ассоциирована с полисомами — комплексами рибосом, которые одновременно транслируют одну и ту же мРНК, а ее функция состоит в подавлении трансляции.
Растительные микроРНК
Далее Равкан перешел к рассказу о микроРНК в растениях. У растений гомологи микроРНК тоже могут встречаться у организмов, которые расположены на филогенетическом дереве очень далеко друг от друга: например, mir-156 есть и у арабидопсиса (класс двудольные), и у риса (класс однодольные). Мишень этой микроРНК — ген транскрипционного фактора SBP, но в некоторых организмах микроРНК связывается с 3'-UTR гена, а в других — с его кодирующей областью.
Растительные микроРНК, в отличие от животных, работают по механизму, похожему на РНК-интерференцию, которая опосредована белком PIWI. «У нас возник вопрос: а не используют ли микроРНК что-то похожее на механизм работы малых интерферирующих РНК (миРНК)? Аргументация в основном была связана с нумерологией: раз микроРНК длиной 22 оснований и миРНК — тоже, не могут ли они быть одним и тем же?», — вспомнил ход своих мыслей Равкан.
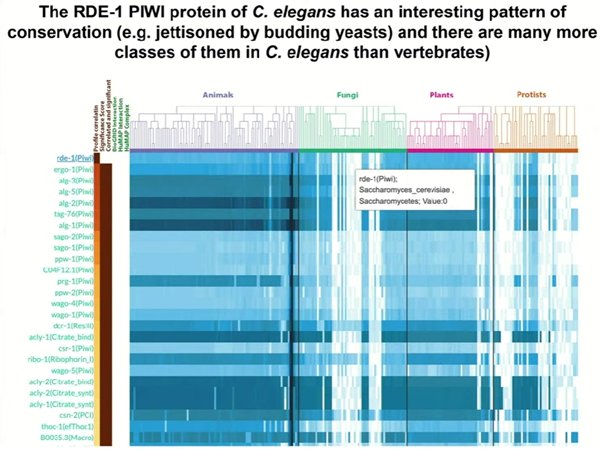
Позднее были обнаружены разные белки с доменом PAZ (Piwi/Argonaute/Zwille): например, Dicer и RDE-1 (из семейства Argonaute). RDE-1 впервые нашли у C. elegans, но он оказался консервативным для многих животных, растений и протистов. При этом у нематод есть 24 класса этого белка, у людей — 8, у растений — 12–15. Что интересно, у дрожжей Saccharomyces cerevisiae RDE-1 не встречается: «Это нас спасло, потому что, если бы генетики, занимающиеся дрожжами, заинтересовались РНК-интерференцией, они бы нас обошли, слишком уж они хороши». Причины того, почему у дрожжей нет PIWI-белков, пока остаются неясными, но Равкан заметил, что это, вероятно, связано с почти полным отсутствием у них интронов.
Работа продолжается
Дальнейшему изучению РНК-интерференции поспособствовала разработка метода, позволяющего не вкалывать нематодам нуклеиновые кислоты, а скармливать. Гены, связанные с РНК-интерференцией, помещали в вектор (плазмиду) под промотор T7. При добавлении индуктора ИПТГ (изопропил-β-D-1-тиогалактопиранозид) начиналась экспрессия двухцепочечной РНК (дцРНК) с такого гена. Кишечную палочку с внесенным вектором добавляли в корм нематодам. В итоге дцРНК попадала сначала в клетки кишечника, потом распространяется по всему телу, и так запускалась РНК-интерференция.
В итоге оказалось, что введение dcr-1 и argonaute приводит к тому же фенотипу нематод, что и нокаут let-7. И это подтолкнуло ученых к мысли о том, что они все-таки взаимосвязаны. Последующие эксперименты показали, что процессинг микроРНК lin-4 также зависит от DICER и белков ALG-1/2 семейства Argonaute. То же было продемонстрировано для mir-1.
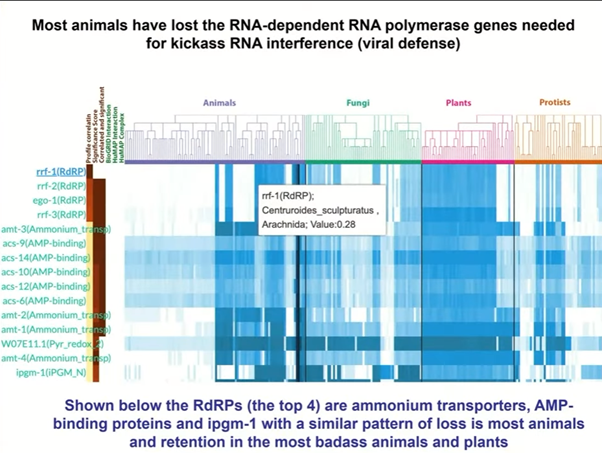
Гэри Равкан рассказал, что РНК-интерференция устроена немного по-разному у разных организмов. У дрозофил и у людей, например, Dicer способствует наработке миРНК той же длины, что микроРНК. А у других организмов в РНК-интерференции также участвует РНК-зависимая РНК-полимераза, которая использует миРНК как праймер и синтезирует вторичную миРНК. У C. elegans есть четыре разных РНК-зависимых РНК-полимераз, которые имеют разные функции: одна полимераза необходима для РНК-интерференции в соматических клетках, другая — в зародышевых, а еще одна является негативным регулятором РНК-интерференции.
У большинства животных нет РНК-зависимых РНК-полимераз. Что интересно, они есть у ланцетников, пауков, клещей, скорпионов, двухстворчатых моллюсков и т.д. Общее у этих организмов то, что они могут выживать в условиях гипоксии, хотя и неясно точно, как это может быть связано с противовирусной защитой посредством РНК-интерференции.
Так как РНК-интерференция, вероятно, появилась как механизм противовирусной защиты, ученые предположили, что у многих животных могут быть механизмы ее регуляции — в зависимости от того, считает ли клетка, что ее заразил вирус. Если найти такие механизмы, то можно поместить организм в состояние, в котором РНК-интерференция работает постоянно, что облегчит ее изучение. «Обычно генетические методы рассматривают как способы сломать организм. Но сила генетики — в том, что она позволяет включить те вещи, которые должны быть выключены, или выключить те, которые должны быть включены. В этом вся суть физиологии», — пояснил Равкан.
Чтобы улучшить РНК-интерференцию C. elegans, команда Равкана провела скрининг генов нематоды. Нематодам вводили трансген rol-6, который кодирует коллаген кутикулы. В отсутствии РНК-интерференции животные с такими трансгенами скользили и крутились в среде, а при ее активации они могли двигаться нормально. Скрининг мутаций выявил 69 генов, инактивация которых приводила к улучшению РНК-интерференции: eri-6/7, ergo-1, а также lin-9, lin-54, lin-35 группы synMuvB.
У нематод есть вульвы, которые нужны для спаривания с самцами и оплодотворения яйцеклеток. Обычно у самки есть одна вульва, что регулируется сигналингом пути Ras в гиподерме. У мутантов synMuvA и synMuvB образуется несколько вульв, что связано со 100-кратным усилением сигнала от белка LIN-3 в гиподерме. Мутанты synMuvA и synMuvB впервые были получены в лаборатории Роберта Хорвица — наставника Виктора Эмброса и Гэри Равкана, лауреата Нобелевской премии по физиологии или медицине 2002 года за изучение апоптоза.
У мутантов synMuvB наблюдается нокаут восьми генов, которые являются частью комплекса транскрипционных факторов dREAM. Эти гены консервативны у нематод, дрозофил и человека. К ним относится Rb — белок ретинобластомы, онкосупрессор. «Сначала я сопротивлялся работе над этим проектом, потому что он связан с регуляцией хроматина. Я волновался, что никогда не пойму, что там происходит с хроматином. Другие, может, и поймут, но не я», — поделился Равкан.
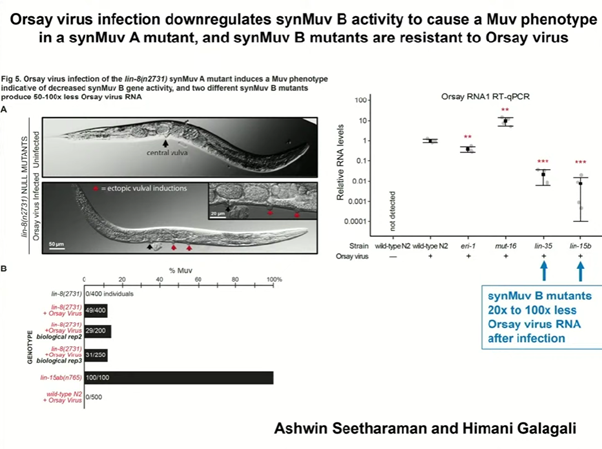
Гены synMuvA тоже кодируют ядерные белки, которые низко консервативны. Фенотип нематоды с несколькими вульвами — Muv-фенотип — на самом деле соответствовал двойному мутанту по synMuvA и synMuvB. У мутантов только по synMuvA такого фенотипа не было. Чтобы его проявить, нужно каким-то образом снизить экспрессию генов группы synMuvB. Один из способов — это инфекция вирусом нематод Орсе, которая приводила к появлению Muv-фенотипа у мутантов synMuvA. Вместе с тем мутанты synMuvB резистентны к вирусу Орсе. Следовательно, при инфекции мутанты synMuvA начинали подавлять synMuvB, чтобы приобрести резистентность к этому вирусу. Так ученые показали, что активация РНК-интерференции способствует улучшению противовирусной защиты.
В конце лекции Гэри Равкан поблагодарил сотрудников своей лаборатории, постдоков, с которыми работал, и своих наставникам. «В моей лаборатории содержится примерно 800 человеко-часов. Большинство из сотрудников были в лаборатории примерно шесть лет. Если помножить шесть на количество людей, вот выйдет 800 человеко-часов. У меня — 40 человеко-часов. Даже если предположить, что, раз я очень хорош, я стою 80 человеко-часов, то это все равно 10% лаборатории. Когда сотрудники покидают мою лабораторию, на их месте остается дыра. Мы теряем таланты, знания. Люди, которые работают у меня, постоянно друг друга вспоминают, остаются друзьями, пишут статьи вместе даже 20 лет спустя. Это лучшее, что можно увидеть», — рассказал Равкан. Он отдельно поблагодарил свою жену Наташу Сталлер, дочь Викторию, родителей Сэма и Дору Равкан и собаку Барнаби.
Напоследок Равкан рассказал о своих детских увлечениях, в том числе электроникой, и о своем пути — от еврейских комиков, интереса к космосу и физике, года, посвященного посадке леса, к занятию биологией.


 Меню
Меню





 Все темы
Все темы




 0
0