Нобелевская неделя 2024. Виктор Эмброс: «Это было весело»
«Мы подумали: у этого гена очень маленький транскрипт, все это очень необычно, мы сообщим миру, что lin-4 не кодирует белок. И, думаю, я крайне надоел Ронде и Розалинде, потому что я считал, что нам нужно доказать, что там нет никакого белка». — Лекция лауреата Нобелевской премии 2024 года по физиологии или медицине Виктора Эмброса. Стокгольм, 7.12.2024.

Скриншот канала Нобелевского комитета
«Червь — это замаскированный маленький человек»
Научные интересы молодого Эмброса поддерживал его отец, Лонгин Эмброс. Виктор хорошо учился в школе, увлекался астрономией. Именно в этой области он впервые получил результаты, которые были опубликованы, — в 1970 году журнал Sky and Telescope упомянул его наблюдения за теневыми волнами во время солнечного затмения 7 марта 1970 года.
В 1971 году Эмброс поступил в MIT, который закончил со степенью бакалавра в 1975 году. Во время обучения участвовал в первом сбросе пианино с крыши Бейкер-хаус — мероприятие, ставшее к настоящему времени традицией. Именно в этот период Эмброс заинтересовался биологией — учившиеся с ним братья Штрул (Struhl) показали ему биологическую лабораторию и заразили своей тягой к этой дисциплине.
В 1979 году Эмброс получил степень PhD, над которой работал под началом Дэвида Балтимора, лауреата Нобелевской премии 1975 года. После получения степени работал с Бобом Хорвицом (Нобелевская премия по физиологии или медицине 2002 года), а затем в разное время в Гарварде, Дартмуте и, наконец, в университете Массачусетса, куда его позвал его бывший ученик Крейг Мелло (Нобелевская премия по физиологии или медицине 2006 года).
— Я работал с тремя нобелевскими лауреатами, — говорит Эмброс. — Так что я сейчас хочу сказать вам: это невероятная жизнь.
История исследования, приведшего к открытию микроРНК, началась с работ Джона Салстона и Боба Хорвица, которые описали клеточные линии нематоды Caenorhabditis elegans. Долгие часы наблюдений за делением и миграцией клеток в живом черве позволили заключить, что деление клеток в процессе постэмбрионального развития всегда происходит одинаково у всех особей дикого типа. Такое свойство C. elegans сделало ее очень привлекательным объектом для исследования развития организма в реальном времени. Эмброс также отметил, что в ретроспективе это была еще и отличная модель для изучения устойчивости программ развития организма к внешним стрессовым воздействиям — нематоды живут в широком спектре условий, но при этом сохраняют инвариантность клеточных линий.
За составлением карты линий встал вопрос: каким образом такая строгая программа развития закодирована в геноме? Хорвиц подошел к нему с генетической точки зрения — через поиск мутантов и анализ их развития. При этом механизмы развития, которые были описаны на одном модельном организме, затем можно применять к множеству далеких от него видов. По выражению Хорвица, «червь — это замаскированный маленький человек». Разные линии животных унаследовали единый набор генетических «инструментов» от общего предка и затем использовали этот набор в процессе эволюционной адаптации.
Однако в 1980-х годах анализ функций одного гена (идентификация мутации, клонирование гена, анализ последовательности и свойств продукта и как это все связано с фенотипом) требовал огромных затрат времени, до нескольких человеко-лет. Поэтому вопрос о том, каких именно мутантных особей отбирать для исследования, имел первостепенное значение.
«Весь проект строился на мутации, которая появилась абсолютно случайно»
Выбор Хорвица пал на мутантов c нарушением тайминга развития, в частности, на lin-4(0) мутантных нематод. У этих червей в процессе развития многократно повторялись процессы клеточного деления и миграции, которые у нематод дикого типа происходили только на личиночной стадии, и не наступал переход к процессам, характерным для более поздних стадий. Такие мутанты получили название «гетерохронных»
К моменту прихода Эмброса в лабораторию в ней уже велась активная работа с мутантами lin-4. Хорвиц учил сотрудников создавать простые модели — если у мутантов с нарушением функции lin-4 повторяется первая личиночная стадия, а у нематод дикого типа происходит переход ко второй стадии, значит, нормальная функция lin-4 состоит в спецификации программ развития для второй личиночной стадии и/или предотвращении повторения программ первой стадии.
Вторым модельным организмом были мутанты lin-14(0). У этих нематод имела место обратная ситуация — в процессе развития программы первой личиночной стадии пропускались и клетки сразу переходили к реализации программ второй личиночной стадии.
Перед коллективом встал вопрос: как эти два гена взаимодействуют? Бвли две возможности: lin-14 ингибирует lin-4, который управляет клеточными программами второй стадии, или же, напротив, lin-4 ингибирует lin-14. Для решения этого вопроса в лаборатории получили двойного мутанта lin-4(0) lin-14(0), который имел фенотип, аналогичный мутанту по lin-14. Такой результат говорил в пользу второго предположения — при отсутствии lin-14 наличие или отсутствие lin-4 не играет роли, значит, lin-4 воздействует на lin-14.
— Интересно рассмотреть, что происходит в этих мутантах — судьба клеток трансформируется во времени. Из этого можно сделать предположение, что в диком типе стволовые клетки на первой личиночной стадии имеют потенциал осуществить как программу первой, так и второй стадии, так же, как и стволовые клетки на второй стадии. И выбор опции происходит вначале под действием присутствия LIN-14 и далее под действием его отсутствия из-за активности LIN-4.
Полученных результатов было достаточно, чтобы оправдать трудозатраты на клонирование генов lin-4 и lin-14. Эмброс начал работать над lin-4 на основе мутанта lin-4(e912), а Гэри Равкан — над lin-14.
— Наша мутация e912 имела интересное происхождение. Ее получили в лаборатории Бреннера, где кормили червей бактериями, помеченными 32P (радиоактивный изотоп фосфора. — PCR.NEWS). Когда нематоды поедали этих радиоактивных бактерий, 32P распадался и повреждал геном, создавая мутантов. И кто-то проанализировал линии нематод, которых кормили этими бактериями, на предмет мутантов, и обнаружил там e912. Так что, когда мы начинали этот проект, он весь строился на мутации, которая появилась абсолютно случайно (…) Вот так и начинаются карьеры.
К началу работы в 1988 году на основе анализа рекомбинации было известно, что lin-4 находится между генами bli-2 и dpy-10 в группе сцепления LG II. Дальнейшая работа по клонированию и картированию LG II выполнялась при активной поддержке проекта по картированию генома C. elegans, проходящего под эгидой совета по медицинским исследованиям под руководством Алана Колсона и Джона Солстона. Промежуточные результаты и успехи картирования публиковали в «Газете заводчиков червей» («Worm Breeder's Gazette» — любительский журнал исследователей, работающих с C. elegans, в котором участвовали многие будущие нобелевские лауреаты). Участники проекта делились полученными клонами и советами.
К 1988 году команда Розалинды Ли получила обширную физическую карту последовательностей генома C. elegans, которая, однако, не несла информации о положении генов. Работа по соотнесению генетической и физической карт велась в сотрудничестве со многими коллективами, включая лабораторию Эмброса. Картирование проводили при помощи анализа различий в длинах фрагментов рестрикции (RFLP) методом саузерн-блоттинга. Ученые получали гетерозиготы между двумя штаммами нематод, различающимися известным полиморфизмом (обычно крупными делециями или инсерциями), после чего выявляли, в каких рекомбинантных фрагментах оказывался этот полиморфизм, что позволяло соотнести его с физической картой.
— Теперь задумайтесь, если бы e912 была точечной мутацией, то шансов найти ее таким способом практически не было. Только если бы эта мутация влияла на сайт рестрикции. Так что шансы были малы. Но она [Розалинда Ли] нашла ее.
Группа Розалинды Ли взялась секвенировать клон, содержащий lin-4, однако выявленный фрагмент был длинной около пяти тысяч нуклеотидов, поэтому точно установить, где в нем располагается lin-4, было сложно. Чтобы сократить потенциальную область поиска, группа скрещивала подвергнутых мутагенезу самцов нематод с самками, несущими мутацию lin-4(e912) и мутацию по dpy-10. Почти все потомки от этих скрещиваний имели нормальный фенотип, потому что обе мутации у самок были рецессивными. Тем не менее у одной из примерно 20 тысяч особей удалось выявить фенотип, характерный для мутации в lin-4, следовательно, она была гетерозиготной по двум мутациям — e912 и новой мутации (ma161), полученной в результате воздействия на самцов. Мутация оказалась точечной и дала ученым информацию о том, в каком месте располагался lin-4.
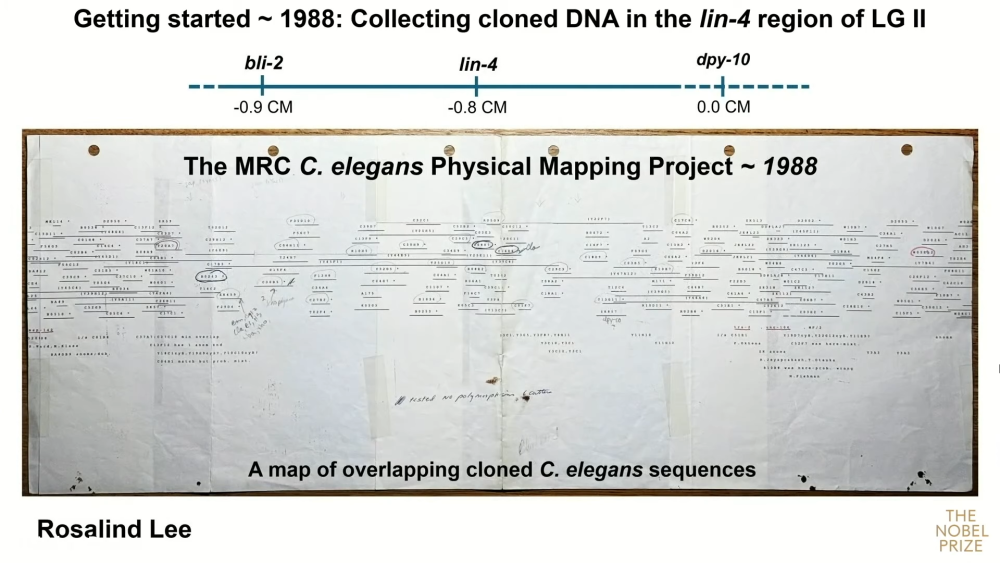 Карта клонированных последовательностей C. elegans
Карта клонированных последовательностей C. elegans
Теперь нужно было определить границы гена. Для этого нематодам с lin-4(e912) вводили клонированную ДНК дикого типа и получали трансгенных особей. По тому, восстанавливался ли у них фенотип дикого типа, можно было определить, содержит ли введенный клон ДНК lin-4 или нет. Таким образом, последовательно уменьшая размеры клона, удалось сократить регион возможного нахождения lin-4 до 700 п.н. Для гена это очень небольшой размер, что еще более заинтересовало ученых. Дальнейший анализ методом ribonuclease protection (выявление размера пробы, которая может гибридизироваться с РНК, полученной с исследуемого участка, и таким образом становится «защищенным» от рибонуклеазы), который проводил Амброс, показал, что длина транскрипта lin-4 — всего около 55 нуклеотидов.
— Я представил эти результаты на нашем собрании по текущим исследованиям. И наш друг Маргарет Беррен спросила: «Что это внизу геля?». Я ответил: «Грязь? Я не знаю». Тогда она предложила переделать нозерн-блот с меньшей выдержкой.
Когда коллега Эмброса Ронда Фейнбаум переделала анализ, то выяснилось, что основной транскрипт имеет размер около 22 нуклеотидов. К настоящему времени известно, что более крупный фрагмент представляет собой прекурсор, который затем разрезается ферментом Dicer с образованием продукта в 21 нуклеотид.
— Мы подумали: у этого гена очень маленький транскрипт, все это очень необычно, мы сообщим миру, что lin-4 не кодирует белок. И, думаю, я крайне надоел Ронде и Розалинде, потому что я считал, что нам нужно доказать, что там нет никакого белка.
Группа попробовала вносить в последовательность сдвиги рамки считывания и новые стоп-кодоны. Получившиеся клоны все еще восстанавливали нормальный фенотип у мутантов e912. Восстанавливался фенотип и при введении последовательности от других видов нематод, разошедшихся около 20 миллионов лет назад. Таким образом, все эти последовательности имели функцию lin-4, но при сравнении их не обнаруживалось никакой консервативной белоккодирующей последовательности.
В июне 1992 Эмброс и Равкан сравнили результаты своих работ по lin-4 и lin-14 и выяснили, что между двумя генами есть консервативные комплементарные участки. Более того, именно эти участки были консервативны внутри каждого гена у разных видов.
— В этот момент мы знали механизм. Это было потрясающе. Редко когда вы можете просто изучить данные и понять механизм. Это было весело.
После публикации этих результатов, в период с 1993 по 2000 гг., лаборатория Эмброса продолжала расшифровывать механизмы регуляции развития C. elegans, включая работу с белок-кодирующими генами lin-29, lin-28, lin-41 и let-7. Среди прочего выяснилось, что lin-4 может воздействовать не только на LIN-14, но и на LIN-28. Также было показано, что так называемый гетерохронный сигнальный путь включает в себя сразу три высококонсервативных белка — LIN-28, LIN-41 и LIN-29. Однако все еще были описаны только две микроРНК (lin-7 и let-7) и только на C. elegans.
В то же время в 1998–2001 годах происходило сближение исследований микроРНК и РНК-интерференции. Разные коллективы описали РНК-интерференцию у C. elegans и растений, при этом для последних продемонстрировали связь явления РНК-интерференции с малыми молекулами РНК. Большой вклад в эту область внесли исследования белков Argonaute. На основе этих исследований получилось выдвинуть предположение, что микроРНК — это эволюционная адаптация РНК интерференции для регуляции экспрессии генов. Вместо того, чтобы воздействовать на инородную вирусную двухцепочечную РНК, те же механизмы используются для взаимодействия с РНК, экспрессируемой в геноме самого организма. В этом случае белки Argonaute блокируют экспрессию не вирусных генов, а генов самого организма, которые требуется регулировать.
В таком случае, раз РНК интерференция — это высококонсервативный процесс, то и микроРНК должны быть консервативны. И действительно, в 2000 году выходит статья, показавшая, что let-7 консервативен у всех животных.
— Когда эта статья вышла, я даже не знал об этих результатах. Они держали их в секрете для максимального драматического эффекта…
Такая древность микроРНК подтолкнула ученых к мыслям о том, что их должно быть намного больше, чем до сих пор было найдено. Виктор и Розалинда взялись за активный поиск новых микроРНК у C. elegans и действительно нашли множество новых последовательностей.
— Это было очень круто, мы собирались писать статью, но вот в какой-то момент я получаю электронное письмо от редактора Science с просьбой написать рецензию на статью. И я смотрю на абстракт и вижу: «Мы клонировали множество новых микроРНК»… И я ответил ему, что я не могу написать рецензию, потому что у нас есть такие же результаты и не можем ли мы прислать нашу рукопись. Он ответил, что можем, но статья должна быть у них до конца недели.
В итоге Science в октябре 2001 года опубликовал работы трех коллективов о большом разнообразии микроРНК у самых разных организмов, после чего интерес к микроРНК еще возрос. Дальнейшие исследования показали в том числе, что miR-100 древнее, чем билатеральные животные.
Мишени зерна
В следующей части лекции лауреат более подробно рассказал о механизме работы микроРНК. Первое исследование, описавшее процесс узнавания мишени микроРНК, было опубликовано в 2005 году группой Юлиуса Бреннеке и Стивена Коэна. За узнавание мишени отвечает так называемое зерно (seed) — консервативный участок микро-РНК; именно те комплементарные участки, которые нашли Эмброс и Равкан между lin-4 и lin-14. Так как и зерно, и его мишень высококонсервативны, можно искать потенциальные мишени конкретной микроРНК на основе последовательности ее зерна.
В отличие от коротких интерферирующих РНК (siRNA), микроРНК не идеально комплементарны своим мишеням. Наличие несовпадений позволяет белку Argonaute связаться с таргетной мРНК, но не запускает процесс разрушения мишени, как в случае с РНК-интерференцией. Это добавляет пластичности системе и позволяет сформировать так называемую программируемую репрессию — с Argonaute на мРНК, в свою очередь, связываются регуляторные белки, которые могут репрессировать трансляцию и (или) дестабилизировать мРНК, приводя к ее разрушению. В качестве примера репрессии без разрушения Эмброс привел работу Бреннеке, опубликованную в 2003 году. В ней была описана репрессия белка HID у дрозофилы и показано, что в присутствии специфичной микроРНК Bantam экспрессия белка нарушается, но мРНК все еще обнаруживается.
Программы для поиска мишеней микроРНК по последовательности зерна, с одной стороны, почти не выдают ложноположительных результатов. С другой стороны, например, для let-7 найдены мишени в 134 генах у C. elegans, однако большинство мутантных фенотипов связано с нарушением репрессии одного гена. Поэтому причина такого разнообразия потенциальных мишеней все еще остается открытым вопросом. При этом на одни и те же консервативные гены у разных организмов (нематод, мух, человека) часто воздействуют совершенно разные микроРНК, что указывает на адаптивную роль приобретения и потери таргетных сайтов.
Лауреат кратко перечислил описанные к настоящему времени функции, которые могут выполнять микроРНК в организме — переключение программ развития, перепрограммирование клеточных типов, координацию комплексов генов и комплексов из множества белков, «буферизация» генного сигнала (превращение шумного сигнала в менее шумный).
Далее Эмброс рассказал об исследовании по «лишению» эмбриона рыбы микроРНК через мутацию белка Dicer. Эмбрион развивался, но получался сильно более простым, с меньшим числом типов клеток и крайне низкой стрессоустойчивостью. Еще одно исследование по отключению микроРНК на дрозофилах показало, что мухи без микроРНК могут развиваться нормально, но только при замедленном метаболизме. Таким образом, микроРНК способствуют клеточному разнообразию, повышают устойчивость к стрессу, а также позволяют активировать метаболизм.
Завершающая часть лекции была посвящена роли микроРНК в заболеваниях человека.
Существует комплекс мутаций белков Argonaute, которые могут спонтанно возникать у человека и приводят к нарушениям развития нервной системы (NDD). Обычно это делеции сразу нескольких генов — индивидов, несущих нокаут одного гена, к настоящему времени обнаружено не было. В то же время единственная нуклеотидная замена в одном из генов семейства Argonaute может вызвать NDD. Отсюда вопрос, может ли подобная замена привести к нарушению микроРНК регуляции в большом масштабе.
Группа Эмброса обнаружила у C. elegans именно такой случай. У нематод есть два белка Argonaute, функции которых пересекаются. Поэтому при полной делеции одного из них второй до некоторой степени компенсирует потерю. Но если один из белков несет определенную точечную мутацию, то он все еще экспрессируется и все еще способен связываться с мРНК (не давая взаимодействовать с ней «здоровому» белку), однако не способен репрессировать трансляцию. В итоге точечная мутация в гене приводит к большей дерегуляции, чем его полная делеция.
Дальнейшая работа с человеческими микроРНК на модели нематод подтвердила полученные результаты — были найдены две мутации, вызывающие сильные последствия для фенотипа. При этом различные комбинации мутаций по-разному воздействовали на разные группы микроРНК и нижележащие сигнальные пути.
В заключение Виктор Эмброс поблагодарил Розалинду Ли и Ронду Фейнбаум за открытие lin-4 микроРНК, Гэри Равкана за разделенные тяготы, открытия и награды и снова Розалинду Ли — уже как свою жену.


 Меню
Меню





 Все темы
Все темы
 Worm Breeder's Gazette |
Worm Breeder's Gazette |




 0
0