Как долго может прожить человек. Рассказывает Александр Тышковский из Гарвардской медицинской школы
Что такое возраст и старение, какие есть болезни старения, как можно продлить жизнь и как скоро появятся лекарства против старения. На эти и другие вопросы отвечает Александр Тышковский, инструктор по медицине Гарвардской медицинской школы и старший научный сотрудник НИИ ФХБ им. А.Н. Белозерского МГУ.

За счет чего некоторые особи живут дольше своих сородичей, а голый землекоп — дольше мышей и крыс? Долголетие кита и летучей мыши поддерживают одни и те же механизмы или разные? Синхронно ли стареют ткани и органы одного индивида? Есть ли у кита и голого землекопа «рецепты», способные продлить нашу жизнь? Ответы на эти вопросы начинают формулироваться. В июне 2023 года вышла фундаментальная статья в журнале Cell за авторством Александра Тышковского и его коллег о связи между активностью генов и продолжительностью жизни у 41 вида млекопитающих.
Вы исследовали 41 вид, это очень много млекопитающих. Вы измерили уровень экспрессии более десяти тысяч генов в их органах, это очень много генов. Вы изучили влияние на старение потенциальных лекарств. Вы сами, ваша лаборатория все делали, или взяли уже готовые данные из баз китов и мышей?
Часть данных, которые мы использовали — уже опубликованные, часть мы секвенировали сами. Как это делается? Берется животное, добываются из него органы. В нашем случае мы рассматривали печень, почки, мозг, прежде всего потому, что по этим органам есть больше всего данных. Нам было интересно посмотреть сразу на несколько органов, чтобы понять, насколько универсальны механизмы долголетия между разными тканями. Дальше из этих органов мы выделяем РНК и секвенируем ее. В результате получаем уровень экспрессии для каждого из 15–20 тысяч генов. Это позволяет исследовать различные интересные закономерности — например, активность каких генов связана с долголетием млекопитающих. Благодаря тому, что все млекопитающие довольно близки друг к другу генетически, мы можем сравнить экспрессию одних и тех же генов в печени мыши, печени человека и печени кита...
У вас в лаборатории есть печень кита?
Да, есть. Не целая печень, конечно, для этого целой лаборатории не хватило бы, но маленькие кусочки по несколько граммов. Этого достаточно, чтобы выделить РНК и посмотреть по каждому гену, насколько он активно экспрессируется у долгоживущих видов животных по сравнению с короткоживущими. Благодаря тому, что в нашем анализе фигурировало несколько десятков видов животных с разной продолжительностью жизни, мы смогли выявить молекулярные механизмы, поддерживаемые эволюцией у самых разных долгоживущих млекопитающих, позволяющие им дольше не стареть.
Говоря о старении, насколько оно синхронизировано между органами? Может ли в разных тканях этот процесс идти с разной скоростью, допустим, печень молодая, а почки старые?
Старение более-менее синхронизировано между органами, но в некоторых случаях дисбаланс наблюдается. Бывают индивидуальные особенности: у одного человека быстрее накапливаются повреждения в почках, у другого – в кровеносных сосудах, в результате чего у первого возникает почечная недостаточность, а у второго — атеросклероз. Но есть и универсальные закономерности. Например, заболевания некоторых органов наступают у людей только в достаточно пожилом возрасте.
Самый яркий пример — нейродегенеративные заболевания: болезнь Альцгеймера или Паркинсона. Это одни из самых поздних заболеваний, обычно они начинают проявляться у людей с 60 лет и позже. Наши нервные клетки могут дольше поддерживать свое функциональное состояние, не скатываясь в патологию. Раковые заболевания, наоборот, — из тех болезней, которые начинают возникать у некоторых людей уже в 40 лет. Другой интересный пример — это клетки половой линии. Когда мы применяем наши молекулярные часы старения к этим клеткам, мы видим, что они стареют гораздо медленнее, чем соматические клетки. Это логично, ведь с точки зрения эволюции половые клетки — самое важное, что у нас есть, именно из них получатся наши потомки. По сути, вся функция нашего тела — обеспечивать половые клетки, поэтому имеет смысл дольше поддерживать их в молодом здоровом состоянии, чтобы они могли давать начало следующим поколениям.
Долголетие не всегда выгодно
Есть организмы, которые размножаются один раз за жизнь либо за очень ограниченное время, например, за один сезон. Им выгодно быстро умирать, потому что таким образом они могут повысить выживаемость своих потомков. Например, тихоокеанский лосось, один из его видов — горбуша. Перед нерестом это красивая молодая рыба, полная сил. Но сразу после нереста у нее начинаются активные патологические процессы, она очень быстро состаривается: вырастает горб, то есть искривление позвоночника, появляются проблемы с челюстями, и она быстро умирает. Если такой рыбе заранее вырезать половые железы, то этого не произойдет. Она будет стареть, но медленнее, и умрет позже. Горбуша размножается в реках, где очень мало еды, и ее смерть позволяет потомству прокормиться на останках родителя. Это самопожертвование ради потомков. Оно эволюционно выгодно, если каждая особь вида размножается один раз: биологическая функция выполнена, дальше жить незачем.
У большинства млекопитающих другая стратегия: мы размножаемся много раз за жизнь. Более того, мы еще должны позаботиться о своем потомстве. Так что наша смерть эволюции не выгодна, напротив — вредна. Поэтому начинает действовать естественный отбор на долголетие. У человека это выражено особенно ярко: мы одни из немногих видов млекопитающих, кто продолжает жизнь после полной потери возможности размножаться — менопаузы. Самая популярная гипотеза, объясняющая этот феномен, называется «гипотезой бабушки»: даже перестав размножаться, женщины продолжают вносить свой вклад в потомство, помогая детям заботиться о внуках.
 Горбуша во время нереста. Аляска. Credit: Bering Land Bridge National Preserve | CC BY 2.0 | wikimedia.org
Горбуша во время нереста. Аляска. Credit: Bering Land Bridge National Preserve | CC BY 2.0 | wikimedia.org
Как вы объясняете синхронизацию старения органов?
Существует механистическое объяснение: все наши органы и ткани взаимосвязаны через кровеносную систему, благодаря чему они могут обмениваться в том числе и молекулярными повреждениями. Одна из интересных моделей замедления старения и даже омоложения называется «гетерохронный парабиоз». Суть простая: вы берете старую мышь и молодую мышь и сшиваете их кровеносные системы. И если через несколько месяцев расшить их обратно, старая мышь будет жить немного дольше, чем мышь, которую вместо этого сшили со старой. Более того, в процессе парабиоза молодая мышь немного омолаживает старую: во многих органах снижается биологический возраст, улучшается регенерация тканей, наблюдается рост кровеносных сосудов и нейрогенез. Несмотря на то, что соединялась только кровеносная система, через нее обеспечивался системный эффект по всему телу.
С эволюционной точки зрения синхронизацию старения можно объяснить тем, что естественный отбор на долголетие действует с равной силой на большинство систем организма. Представим себе ситуацию, что все органы животного выходят из строя в 70 лет, а почки — скажем, в 200 лет. Тогда со временем у потомства организма будут накапливаться мутации, которые выводят почки из строя немного раньше. Ведь такие мутации не будут отбраковываться отбором, так как организм все равно будет умирать в 70 лет из-за болезней в других органах. Со временем накопившиеся мутации приведут к тому, что почки будут функционировать примерно столько же, сколько и остальные органы.
Александр Тышковский очень молод, ему 32 года, но он занимается проблемами старения, причем в Гарварде, что само по себе для любого биолога выглядит как покорение Фудзи в ненастье. О себе он говорит так: «Я с детства интересовался этой темой. Тут есть личная история. У меня рано умерли бабушка и дедушка, как раз от возрастных заболеваний: бабушка — от рака, а дедушка — от сердечно-сосудистых заболеваний. И это было большим ударом для меня. Через несколько лет моя школьная учительница по биологии Вера Евгеньевна Зайцева рассказывала нам о механизмах старения — в частности, об укорочении теломер и накоплении повреждений в ДНК. И когда она упомянула, что в наших клетках есть специальные системы, позволяющие бороться с этими процессами — удлинять теломеры, чинить ДНК и так далее, — а некоторые животные вроде голого землекопа умудряются практически не стареть на протяжении всей своей жизни, меня это поразило. До этого я и подумать не мог, что со старостью можно бороться: в детстве я всегда воспринимал этот процесс как нечто неизбежное, как то, что нужно просто принять как данность. А тут оказалось, что способы замедлить старение не просто существуют — они уже реализованы природой, в том числе в наших собственных клетках. Так во мне зародилась идея, что старение — это не приговор, а научная задача, которую нужно решить. Затем я поступил в МГУ на факультет биоинженерии и информатики, и нашим деканом был академик Владимир Петрович Скулачев. Как можно было не заинтересоваться этой темой еще больше с таким деканом? Поэтому, когда после выпуска из МГУ у меня появилась возможность попасть в лабораторию Вадима Гладышева в Гарвардском университете, лидера в этой области, у меня не было ни доли сомнения. Мы с ним созвонились и сразу нашли общий язык. Так я попал к Вадиму. Я делал у него проект для защиты диссертации (PhD), а сейчас работаю в должности инструктора по медицине.
Александр Тышковский
Если говорить о старении в целом, мне кажется, что на сегодняшний день нет более важной проблемы в биологии. Она важна как с фундаментальной, так и с практической точки зрения. С фундаментальной точки зрения — это одна из совершенно не решенных проблем в биологии. С инфекциями мы довольно неплохо научились бороться, даже с ВИЧ, неплохо справляемся с раком, но со старением человека сделать ничего не можем. Даже по механизмам старения в научном сообществе все еще нет полного консенсуса. С практической точки зрения старение — это главная причина смертности человека на сегодняшний день, более 70% смертей по всему миру вызваны старческими заболеваниями. Как можно не интересоваться этой проблемой? Радует, что в настоящее время интерес к биологии старения проявляют не только ученые, но и крупные инвесторы. За последние годы несколько компаний-гигантов, такие как Гугл и Амазон, создали дочерние компании, которые занимаются разработкой терапий против старения. В случае Амазона — это Altos Labs, в случае Гугла — Calico Labs. И если раньше биологией старения занимались лишь энтузиасты, на сегодняшний день она уверенно выходит на первый план».
Как вы определяете биологический возраст?
В нашей лаборатории мы пользуемся двумя основными методами. Во-первых, биологический возраст можно предсказать по активности некоторых генов. Высокопроизводительное секвенирование позволяет одновременно измерять уровень тысяч самых разных молекул-биомаркеров. То есть мы видим, сколько копий РНК считывается с конкретных генов, которых у нас порядка 25 тысяч. И мы можем на каждый ген посмотреть, насколько он активен у молодого организма, у старого, у короткоживущего, у долгоживущего, затем измерить уровень этих генов у конкретного организма и оценить его биологический возраст.
Кроме того, возраст можно предсказать по метилированию ДНК — это один из методов эпигенетического контроля, регулирующий активность генов. Обычно если промотор гена метилирован, то ген не считывается, а если деметилирован, то ген активен. На основе метилирования ДНК построены молекулярные часы старения, которые с высокой точностью предсказывают возраст организма, причем неважно, мышь вы или кит.
Почему метилирование — это такой универсальный маркер, генетические часы старения?
Само по себе метилирование ДНК — это простая химическая реакция присоединения CH3 группы к цитозинам. Эта реакция контролируются ферментами: метилтрансферазы навешивают метильную группу, а деметилазы ее снимают. В клетках есть некий баланс метилтрансфераз и деметилаз, который определяет равновесный уровень метилирования. То есть если мы не будем регулировать работу этих ферментов, метилтрансферазы будут случайным образом метилировать ДНК, а деметилазы — деметилировать, это будет стохастический процесс. Некоторые метильные группы могут не иметь функционального значения, а некоторые важны, потому что они контролируют экспрессию генов. Поэтому в здоровой клетке метилирование ДНК должно контролироваться, например, с помощью транскрипционных факторов или укладки хроматина — в более открытый участок ДНК легче пробраться ферменту.
С возрастом система контроля метилирования ДНК начинает разбалтываться, растет энтропия. Представьте, что у вас есть монетка, которая выпадает то орлом, то решкой, но вы в любом случае переворачиваете ее на «орла», то есть контролируете исход броска. Однако с возрастом вы начинаете отвлекаться, хуже следить за монеткой и пропускать «решки». В результате доля «орлов» будет составлять уже не 100%, а 90%, потом 80% и так далее – вплоть до 50%. Подобный рост стохастики с возрастом мы видим и на уровне метилирования ДНК. Его и измеряют эпигенетические часы.
То есть само метилирование не является причиной старения, это просто показатель?
Многие возрастные изменения метилирования, похоже, действительно нейтральны, но среди них также есть вредные и даже полезные. Например, если метилирование произойдет в нефункциональном участке ДНК, то оно не приведет к заметным последствиям — это будет признаком старения, но не причиной. Но если будет затронут промотор важного гена, он может перестать экспрессироваться, что станет причиной накопления новых повреждений. Если говорить в целом, то с возрастом меняется уровень метилирования сотен тысяч нуклеотидов. Это признак того, что происходит глобальная поломка системы регуляции.
Почему система разбалтывается? Это же не сразу происходит, а очень-очень постепенно? И к тому же у человека есть периоды, когда он находится в одной кондиции, вообще нет признаков старения, 20 лет плюс, например.
Старение может не проявляться на фенотипическом уровне, но внутри клеток эти процессы уже будут идти. Разбалтывание системы контроля начинается еще до нашего рождения — у человека это происходит уже с третьего месяца беременности. В течение жизни эпигенетические часы показывают монотонное постепенное повышение возраста. Однако не во всех сайтах метилирование меняется равномерно: есть и те, которые до какого-то возраста практически не подвержены изменениям, а потом начинают довольно резко приобретать или терять свой статус метилирования.
У нашего организма есть методы борьбы с накопившимся «шумом». Например, в процессе образования половых клеток и репрограммирования биологический возраст клетки откатывается «к заводским настройкам». Правда, несмотря на тщательную защиту половых клеток, с возрастом в них тоже накапливаются некоторые повреждения. Поэтому после оплодотворения в эмбрионе происходит дополнительное снижение биологического возраста — у мышей это наблюдается в течение первых 7–10 дней эмбрионального развития. (Подробнее об этом в интервью с Вадимом Гладышевым. — PCR.NEWS.) Происходит глобальное деметилирование генома, после чего метильные метки заново расставляются в нужных участках ДНК: чем отдельно чинить каждый сайт, проще снять все метильные метки и дальше с нуля расставить их по новой.
Интересно, что в процессе раннего развития происходит починка и других возрастных повреждений. Например, благодаря ферменту теломеразе удлиняются теломеры хромосом. По-видимому, начальная стадия эмбриогенеза — оптимальный момент для устранения возрастных повреждений, чтобы обеспечить организм потенциалом на всю будущую жизнь.
Я повторю вопрос: почему в течение всей жизни планомерно происходит разбалтывание системы регуляции?
Потому что это стохастический процесс: в живой клетке ежесекундно происходят тысячи химических реакций, что неизбежно приводит к появлению побочных продуктов, нежелательным взаимодействиям между ними и так далее. В результате в системе постоянно возникают повреждения, накапливаются ошибки, растет энтропия. А чем больше становится повреждений и ошибок, тем больше вероятность того, что это повредит функционированию всей системы и возникнет патология, фенотипическое проявление.
Из того, что вы говорите, следует, что старение — это накопление поломок. Вы мне рассказываете в этой парадигме.
Да. Эту парадигму сегодня разделяет большая часть научного сообщества.
Старение как растущая вероятность смерти
Старение — широкий феномен, и определять его можно по-разному. Одно из определений демографическое: старение — это увеличение вероятности умереть с возрастом. Когда нам двадцать лет, мы с очень высокой вероятностью — более 99% процентов — доживаем до 21 года, а если нам 100 лет, шанс дожить до 101 года составляет уже меньше 70%. Во взрослом возрасте вероятность смерти человека удваивается каждые 8 лет. Примерно с той же скоростью растет вероятность возникновения различных заболеваний.
Другое определение биологическое: с возрастом в организме возникают повреждения на разных уровнях организации, начиная от молекулярного и заканчивая уровнем целых клеток, тканей и систем органов. Чем лучше организм противостоит накоплению повреждений, тем медленнее стареет. И наоборот.
Как старение проявляется на молекулярном уровне, на уровне биохимии, клеток и тканей? Я спрашиваю о конкретных поломках.
На молекулярном уровне можно выделить образование белковых аггрегатов, повреждения межклеточного матрикса, поломки в ДНК и другие. Причем все эти повреждения могут возникать в ответ на внешние стимулы, вроде ультрафиолетового излучения, но могут появиться и сами внутри организма. Например, у нас с возрастом увеличивается окислительный стресс, нарушается работа митохондрий, появляется больше активных форм кислорода, которые вызывают повреждения различных молекул. Другой пример: в процессе деления клеток укорачиваются теломеры и возникают «опечатки» в ДНК — мутации, которые в дальнейшем могут себя как-то проявить. Например, отключится система апоптоза — клеточного самоубийства — и тогда клетка может стать раковой. Рак — это ведь тоже старческое заболевание, основной механизм которого — повреждения ДНК.
Более широкий уровень — уровень клеток, и тут мы тоже видим патологические изменения. Если какая-то клетка в ткани выходит из строя, на ее место должна прийти новая. Откуда она берется? Есть стволовые клетки, которые могут делиться и давать начало новым клеткам. Их с возрастом становится меньше, поэтому снижается способность к регенерации. Это очень легко наблюдать в бытовых условиях: если вы порезались в молодом возрасте, у вас рана зарастет быстрее, чем у пожилого человека. Другой пример — это накопление с возрастом сенесцентных клеток — «дряхлых» в переводе с английского. Обычно, если в клетке накопилось большое количество повреждений, она это «понимает» и совершает апоптоз, самоубийство. Она избавляет ткань от своего присутствия, и ее остатки аккуратно поедают иммунные клетки. Но иногда этого не происходит — вместо самоубийства клетка останавливает свой клеточный цикл и перестает нормально функционировать, но при этом она остается в ткани. Такая клетка называется сенесцентной.
На самом деле сенесцентность иногда оказывается нужной. Если в органе возникнет сильное повреждение и все клетки совершат апоптоз, это может нарушить структуру ткани — например, появится дырка в стенке кровеносного сосуда. В этом случае путь сенесцентности оказывается меньшим злом, ведь в этом случае клетки продолжат по крайней мере поддерживать целостность ткани. Но при этом они будут приносить и вред, выделяя в ткань факторы воспаления.
Это подводит нас к следующему уровню — системному. Самый яркий пример — это хроническое воспаление, которое нарастает с возрастом и из-за которого даже инфекционные заболевания тяжелее переносятся у пожилых людей. Можно вспомнить ковид, самое тяжелое проявление которого — это цитокиновый шторм, когда воспалительный ответ выходит из-под контроля. В результате погибают не только клетки, зараженные вирусом, но и здоровые клетки легочного эпителия — больной теряет возможность дышать.
Другой пример — возрастное ухудшение васкуляризации, то есть кровоснабжения ткани. Хуже снабжаются кровью, а значит, кислородом и питательными веществами, ткани мозга, сердца и так далее. Это приводит к тому, что клетки начинают погибать. Поэтому некоторые методы борьбы со старением направлены на то, чтобы улучшить васкуляризацию, чтобы кровеносные сосуды лучше снабжали наши ткани. Есть такой знаменитый фактор VEGF, который активирует рост сосудов и кровоснабжение: было показано, что, если дополнительно активировать его экспрессию у мышей, это продлевает им жизнь на 35–45%. Кстати, VEGF часто активируется раковыми клетками, поскольку для активного деления им требуется много энергии и питательных веществ. Поэтому один из методов борьбы с раком — блокировка этого фактора. Этот пример показывает, что одна и та же терапия может быть полезной в здоровых организмах и вредной — в больных.
Эти наблюдения не отменяют вопроса: старение — это накопление поломок, или есть программа с центром управления биологическими часами.
Я бы сказал, что у нас, как и у большинства млекопитающих, нет программы старения, скорее наоборот — есть программа выживания. В наших клетках есть целые системы белков, функция которых — починка повреждений и утилизация поломанных молекул и клеток. Но у разных животных эти системы работают лучше или хуже, в зависимости от того, насколько эволюция поощряет их долголетие — насколько долгая жизнь помогает этим организмам передавать свои гены. Нам, например, долголетие очень помогает — чем дольше мы проживем, тем больше оставим потомства и лучше о нем позаботимся. А мышам долголетие не очень-то нужно, потому что в дикой природе мышь почти гарантированно съедят в течение одного-двух лет. Неважно, молодая она или старая, ее съедят, ведь существует много мелких хищников, которые питаются мышами, — змеи, кошки, совы, лисицы и т.д. Если мышь будет бессмертной, это не даст ей никаких дополнительных преимуществ. И зачем ее клеткам тратить столько энергетических ресурсов и поддерживать очень эффективные системы починки повреждений, которые бы позволили ей жить десятки лет, если ее все равно съедят за два года?
Но есть ведь кандидат на централизованное управление — супрахиазматическое ядро гипоталамуса, гормональная регуляция. Я это от Скулачева слышал…
Супрахиазматическое ядро гипоталамуса — это действительно важный регион нашего мозга, отвечающий за координацию циркадных ритмов в организме. С возрастом нарушается работа и этой системы, что, в частности, приводит к ухудшению качества сна и бессоннице у пожилых людей. Однако наличие подобных центров управления не говорит о том, что они специально запускают процесс старения. Ведь, как и любые биологические системы, они также не застрахованы от накопления повреждений, которые неизбежно будут возникать в этих тканях с возрастом. Разница лишь в том, что поломки в центрах управления могут привести к более системному эффекту для всего организма, чем повреждения периферийных органов.
То же касается и гормонов: они могут частично регулировать скорость старения, наиболее ярко это наблюдается на примере тихоокеанского лосося. Впрочем, и у нас гормоны влияют на скорость накопления повреждений. Например, один из гормонов гипофиза — это гормон роста, соматотропин. Помимо того, что он способствует росту тканей, он напрямую влияет на системы починки повреждений наших клеток, а именно — он их подавляет. И если вы полностью заблокируете активность гормона роста, например, у мышей, вы получите очень маленьких животных, но они будут жить в полтора раза дольше и реже болеть многими возрастными заболеваниями. У некоторых людей-карликов также встречается подобная мутация. Благодаря этому они практически не болеют раком и диабетом второго типа — болезнями, от которых умирает каждый пятый человек на планете.
Другой пример — мужской половой гормон тестостерон. Тестостерон ускоряет инволюцию тимуса, одного из органов иммунной системы, который нужен для созревания Т-клеток. C возрастом тимус зарастает жировой тканью, и тестостерон ускоряет этот процесс. А женский половой гормон — эстрадиол — наоборот, положительно сказывается на работе иммунной системы: он подавляет хроническое воспаление. Если кормить самцов мышей модифицированным женским половым гормоном — 17-α-эстрадиолом, они будут жить дольше. Причем только самцы: самкам дополнительное введение не помогает. То есть гормоны действительно влияют на наше старение, но чаще всего это связано с тем, что организм вынужден переключаться между режимом роста и размножения и режимом выживания.
Самый известный молекулярный путь, который связан с долголетием, — это сигнальный путь инсулина, он как раз является тем самым переключателем. Инсулин вырабатывается в ответ на потребление пищи и направляет клетки в сторону роста и размножения: клетка запасает вещества, растет, делится. А если пищи нет, вместо этого активируется система починки повреждений. С точки зрения эволюции это логично: если вы окружены пищей, то ваша главная задача в этих условиях — быстрее размножиться. Не так важно, сколько вы после этого проживете. А если еды нет, то размножаться вы не можете: вы не прокормите ни себя, ни потомство. Остается выживать до лучших времен, когда появится еда. Это один из самых универсальных переключателей в живой природе: если вы посадите мышь, червяка или даже пекарских дрожжей на умеренную низкокалорийную диету, эти организмы проживут дольше. Но во время диеты у них будет подавлена репродуктивная функция.
Существует ли феноптоз
Владимир Петрович Скулачев развивал представление о феноптозе — специальной программе старения, которая детерминирует срок жизни особи, выгодный с точки зрения эволюции, независимо от имеющегося «ресурса» организма. Если такая программа существует, то ее отключение продлило бы жизнь. Согласно представлениям, существующим сегодня, у большинства млекопитающих необходимости в такой программе нет: старение может возникать в результате случайного накопления повреждений, с которыми нет смысла бороться, если дальнейшая жизнь не повышает приспособленность организма.
Когда мы говорим о старении как о накоплении поломок... Понимаете, выпадает кое-что. Есть же болезни ускоренного старения. Причем это генетически запрограммированная штука. Значит, какая-то программа есть?
Да, есть ряд наследственных заболеваний, вызывающих прогерию — синдром ускоренного старения, механизмы их достаточно хорошо известны. Прогерия обычно возникает из-за того, что ломается какой-то существенный компонент поддержания целостности клетки. Например, один из видов прогерии человека — синдром Коккейна —— связан с нарушением репарации ДНК. Мутированный белок хуже чинит поломки в ДНК, там быстрее накапливаются повреждения, и это ускоряет старение. Тут важно, что мы знаем много случаев, когда мутации в генах системы выживания приводят к тому, что организмы живут в 5–10 раз меньше. Но нам неизвестны случаи, когда у мыши или человека в результате каких-либо мутаций ломалась бы программа старения, благодаря чему они бы жили на порядок дольше. То есть наличие прогерий и отсутствие синдромов замедленного старения — хороший довод в пользу того, что у нас есть программа выживания, но нет программы старения, которую можно было бы отключить, сломав пару генов.
А каким же образом одни организмы живут дольше, другие меньше? Полярная акула живет 450 лет, и половое созревание у нее только в 150 лет, а мышка живет два года. С точки зрения эволюции вы хорошо объяснили, но ведь должны же быть биологические механизмы!
Давайте начнем с ярких примеров долголетия. Знаменитые голые землекопы — рекордсмены среди грызунов, живут больше 40 лет, и до сих пор непонятно, какой у них предел. Они демографически не стареют: у них вероятность смерти с возрастом не растет, по крайней мере, до 25–30 лет, дальше мы просто пока не знаем. Обычно у млекопитающих смертность начинает увеличиваться сразу после полового созревания, но у голого землекопа на протяжении десятилетий этого не происходит, хотя половое созревание наступает в течение первого года жизни.
 Голый землекоп Heterocephalus glaber. Credit: 123rf.com
Голый землекоп Heterocephalus glaber. Credit: 123rf.com
Когда стали изучать, почему голые землекопы так долго живут, оказалось, что у них нет какого-то одного «ключика» против старения. Вместо этого эволюция предоставила им целую связку ключей, каждый из который направлен против определенного механизма старения. Например, у них выше экспрессия генов репарации ДНК, выше уровень аутофагии — утилизации поврежденных компонентов систем клетки. Также их митохондрии эффективнее нейтрализуют активные формы кислорода, а клетки более восприимчивы к своим соседям — это называется ранним контактным ингибированием: когда клетка понимает, что вокруг нее близко находятся другие клетки, она останавливает свой клеточный цикл, что снижает риск развития рака. Кстати, этот механизм у голого землекопа отчасти достигается благодаря высокомолекулярной гиалуроновой кислоте, которая находится в межклеточном веществе и, взаимодействуя с клетками, останавливает их активный рост и пролиферацию. Наконец, у землекопов есть нетривиальный механизм усиления экспрессии одного из генов-онкосупрессоров — гена PTEN. В ДНК этих животных есть 17 псевдогенов PTEN: и хотя они не экспрессируются, они привлекают на себя регуляторные микроРНК. Из-за этого те хуже связываются с мРНК функциональной версии гена, и PTEN активнее считывается рибосомами.
У других видов-долгожителей такие же механизмы долголетия?
Наша работа отчасти дает ответ на этот вопрос. Сравнив активность генов у 41 вида млекопитающих с разной продолжительностью жизни, мы увидели, что у многих животных-долгожителей была повышена экспрессия генов репарации ДНК. Более того, выяснилось, что некоторые механизмы долголетия свойственны не только китам и голым землекопам, но и долгоживущим мышам — тем, кому удалось продлить жизнь диетами, лекарствами и генетическими воздействиями. Среди них оказались гены, связанные с сигнальным путем инсулина. В частности, экспрессия гена инсулиноподобного фактора роста Igf1 была понижена как у долгоживущих видов млекопитающих, так и у мышей-долгожителей. Видимо, подавление сигнального пути инсулина — это действительно один из ключевых механизмов долголетия, на который воздействует не только низкокалорийная диета, но и естественный отбор в ходе эволюции.
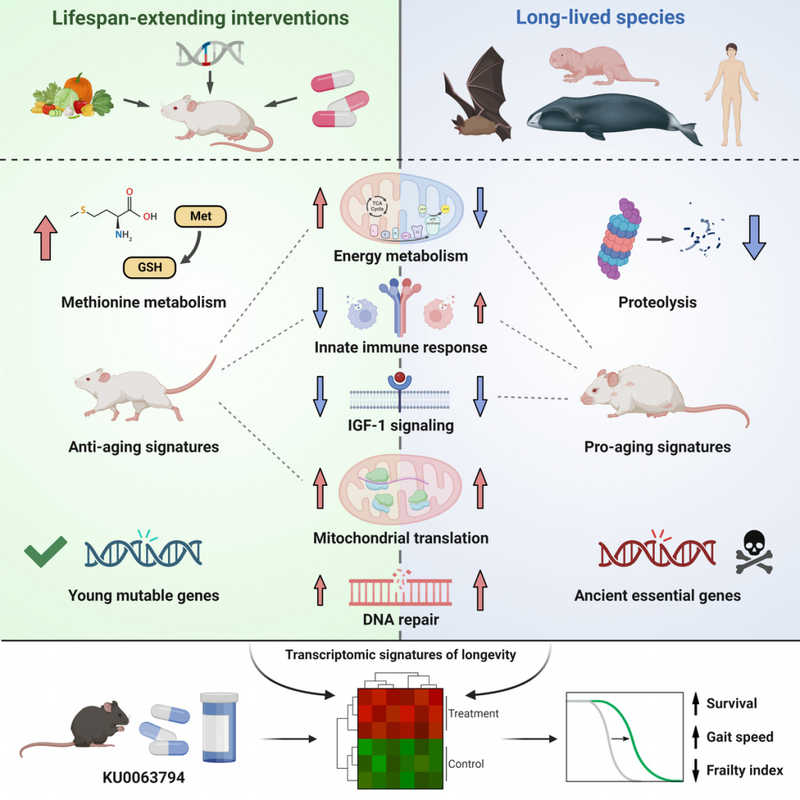 Графический абстракт статьи Александра Тышковского и соавторов в Cell. Исследование генной экспрессии у долгоживущих видов и у мышей, на которых воздействовали факторами, продлевающими жизнь, выявило некоторые общие черты у той и другой группы. А ингибитор mTOR KU0063794 продлевал жизнь старых мышей и положительно коррелировал с транскриптомными биомаркерами долголетия. Credit: Cell. 2023. DOI: 10.1016/j.cell.2023.05.002
Графический абстракт статьи Александра Тышковского и соавторов в Cell. Исследование генной экспрессии у долгоживущих видов и у мышей, на которых воздействовали факторами, продлевающими жизнь, выявило некоторые общие черты у той и другой группы. А ингибитор mTOR KU0063794 продлевал жизнь старых мышей и положительно коррелировал с транскриптомными биомаркерами долголетия. Credit: Cell. 2023. DOI: 10.1016/j.cell.2023.05.002
Но было и много отличий на межвидовом и внутривидовом уровнях. Одно из них — гены, связанные с иммунным ответом. На внутривидовом уровне это так: мышка дольше проживет, если мы подавим ей активность врожденного иммунитета, особенно если речь идет о пожилой мыши, у которой нарастает хроническое воспаление. Однако у долгоживущих видов млекопитающих — у китов, человека, летучих мышей — активность генов врожденного иммунитета оказалась повышена. В чем дело? Вероятно, в том, что системы врожденного иммунитета исходно нужны для защиты организма. Например, система комплемента помогает очищать организм от патогенов и остатков погибших клеток, однако в то же время она стимулирует воспалительный ответ. Поэтому если эта система активна с самого рождения, она может увеличить продолжительность жизни, но в пожилом возрасте она начинает играть против нас, и ее лучше подавлять.
Другой пример — это энергетический метаболизм, то есть активность генов, которые нужны для расщепления питательных веществ: глюкозы, жиров и так далее. С возрастом активность таких генов падает, катаболизм идет хуже, и это, кстати, одна из причин, почему люди с возрастом полнеют — у нас замедляется расщепление жиров. У долгоживущих мышей эти гены активируются, а вот на межвидовом уровне, если мы сравним кита с мышью, мы увидим, что у кита экспрессия этих генов значительно ниже. Получается, животным-долгожителям свойственна низкая скорость метаболизма. Правда, у этой теории есть исключения. Например, летучие мыши: у них очень быстрый метаболизм, особенно во время полета, но при этом они живут достаточно долго.
Рукокрылые долгожители
Летучие мыши живут долго по сравнению с другими схожими по размеру животными, хотя они буквально нашпигованы патогенными вирусами. Это объясняется тем, что организм летучих мышей умеет держать под контролем хроническое воспаление. Полет очень энергозатратен — во время полета метаболизм летучих мышей усиливается, а температура тела поднимается выше 40 °С. У человека это признак серьезной лихорадки, а для летучей мыши — норма. При такой высокой температуре необходимо понижать уровень хронического воспаления, иначе животное умрет от цитокинового шторма. Эволюционным следствием этого стало то, что вирусы стали лучше размножаться в летучих мышах, а у летучих мышей в ответ на это появилась чувствительная и эффективная интерфероновая защита, позволяющая быстро реагировать и избавляться от РНК вируса. Но и среди летучих мышей есть свой долгожитель — ночница Брандта, живущая больше 40 лет. Геномный анализ этой мыши показал, что у нее есть мутации в гене рецептора инсулиноподобного фактора роста IGF1.
 Ночница Брандта Myotis brandtii. Credit: Herman Lankreijer | CC BY 2.5 | wikimedia.org
Ночница Брандта Myotis brandtii. Credit: Herman Lankreijer | CC BY 2.5 | wikimedia.org
Будут ли таблетки, которые продлевают жизнь? Предотвращают старение? Вроде бы уже сенолитики испытывают в США.
Сенолитики — это лекарства, направленные на уничтожение сенесцентных клеток. В целом вещества, замедляющие старение, называются геропротекторами. Сенолитики на сегодняшний день не самый эффективный вид терапии против старения. Однако некоторые ученые считают их перспективными. Есть стартапы, которые их разрабатывают, самый известный из них — Unity Biotechnology. В 2019 году у них неудачно закончились клинические испытания препарата UBX0101. Они выбрали остеоартроз в качестве модели, и улучшений у пациентов не было. Конечно, это не значит, что лекарство неэффективно против других заболеваний, возможно, просто неудачно была выбрана модель болезни. А в прошлом году тестировался сенолитик против макулодисторфии — и эти клинические испытания второй фазы закончились успешно: у людей улучшилась острота зрения, замедлилось прогрессирование заболевания.
Если мы говорим про геропротекторы в целом, то пока нет лекарств, доказанно продлевающих жизнь здоровым людям. Но есть неплохие кандидаты — эффективные вещества, продлевающие жизнь самым разным животным. Самое известное из них — рапамицин. Это ингибитор комплекса mTOR, ключевого компонента сигнального пути инсулина. То есть рапамицин бьет прямо в сердце основного пути-регулятора долголетия. На человеке пока не проводились клинические испытания рапамицина на здоровых людях, и до этого я бы не рекомендовал его употреблять: рапамицин подавляет иммунную функцию и на человеке обычно применяется при трансплантации органов.
А если на очень старых людях попробовать? У них все равно воспаление идет постоянным фоном.
Вполне возможно: у мышей рапамицин продлевал жизнь, даже когда его давали только в старом возрасте. Но пока не будут проведены клинические испытания, мы не можем быть уверены.
Есть и другие геропротекторы, которые активно применяются для помощи людям с диабетом II типа. Например, метформин и акарбоза. На мой взгляд, акарбоза — это один из самых удачных кандидатов в геропротекторы на сегодняшний день: она эффективна у животных и имеет мало побочных эффектов. Акарбоза связывает в кишечнике фермент амилазу, который расщепляет крахмал. В норме мы едим картошку, крахмал разрезается амилазой, и получившиеся сахара попадают в кровь. Акарбоза не дает этому произойти. Крахмал как пришел с картошечкой, так и вышел в неусвоенном виде. Интересно, что акарбоза даже в кровь не попадает, работает в кишечнике, но этого достаточно, чтобы продлить жизнь мышам примерно на 10%. Если перевести на людей, это будет 10 лет жизни — неплохо для одного вещества.
И есть совсем забавные вещества, которые помогают животным. Например, аминокислота глицин. Ее потребление продлевает жизнь мышам — правда, всего на 4–6%, но глицин безопасен, мы регулярно потребляем его с пищей, и его продают в качестве БАДов. Правда, глицин часто рекламируют как ноотроп (вещество, улучшающее когнитивную функцию), что парадоксально, ведь через гематоэнцефалический барьер он не проходит, а значит, в мозг не попадает. Но механизм, через который глицин может замедлить старение, более-менее известен: он подавляет воспаление и активирует аутофагию.
Также есть некоторые генные терапии, способные продлить жизнь посредством доставки нужных генов. Один из ярких примеров здесь — теломераза, фермент, который удлиняет теломеры. Есть несколько работ, в которых активация теломеразы продлевала жизнь мышам на 10–20%. Причем, это не приводило увеличению риска развития рака.
Есть еще антиоксиданты, про которые столько говорят. В косметике на кожу действует, сам использую…
С антиоксидантами интересный вопрос. С одной стороны, окислительный стресс — это механизм старения: активные формы кислорода повреждают мембраны наших клеток, белки, даже ДНК. С другой стороны, если мы посмотрим на людей, которые принимают добавки с антиоксидантами, например, витамины А и Е, то окажется, что они умирают не реже, а наоборот, немного чаще, чем те, кто их не принимает. Почему это так? На самом деле активные формы кислорода используются организмом, чтобы уничтожать раковые клетки. Поэтому если человек находится в предраковом состоянии, антиоксиданты могут ему только навредить.
Есть поразительная работа, где заядлым курильщикам давали добавку с бета-каротином — предшественником витамина А. Оказалось, что курильщики, которые принимали бета-каротин, умирали в полтора раза чаще, чем курильщики, которые его не употребляли. То есть, если вы курите, морковка вам строго не рекомендуется. Это показывает, что антиоксиданты, вероятно, могут предотвратить возникновение болезни на ранних этапах, но в дальнейшем эффект от них может быть противоположным. Однако при определенных заболеваниях они могут быть эффективны. Например, ионы Скулачева — это ведь тоже антиоксиданты, и по данным клинических испытаний они помогают больным с синдромом сухого глаза.
Можно ли откатать назад, не замедлить, а резко омолодить организм? Вернуть 50-летнего в состояние 20 лет? Есть ли подобные работы на мышках?
Это вопрос нетривиальный. На сегодняшний день есть возможность сделать это с отдельными клетками. Мы можем взять клетку пожилого человека или мыши и откатить ее в эмбриональное состояние. Эта технология называется «клеточным репрограммированием», за нее в 2012 году Синъя Яманака получил Нобелевскую премию. Полученная клетка будет молодой, и дальше из нее мы можем вырастить человеку новые клетки — кожи, мышц, печени. При этом они тоже будут сохранять молодое состояние. Это значит, что теоретически мы можем взять каждую клетку нашего организма из 50 триллионов, омолодить ее и вернуть на место. Теоретически возможно, практически маловероятно. Поэтому сейчас ученые придумывают другие решения.
Можно заменять больным только наиболее поврежденные клетки — например, выращивать людям с болезнью Паркинсона новые дофаминергические нейроны. Эта технология сейчас проходит клинические испытания: пару лет назад было показано, что прогрессирование заболевания у таких пациентов замедляется. Или, если у вас вышел из строя какой-то орган, можно попробовать вырастить новый из ваших омоложенных клеток. Причем, поскольку молодые клетки будут клетками вашего собственного организма, иммунитет не будет их отторгать. Сейчас это активная область в биологии: для выращивания органов используют в том числе 3D-принтеры. Например, в одной из работ у пациента брали старые клетки, их возвращали в эмбриональное состояние, выращивали молодые клетки сердечной мышцы и стенок сосудов, и дальше слой за слоем на 3D-принтере печатали целое сердце. Пока технология сырая, но со временем вполне может стать рабочей.
На ваш взгляд, теми технологиями, которые уже сейчас известны на мышках, насколько можно увеличить продолжительность жизни человека?
Есть некоторые работы математического моделирования, которые показывают, что с помощью этих методов вряд ли удастся продлить жизнь человеку более чем до 150 лет. На сегодняшний день рекорд — 122 года. Фактически у нас получается плюс 25% к максимальной продолжительности жизни. Это уже здорово, потому что за последние 100 лет продолжительность жизни пожилых 70-летних людей увеличилась всего на 5 лет. Но все равно эти цифры теоретические. Что можно сказать уверенно: скорее всего, из десятков технологий, которые продлевают жизнь животным, хотя бы некоторые сработают и на человеке. Просто статистически. Потому что они воздействуют на очень консервативные механизмы, которые есть у нас, у мышей, даже у пекарских дрожжей. И даже если это не продлит нашу жизнь, это может увеличить продолжительность здоровой жизни, мы будем дольше не страдать от болезней. А это уже неплохо.
Когда эти технологии появятся в клинике?
Здесь проблема регуляторная: старение не считается заболеванием. И даже если вы придумаете лекарство, которое останавливает старение, вы не сможете его продавать здоровым людям. Поэтому у фармкомпаний нет мотивации тестировать такие лекарства.
Но вакцины же мы себе колем? А это профилактика.
Да! Та же логика: казалось бы, болезни еще нет, но мы себя профилактически от нее защищаем. Если эту концепцию удастся реализовать в области старения, это будет замечательным решением. Мы будем вакцинироваться от старения как вакцинируемся от инфекций. Ситуация постепенно меняется в медицинском сообществе и у регуляторов.
Есть свои плюсы: многие лекарства, продлевающие жизнь мышам, уже применяются на человеке против отдельных болезней. Поэтому первую фазу клинических испытаний для них можно будет ускорить: мы уже знаем, что они безопасны. Но есть и минусы: если мы будем тестировать их на продолжительность жизни человека с молодости, то это займет лет 50. Никто столько ждать и финансировать не будет. Поэтому сейчас ученые думают, какие сделать клинические точки, по которым можно измерять эффективность этих терапий. И тут есть разные варианты: можно смотреть на молекулярные маркеры здоровья — те самые часы. Можно оценивать физиологические и биохимические биомаркеры, например, артериальное давление и уровень «плохого» холестерина. И, наконец, можно проводить испытания сразу на пожилых людях и отмечать у них момент возникновения хронических заболеваний. Как рано заболевания будут возникать у людей в зависимости от того, принимают они данный геропротектор или нет? Если мы будем брать 70-летних людей, то срок клинических испытаний можно будет сократить буквально до нескольких лет.
Предсказать это невозможно, но я думаю, что реальный временной промежуток до того, как мы увидим доказательства эффективности геропротекторов на здоровых людях — около 15 лет. Но если мы говорим об их применении на больных людях, то уже сейчас активно идут клинические испытания. По сути, против каждого механизма старения есть какие-то разработки, которые проверяются на людях. Прямо сейчас, когда мы разговариваем, проходят десятки клинических испытаний, в рамках которых потенциальные геропротекторы тестируются против разных возрастных болезней. И, возможно, первые положительные результаты мы увидим уже в течение нескольких лет.


 Меню
Меню





 Все темы
Все темы




 0
0







