Нонсенс-мутации: темные лошадки мутационного мира
«Нонсенс-мутация преждевременно прекращает синтез белка и поэтому вредна» — так прямолинейно и без дополнительных деталей обычно пишут о нонсенс-мутациях в учебниках и статьях. Тем не менее, они не всегда вредны, а иногда даже полезны. Разбираемся, почему такое возможно — как возникают нонсенс-мутации, чем они различаются между собой и каким образом могут оказаться безвредными.

Буйволы-альбиносы, носители нонсенс-мутации в гене тирозиназы, хорошо заметны в стаде и страдают светобоязнью (прикрывают глаза на ярком солнце). Однако не все нонсенсы настолько вредны.
Credit:
BMC Genetics. 2012. DOI: 10.1186/1471-2156-13-62 | CC BY 2.0
Обычно нонсенс-мутациям в учебниках по молекулярной биологии и генетике отводится совсем мало места. О них стандартно говорят, что это почти всегда (а то и всегда) очень вредные мутации: они приводят к появлению преждевременного стоп-кодона и останавливают синтез белка на рибосоме, в результате чего появляется дефектный укороченный белок. Далее обычно приводится несколько примеров вреда нонсенс-мутаций (обычно это клинические случаи), и авторы переходят к другой теме.
А на самом деле нонсенс-мутации не такие уж простые, как кажется на первый взгляд и как показывают в учебниках (а также в научных статьях и даже обзорах). Они могут быть полезными и просто безвредными. За миллионы лет эволюции выработались молекулярные механизмы, позволяющие обходить потенциальный вред от нонсенс-мутаций. Кроме того, само местонахождение нонсенс-мутации может напрямую обуславливать ее влияние на организм.
Что такое нонсенс-мутации?
Нонсенс-мутации — это мутации, которые приводят к появлению в транскрипте стоп-кодона вместо кодона, кодирующего аминокислоту. У каждого транскрипта есть начало (старт-кодон) и конец (стоп-кодон; в ядерном геноме у позвоночных это TAA, TAG, TGA). Трансляция белка на рибосоме начинается со старт-кодона и заканчивается на стоп-кодоне. В случае появления преждевременного стоп-кодона трансляция заканчивается раньше нужного, соответственно, белок получается укороченным.
Нонсенс-мутации называют еще преждевременными стоп-кодонами, а также нуль-аллелями. В англоязычной литературе распространены термины nonsense mutation, premature stop codon, premature termination codon, а также иногда используется термин null allele или null mutation. Они входят в множество мутаций, укорачивающих белок — PTV, protein truncation variants.
Нонсенс-мутации относятся к несинонимичным мутациям?
Здесь стоит для начала пояснить само понятие несинонимичных мутаций. Есть несколько классификаций мутаций, согласно одной из них мутации можно поделить на синонимичные, то есть не меняющие аминокислоту, и несинонимичные, то есть меняющие аминокислоту. (Иногда их же называют немного иначе — несинонимические и синонимические.) Из-за вырожденности генетического кода не все однонуклеотидные мутации приводят к изменению аминокислоты, например, если кодон AAA превратится в AAG, он по-прежнему будет кодировать лизин. Кроме того, делеции, инсерции и более сложные мутационные события не всегда меняют рамку считывания и, соответственно, не приводят к изменению кодируемых аминокислот.
Есть два мнения по поводу того, являются ли нонсенс-мутации несинонимичными. Одни ученые считают, что нонсенс-мутации представляют собой подмножество несинонимичных мутаций, потому что они меняют аминокислоту (на ее отсутствие). Другие считают, что нонсенс-мутации — отдельная группа мутаций, потому как стоп-кодон не кодирует никакую аминокислоту.
Стоп-кодоны — всегда TAA, TAG, TGA?
Так как нонсенс мутации — это появление преждевременного стоп-кодона, то они рассматриваются исходя из генетического кода исследуемого организма. Например, у человека в ядерной ДНК три стоп-кодона — TAA, TAG, TGA. Соответственно, появление этих кодонов в неожиданной позиции в транскрипте будет являться нонсенс-мутацией. А в митохондриальном генетическом коде позвоночных стоп-кодоны — AGA, AGG, TAA, TAG, и именно они, оказавшись в неположенном месте, будут нонсенс-мутациями.
Из-за чего происходят нонсенс-мутации?
Преждевременный стоп-кодон в транскрипте может появиться по нескольким причинам. Приведем самые распространенные.
1. Однонуклеотидная замена. Например, кодон TAC, кодирующий метионин, превращается в TAG.
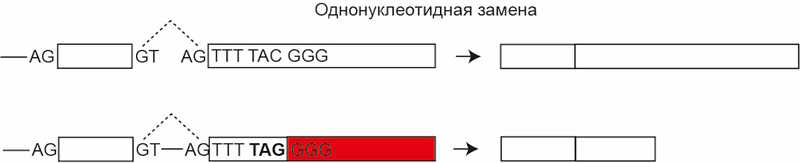
2. Делеция или инсерция, длина которой не кратна трем, а потому смещает рамку считывания. В примере ниже делеция первого нуклеотида Т приведет к появлению стоп-кодона:
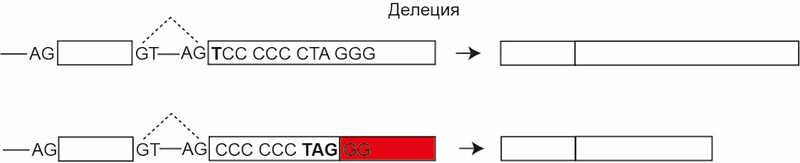
3. Инверсии, в результате которых изменяется последовательность аминокислот в инвертированном фрагменте и могут возникнуть нонсенс-мутации.
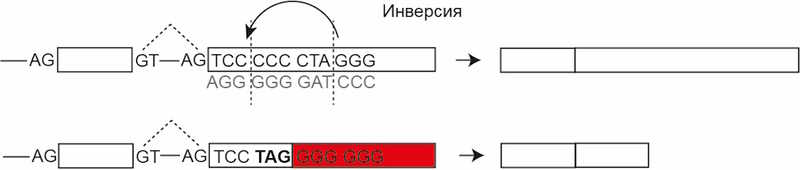
4. Мутации в сайтах сплайсинга, приводящие к включению или исключению экзона или интрона в транскрипте. Вследствие этого может меняться рамка считывания и появляться нонсенс-мутации.
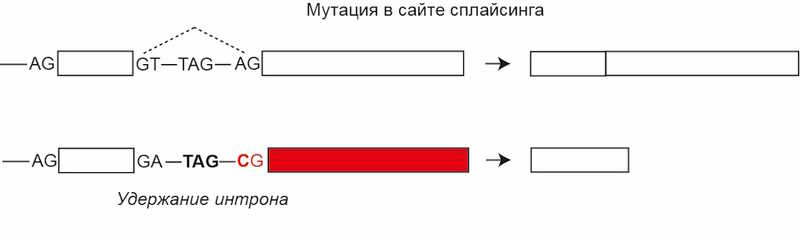
Сколько бывает нонсенс-мутаций в геноме?
Все зависит от того, какой организм изучается: какой у него размер генома, сколько генов, какая эволюционная история вида, его популяционная структура, размер популяции из которой был взят организм, в целом в каких условиях находится организм в лаборатории или в природе и от многого другого.
Нонсенс-мутаций может вообще не быть, а может быть несколько сотен, например, у растения Arabidopsis thaliana в среднем 215 таких мутаций в геноме.
Важно заметить, что число нонсенс-мутаций не равно числу генов с такой мутацией, потому что в гене может находиться сразу несколько нонсенс-мутаций. Как это может быть? В случае, если ген стал псевдогеном, то есть, просто говоря, функционирующего белка с него не синтезируется, он больше не находится под действием отрицательного (по-другому говоря, очищающего отбора) и в нем с большей скоростью начинают накапливаться мутации. Соответственно, поэтому в одном гене может быть несколько нонсенс-мутаций. Про отбор мы еще поговорим в ответе на один из следующих вопросов «Как эволюционирует ген, в котором произошла нонсенс-мутация?».
Кроме того, при подсчете числа нонсенс-мутаций могут возникать и технические ошибки, например, ошибки секвенирования, приводящие к тому, что нонсенс-мутация не будет распознана. Или ошибки фильтрации прочтений, ошибки сборки генома или транскриптома, ошибки работы с данными при анализе и так далее так же могут влиять на финальное число найденных мутаций.
 Курица sc/sc (scaleless) без перьев и кожных чешуек на лапах. Нонсенс-мутация в гене FGF20. Credit: BMC Genomics, 13, 257 (2012). DOI:
10.1186/1471-2164-13-257 | CC BY 2.0
Курица sc/sc (scaleless) без перьев и кожных чешуек на лапах. Нонсенс-мутация в гене FGF20. Credit: BMC Genomics, 13, 257 (2012). DOI:
10.1186/1471-2164-13-257 | CC BY 2.0
Все нонсенс-мутации вредные?
Это утверждение — систематическая ошибка выжившего, то есть вывод, сделанный по наиболее заметной группе мутаций без учета менее заметных. «Выжившие» в данном случае условный термин: заметными тут как раз оказались больные и неблагополучные. Из-за того, что больше всего статей публикуется об очевидном эффекте нонсенс-мутаций — их влиянии на развитие заболевания, — возникает ощущение, что эти мутации всегда вредные. Можно найти множество таких статей, написав в поисковой строке PubMed «nonsense mutation».
Чаще всего выходят статьи с описанием клинических случаев — одного или нескольких пациентов, иногда семей, с некоторым заболеванием, для которого нашли генетическую причину возникновения. Например, нонсенс-мутация в гене PAX9 стала причиной олигодонтии, то есть врожденного отсутствия нескольких зубов, нонсенс-мутация в гене TITF1 — причиной возникновения доброкачественной семейной хореи, нонсенс-мутация в гене GDF2 вызывает системную красную волчанку.
А какие нейтральные и полезные нонсенс-мутации бывают и почему их известно так немного?
Нейтральные нонсенс-мутации редко описывают, потому как их и не ищут, и не находят. Ведь если нет никакого видимого влияния на фенотип организма (например, это в целом здоровый организм), это вряд ли предполагает активный поиск нонсенс-мутаций.
Укорочение или отсутствие белка может быть и полезным — способствовать появлению признака, повышающего приспособленность. Например, у спортсменов, которые хорошо себя показывают в видах спорта, где необходима выносливость, чаще встречается вариант гена ACTN3 с нонсенс-мутациями в обоих аллелях. А у мышей с такими мутациями менялся метаболизм в мышцах. Исходя из этого, можно предположить, что эти мутации адаптивны как минимум для некоторых популяций людей.
Известный многим пример — делеция длиной 32 п.н. (то есть сдвигающая рамку считывания) в гене CCR5, которая приводит к появлению нонсенс-мутации. Этот ген кодирует рецептор, с которым связывается вирус иммунодефицита человека (ВИЧ). Точнее, он связывается с рецептором CD4 на поверхности Т-лимфоцитов, но для проникновения в клетку ему также нужен корецептор, и это как раз CCR5. Из-за делеции рецептор оказывается нефункциональным, и вирус не может проникнуть внутрь клеток. Если делеция находится в гетерозиготном состоянии, то есть в одном из двух аллелей, это снижает шанс быть инфицированным ВИЧ, а если в обоих — снижает еще сильнее. (Однако не до нуля: есть штаммы ВИЧ, которые используют другой корецептор, CXCR4.)
Вариант рецептора с делецией CCR5-Δ32 распространен в человеческой популяции, есть признаки того, что он поддерживается отбором. Высказывались гипотезы, согласно которым он защищает не только от ВИЧ, но и от других инфекций, угрожавших человечеству, например, от оспы. Впрочем, при других инфекциях, таких как вирус Западного Нила, он может быть и вредным.
В конце 2018 года разгорелся большой скандал: ученый из Китая Хэ Цзянькуй отредактировал ген CCR5 у эмбрионов человека. Он заявлял, что планировал создать людей, невосприимчивых к ВИЧ. Для этого ген CCR5 был сделан нефункциональным (Хэ Цзянькуй с соавторами утверждали, что хотели воспроизвести существующий вариант CCR5-Δ32, но получилось не совсем так.) Ученый был приговорен к трехлетнему тюремному сроку. В 2022 году он вышел на свободу и заявил, что собирается заняться генетической терапией редких заболеваний, в первую очередь миодистрофии Дюшенна. В феврале 2023 года он сообщил в интервью, что генноотредактированные дети «живут нормальной жизнью».
Эксперимент доктора Хэ никто в научном сообществе не одобряет, но формально он исходил именно из соображения, что нарушение функции гена может принести пользу.
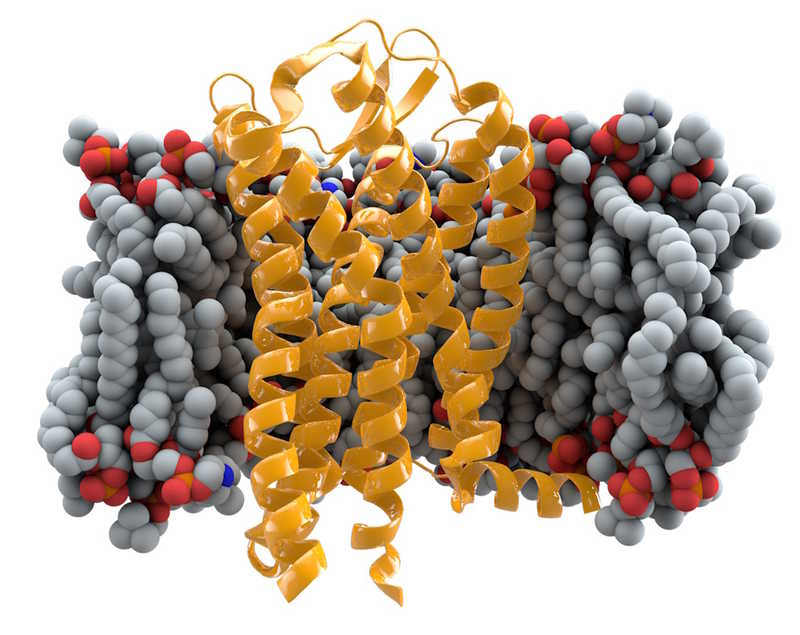 Рецептор CCR5 в клеточной мембране. Credit: Thomas Splettstoesser | CC BY-SA 3.0 |
wikimedia.org
Рецептор CCR5 в клеточной мембране. Credit: Thomas Splettstoesser | CC BY-SA 3.0 |
wikimedia.org
 Доктор Хэ Цзянькуй. Credit: The He Lab | CC BY 3.0 |
wikimedia.org
Доктор Хэ Цзянькуй. Credit: The He Lab | CC BY 3.0 |
wikimedia.org
Как эволюционирует ген, в котором произошла нонсенс-мутация?
Раньше преобладала точка зрения, согласно которой нонсенс-мутации псевдогенизируют ген, то есть он превращается в псевдоген и начинается эволюционировать нейтрально.
Что означает «нейтрально»? Обычно ген находится под действием или положительного, или отрицательного отбора. В нем накапливаются по мере эволюции синонимичные (не меняющие аминокислоту) и несинонимичные (меняющие аминокислоту) мутации. Но если на ген действует отрицательный отбор (то есть если гену «выгоднее» оставаться неизменным, чем меняться), число синонимичных мутаций выше, чем число несинонимичных. Таким образом, изменение аминокислот в последовательности происходит медленно. А если отбор положительный (то есть гену «выгоднее» меняться), то число несинонимичных мутаций выше числа синонимичных. Такой отбор нередко наблюдается у генов, вовлеченных в иммунный ответ, чтобы быстрее приспосабливаться к эволюции патогенов и не отставать в защите организма от них.
Но в случае псевдогенов у нас ни положительного отбора, ни отрицательного не остается. А остается нейтральная эволюция, когда число синонимичных и несинонимичных мутаций примерно одинаково. Именно такой должна быть картина, если нонсенс-мутация превращает ген в псевдоген.
Силу отрицательного отбора, действующего на нонсенс-мутации, можно измерить различными способами. Работу, посвященную как раз такому анализу, мы опубликовали в 2018 году (популярный пересказ можно прочитать здесь). Мы исследовали геномы замбийских дрозофил, и оказалось, что нонсенс-мутации действительно псевдогенизируют гены, но, судя по всему, сказать об этом можно точно только для тех, которые состоят из одного экзона. Если же в гене несколько экзонов, то псевдогенизируется только экзон с нонсенс-мутацией, а остальные остаются «рабочими», и на них действует отрицательный отбор (хоть и не такой сильный, как на гены без нонсенс-мутаций). Это обеспечивают разные механизмы, в том числе альтернативный сплайсинг или рекомбинация с фрагментами этих же генов, но без нонсенс-мутации.
От чего зависит, будет ли нонсенс-мутация вредной, полезной или никак не повлияет на организм?
От многих факторов. Подробно о них можно прочитать в моем обзоре Nonsense Mutations in Eukaryotes (pdf). Разумеется, не все факторы пока что обнаружены. К тому же в каждом отдельном случае, то есть для каждой отдельной нонсенс-мутации, вредность, полезность или безвредность определяется комбинацией причин. Но основные причины все же можно перечислить.
1. Место расположения нонсенс-мутации в транскрипте
Высокий пик числа нонсенс-мутаций в самом начале транскрипта (примерно в районе первых трех кодонов) и в самом конце транскрипта (предпоследний, перед настоящим стоп-кодоном) (раз,два). Находясь в самом конце транскрипта и затрагивая лишь одну аминокислоту, такая мутация вряд ли будет влиять на белок. А если нонсенс-мутация находится в начале транскрипта, то как стартовый может использоваться следующий за ним кодон AUG, кодирующий метионин. Разумеется, здесь есть нюансы, которые касаются того, как именно происходит последующий фолдинг белка, сворачивается ли аминокислотная последовательность в белок целиком или дополнительно режется (в таком случае концевой фрагмент транскрипта может оказаться и где-то в активном центре белка).
2. Частота использования экзона
Если экзон редко включается в изоформу, то можно предположить, что он не особо важен и поэтому нонсенс-мутация в нем не так вредна. Но есть важный момент — этот экзон может быть критически важен, например, в эмбриональном развитии, или в еще какой-то ситуации; как говорится, редко, но метко. Поэтому считать, что все редко используемые экзоны не нужны — ошибка.
3. Гаплодостаточность и гаплонедостаточность гена
Имеет значение и то, насколько организм может функционировать при наличии всего одной «рабочей» версии гена, то есть без нонсенс-мутации. Иногда хватает одной копии, и нонсенс-мутация оказывается нейтральной по своему влиянию на фенотип. А бывает, и не хватает, и тогда мутация становится вредной.
4. Экспрессия гена и изоформы с экзоном с нонсенс-мутацией
Здесь логика примерно та же, что в п.2. Эффект мутации зависит от уровня экспрессии, времени экспрессии гена и изоформы.
5. Генетическая компенсация (genetic compensation response)
Если у организма есть гены, принадлежащие к тому же семейству, что и ген с нонсенс-мутацией, то они могут выполнить его роль и заменить. В таком случае вред снижается или вообще нивелируется.
6. Нонсенс-опосредованный распад мРНК (nonsense-mediated mRNA decay) (и другие варианты нонсенс-опосредованных механизмов)
Это процесс, который позволяет деградировать транскрипты, содержащие в себе нонсенс-мутацию. Соответственно, такие транскрипты не транслируются и потенциально вредный укороченный белок не появляется. Насчет эффективности работы этого процесса есть разная информация для разных организмов и даже для одного организма. Например, для человека показано и 10%, и 25%, и до 50%. С одним из последних подсчетов можно ознакомиться в статье 2020 года (рис. 1F).
7. Чтение сквозь стоп-кодон (stop codon readthrough)
В этом случае преждевременный стоп-кодон распознается не как окончание трансляции, а как кодирующий кодон, и трансляция продолжается дальше. Этот процесс широко известен для вирусов и бактерий, но также присутствует у эукариот. Чтение сквозь стоп-кодон зависит от множества деталей, например, от того, какие нуклеотиды в стоп-кодоне и какой контекст.
Например, этот процесс известен для нематоды C. elegans, и для различных видов мушек рода Drosophila, и для человека. Интересный случай описан для Drosophila sechellia: у нее в локусе Ir75a, который кодирует один из обонятельных рецепторов, находится нонсенс-мутация. И тем не менее локус продолжает экспрессироваться, как раз благодаря чтению сквозь стоп-кодон. Для описания этой ситуации авторы использовали термин «псевдопсевдоген».
Нельзя не сказать про один специфический вариант чтения сквозь стоп-кодон, когда стоп-кодон считается не терминирующим, а кодирующим аминокислоту селеноцистеин. Так, особая селеноцистеиновая тРНК может считывать кодон UGA как селеноцистеин, если на 3'UTR находится так называемый SECIS элемент. Это явление наблюдали у разных видов Drosophila, птиц, рыб, млекопитающих. Таким образом происходит расширение генетического кода: в белки добавляется 21-я аминокислота. (О роли селенсодержащих белков в живых организмах можно прочитать в интервью с Вадимом Гладышевым.)
А как в медицинской практике нужно проверять нонсенс-мутации?
Разумеется, в первую очередь нонсенс-мутации проверяются по специальным медицинским базам данных — ClinVar, OMIM, The Human Gene Mutation Database (HGMD®) и другим. Иногда ответ кроется на поверхности, то есть в этих базах удается найти, при каком заболевании наблюдали такую мутацию. Но результаты поиска не следует применять бездумно. Нужно учитывать и выборку, на которой показан результат в базе данных, и другие характеристики описываемых случаев. Таким образом, если уже найдена нонсенс-мутация в гене или генах, а затем подтверждена в базе данных (при хорошем стечении обстоятельств), это не означает, что поиск закончен. Нужно найти еще дополнительные подтверждения того, что она действительно влияет на организм (с учетом всех описанных выше способов, с помощью которых может быть снижен возможный вред от нонсенс-мутаций) и что причина именно в ней, а не где-то в другом гене или генах. А если информации о такой мутации нет, то неопределенности еще больше, и появляется вопрос: «А вредна ли эта мутация и влияет ли она на возникновение этого заболевания?»


 Меню
Меню





 Все темы
Все темы




 0
0








