Экспрессию терапевтических трансгенов можно индуцировать при помощи запаха
Контроль экспрессии трансгена — важная проблема генетической терапии, поскольку постоянные высокие уровни целевого белка могут вызывать токсические эффекты. Авторы статьи в Nature Communications предложили необычную систему контроля. Она основана на индукции трансгенов при помощи мускона — одного из компонентов мускуса. Ученые показали на мышах, что вдыхание этого соединения запускает экспрессию целевого гена, а также применили систему для лечения неалкогольной жировой болезни печени и аллергической астмы.
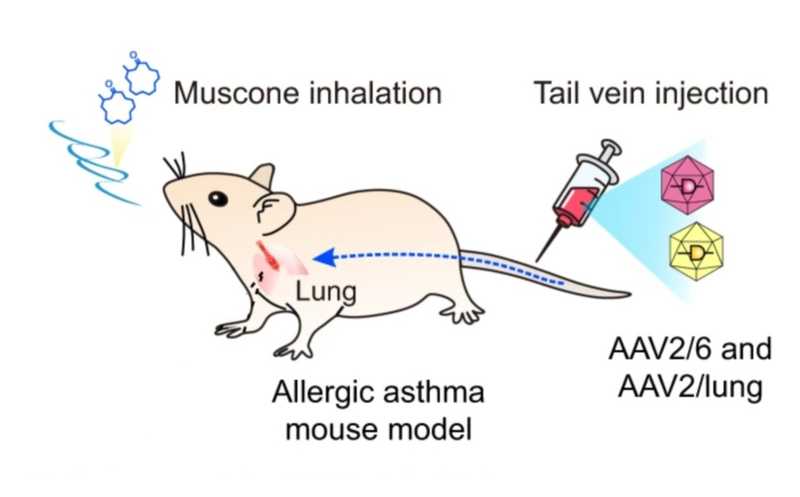
Целевой трансген доставляется в ткани с помощью аденовирусного вектора, а его экспрессия индуцируется вдыхаемым мусконом.
Credit:
Nature Communications (2024). DOI:
10.1038/s41467-024-45383-z |
CC BY
Хронические заболевания представляют собой серьезную проблему для здравоохранения. Один из подходов к их лечению — это генная терапия, однако для нее необходимы системы долгосрочного контроля экспрессии терапевтических трансгенов. Ученые из Китая и США предложили систему индукции трансгенов при помощи мускона, который, связываясь с обонятельным рецептором, активирует сигнальный путь цАМФ. Это запускает экспрессию трансгена, который находится под синтетическим цАМФ-зависимым промотором.
Рекомбинантные векторы на основе аденоассоциированных вирусов (AAV) обладают низкой иммуногенностью и непатогенны, благодаря чему они становятся все более популярной платформой для доставки терапевтических генов. Более того, генная терапия на основе AAV может обеспечить долгосрочную экспрессию терапевтического белка. Однако у этого есть и обратная сторона — конститутивная экспрессия может приводить к токсичности из-за уровней терапевтического агента, превышающих физиологические. Чтобы решить эту проблему, авторы статьи в Nature Communications разработали мускон-индуцируемую трансгенную систему (MUSE), которая доставляется при помощи AAV и обеспечивает контролируемую экспрессию терапевтических генов при вдыхании мускона — ароматического вещества, одного из основных компонентов мускуса.
В предложенной авторами системе экспрессируются чувствительный к мускону белок мышиного обонятельного рецептора (MOR215-1) и укороченный вариант рецептор-транспортирующего белка 1 (RTP1S), который перемещает MOR215-1 к клеточной мембране. MOR215-1 — рецептор, сопряженный с G-белком, и при связывании мускона он вызывает в клетке продукцию цАМФ. Тот, в свою очередь, связывается с регуляторными субъединицами протеинкиназы А, каталитические субъединицы которой фосфорилируют транскрипционный фактор CREB1. Он связывается с синтетическим промотором PCRE и тем самым запускает экспрессию трансгена.
Сперва ученые испытали MUSE на клеточной модели. Они экспрессировали ее компоненты в клетках HEK293, а в качестве репортерного белка использовали щелочную фосфатазу, которую детектировали в культуральной жидкости. При оптимальном соотношении вектора и целевых генов авторы добились 63-кратной индукции щелочной фосфатазы в присутствии мускона. При этом на конститутивную экспрессию щелочной фосфатазы мускон не влиял. Эти результаты подтвердились и на других клеточных линиях (HeLa, hMSC-TERT, Hana 3 A), что говорит о широкой применимости системы.
Подтвердив работоспособность MUSE in vitro, исследователи протестировали систему на мышах. В хвостовую вену им вводили аденовирусный вектор, кодирующий нужные компоненты, а спустя две недели подвергали мышей ингаляции мусконом. Репортерным белком в этом эксперименте служила люцифераза. Ученые детектировали ее люминесценцию и обнаружили высокий уровень сигнала в печени животных. При этом двух часов воздействия распыленного мускона было достаточно для запуска экспрессии, а максимальная интенсивность сигнала наблюдалась через четыре часа после его воздействия. Результаты воспроизводились и при систематической обработке мышей мусконом — ученые распыляли его каждые две недели, и такая повторяющаяся обработка каждый раз индуцировала экспрессию люциферазы в печени животных вплоть до 28 недель.
Авторы работы также показали, что систему можно применять в терапевтических целях. Они смоделировали неалкогольную жировую болезнь печени на мышах и вводили им синтетический рекомбинантый вариант Fc-FGF21 (ΔhFGF21) при помощи MUSE. Этот белок был исследован в фазе 2 клинических испытаний, направленных на снижение содержания жира в печени. Затем ученые обрабатывали мышей, получивших MUSE с ΔhFGF21, распыленным мусконом или контрольным раствором, который мускона не содержал. Вдыхание мускона значительно повышало содержание ΔhFGF21 в организме животных по сравнению с контролем; его концентрации составили 20–30 нг/мл и таким образом оказались в терапевтическом окне. У модельных животных, получавших такое лечение, снижался уровень жира в организме — это детектировали при помощи МРТ — и общая масса тела. Также у них увеличивался уровень потребления кислорода, а уровень ферментов печени (аспартатаминотрансфераза, аланинаминотрансфераза) и холестерина понижался по сравнению с модельными животными, которые лечения не получали. Таким образом, регулярная индукция терапевтического трансгена в системе MUSE оказалась эффективной для лечения неалкогольной жировой болезни печени у мышей.
Наконец, исследователи продемонстрировали, что экспрессировать компоненты системы MUSE можно тканеспецифично. В качестве мишени они выбрали легкие, в качестве репортера — люциферазу. Чтобы добиться экспрессии в целевой ткани, авторы модифицировали систему и разделили ее на два вектора — это было необходимо, поскольку исходный вариант высоких уровней экспрессии не давал. Оба вектора вводили мышам в хвостовую вену, а через две недели подвергали животных воздействию распыленного мускона. Четыре часа такой обработки индуцировали 17-кратное возрастание сигнала люциферазы по сравнению с контролем. Индукцию повторяли каждые шесть недель и показали, что MUSE обеспечивает долгосрочную (в течение 20 недель) экспрессию люциферазы в легких. Также система применима для терапии — это ученые подтвердили на мышиной модели аллергической астмы.
Генотерапевтический агент для лечения аллергической астмы — это мутантная форма IL-4 (ΔmIL-4). В легкие мышей доставляли ΔmIL-4 при помощи MUSE, а спустя 14 дней после этого индуцировали у них развитие аллергической астмы. Модель этого заболевания получили с помощью сенситизации к овальбумину. Обработка распыленным мусконом проводилась за сутки до начала сенситизации (день 13), сутки спустя (день 15), а также на 17-й и 19-й дни эксперимента. Она индуцировала увеличение уровня ΔmIL-4; кроме того, количество эозинофилов и Т-клеток в легких и бронхоальвеолярной жидкости мышей снижалось по сравнению с контролем. Также в бронхоальвеолярной жидкости животных, обработанных мусконом, уменьшался уровень провоспалительных цитокинов IL-4, IL-5 и IL-13. Таким образом, с помощью MUSE можно контролировать экспрессию ΔmIL-4 и подавлять развитие чувствительности к аллергену.
Предложенная система, отмечают исследователи, основана на «безыгольной ароматерапии, а это — удобная альтернатива инъекциям при хронических заболеваниях, таких как диабет, ожирение и хронические болезни почек». Кроме того, MUSE можно доставлять в целевые ткани и обеспечивать в них долгосрочную и контролируемую экспрессию после однократной инъекции аденовирусных векторов. Авторы работы рассчитывают, что разработанный ими подход станет ценным дополнением к генной терапии и улучшит ее эффективность и безопасность.
Лигандзависимый РНК-переключатель обеспечивает контроль экспрессии генов в клетках млекопитающих
Источник
Wu, X., et al. AAV-delivered muscone-induced transgene system for treating chronic diseases in mice via inhalation. // Nat Commun 15, 1122 (2024). DOI: 10.1038/s41467-024-45383-z


 Меню
Меню





 Все темы
Все темы





 0
0