Предложен метод получения циклических пептидов — кандидатных препаратов для перорального приема
Циклические пептиды эффективно связывают сложные терапевтические мишени, однако многие из них быстро перевариваются и (или) плохо всасываются в ЖКТ. Исследователи из Лозанны разработали новый подход к синтезу и скринингу циклических пептидов и в итоге получили ингибиторы тромбина с наномолярным сродством, высокой стабильностью и пероральной биодоступностью.
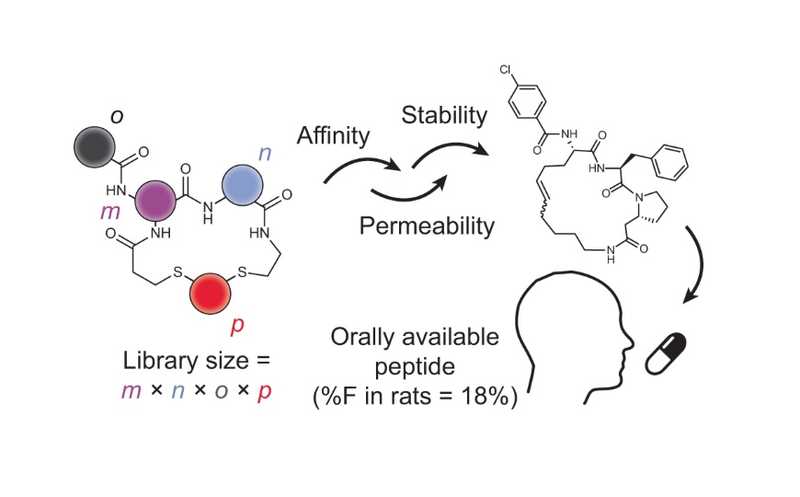
Nat Chem Biol (2023). DOI: 10.1038/s41589-023-01496-y | CC BY 4.0 DEED
Для лечения многих заболеваний сложно создать лекарства, которые можно было бы принимать перорально, в виде таблеток. Небольшие молекулы, подходящие для перорального применения, зачастую не могут избирательно связываться с белками-мишенями, а моноклональные антитела, способные к высокоспецифичному связыванию с антигеном, слишком велики и нестабильны. Решением этой проблемы могут стать небольшие циклические пептиды, способные проходить через клеточную мембрану. Уже существуют препараты на основе таких пептидов, например, циклоспорин А (иммунодепрессант), десмопрессин (антидиуретик), аналог соматостатина, подавляющий повышенную секрецию гормона роста. Однако поиск циклических пептидов, достаточно стабильных, чтобы противостоять протеазам, и достаточно маленьких и неполярных, чтобы пересекать эпителиальный барьер ЖКТ, остается сложной задачей. Исследователи из Федеральной политехнической школы Лозанны недавно разработали стратегию синтеза и функционального скрининга тысяч небольших циклических пептидов. В новой работе они применили ее для поиска кандидатов в препараты для перорального приема.
Эта группа исследователей на протяжении многих лет разрабатывала бициклические пептидные лиганды с использованием фагового дисплея. Но эти пептиды были довольно крупными (1–2 кДа) и не могли проходить сквозь мембраны, что ограничивало их применение внеклеточными мишенями; вводить их можно было только инъекционно, и они быстро выводились из организма. Поэтому авторы перешли от фагового дисплея к химическому синтезу. Такой подход дал им доступ к более чем 500 коммерчески доступным аминокислотным строительным блокам для создания библиотек. Сначала они получали пептиды, образующие циклы за счет дисульфидных мостиков, но эти молекулы были метаболически лабильными и не подходили для перорального применения. Тогда авторы модифицировали метод для получения более стабильных циклов с тиоэфирными мостиками. В этой новой стратегии комбинаторного синтеза m пептидов случайного строения циклизуются с n линкерами, причем образуются тиоэфирные связи, а затем циклический пептид ацилируется по амину с помощью o карбоновых кислот. Таким образом можно получить m × n × o циклических пептидов. Они оказались более стабильными, , чем молекулы с дисульфидными связями.
Исследователи синтезировали библиотеку из 8448 циклических пептидов со средней молекулярной массой около 650 Да, что немного выше предела в 500 Да, рекомендованного для перорально доступных малых молекул в соответствии с правилом Липински.
«Эта статья выделяется тем, что в процессе скрининга и отбора [пептидов] учитывались не только активность, но и стабильность и проницаемость», — отметил Рассел Джонсон, главный редактор журнала Nature Chemical Biology. Скрининг библиотеки идентифицировал ингибиторы тромбина — сериновой протеазы, играющей важную роль в свертывании крови. Эти пептиды показали хорошую протеолитическую стабильность, но низкую проницаемость мембран и метаболическую стабильность. Тогда авторы провели несколько итерационных циклов синтеза и тестирования библиотеки на основе кандидатов из первого раунда и получили пептиды с наномолярным сродством и высокой стабильностью. Биодоступность при пероральном приеме у крыс достигала 18%.
Таким образом, пептиды для перорального применения можно получать из случайных библиотек. Швейцарские исследователи предполагают, что метод можно применить и к более сложным мишеням, таким как вмешательство в межбелковые взаимодействия, но для этого понадобятся более крупные библиотеки и автоматизация большинства шагов.
Пептоиды — миметики антимикробных пептидов — разрушают оболочку вирусов
Источник
Merz, M.L., et al. De novo development of small cyclic peptides that are orally bioavailable. Nature Chemical Biology (2023). DOI: 10.1038/s41589-023-01496-y


 Меню
Меню





 Все темы
Все темы





 0
0