Развитие бокового амиотрофического склероза у мышей затормозили с помощью нового препарата
Исследователи из Германии изучили нейропротекторные свойства FP802 — ингибитора взаимодействия между внесинаптическим рецептором NMDA и рецептором TRPM4. Это взаимодействие приводит к гибели мотонейронов при боковом амиотрофическом склерозе (БАС). Кандидатный препарат был успешно протестирован на мышиной модели БАС и органоидах мозга, полученных из клеток пациентов с этим заболеванием.
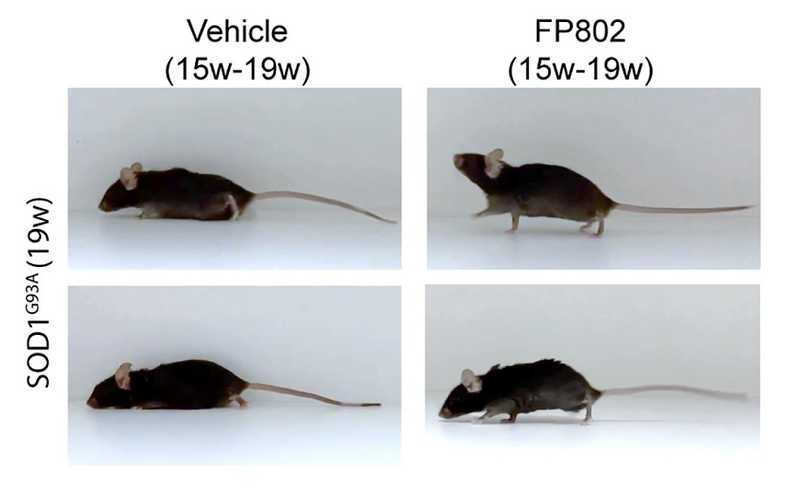
Мыши, моделирующие БАС, после четырех недель лечения (справа) передвигаются намного лучше, чем контрольные
Credit:
Cell Rep Med. 2024. DOI: 10.1016/j.xcrm.2024.101413 | CC BY 4.0 DEED
Боковой амиотрофический склероз (БАС) – хроническое быстро прогрессирующее дегенеративное заболевание ЦНС, поражающее как верхние двигательные нейроны в коре головного мозга, так и нижние двигательные нейроны в стволе головного мозга и спинном мозге. Пациенты страдают параличом мышц, отвечающих за движение и речь, а также за прием пищи и дыхание. На сегодня не существует эффективного медикаментозного лечения. В большинстве случаев смерть наступает в течение двух-пяти лет после постановки диагноза.
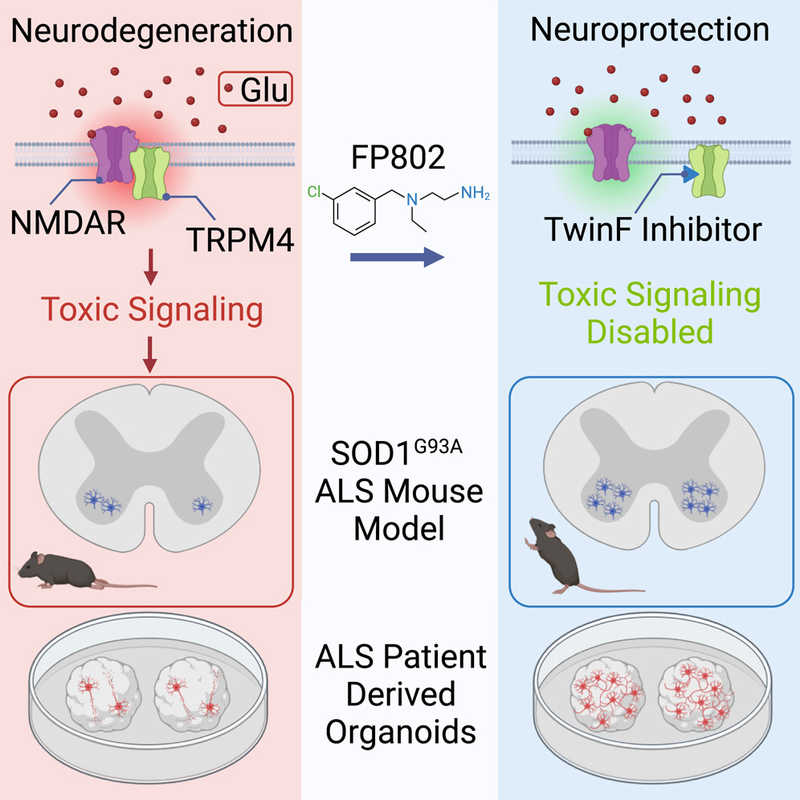
NMDA-рецепторы (NMDAR) присутствуют на поверхности нервных клеток как в синапсах, так и вне их, и активируются нейротрансмиттером глутаматом. Стимуляция синаптических NMDA рецепторов в мозге способствует обучению и запоминанию, а также защите нервных клеток. Однако активация внесинаптических NMDAR приводит к повреждению и гибели нейронов. Классические блокаторы NMDAR не различают рецепторы, расположенные вне и внутри синапса, поэтому непригодны для терапии. Нейробиологи из Гейдельбергского университета (Германия) предложили альтернативный подход, способный остановить прогрессирования БАС.
Ранее группа нейробиолога Хилмара Бадинга из Гейдельберга выяснила, что токсические свойства внесинаптическим NMDA-рецепторам в мозге придает TRPM4, рецептор N-метил-D-аспартата. Взаимодействие между рецепторами NMDA и TRPM4 — важный фактор прогрессирования БАС, а блокировка этого взаимодействия могла бы препятствовать развитию болезни, не вмешиваясь в нормальную работу NMDA-рецепторов.
Нейропротекторная молекула FP802, используемая в исследовании, относится к новому фармакологическому классу препаратов, открытому под руководством профессора Бадинга, — ингибиторам интерфейса TwinF. Они нарушают взаимодействие NMDAR и TRPM4, которые образуют комплекс благодаря белковому карману TRPM4, названному исследователями TwinF4. FP802 связывается с карманом TwinF, блокирует зону контакта и тем самым разрушает патогенный комплекс NMDAR/TRPM4.
Для проверки эффективности FP802 ученые вводили FP802 подкожно мышам линии SOD1G93A (мышиная модель БАС). Чтобы препарат высвобождался стабильно, животным имплантировали осмотические мини-насосы. Инъекции начинали с момента возникновения двигательного дефицита, то есть примерно на 15-й неделе жизни.
У мышей, получавших FP802 в течение последующих четырех недель, улучшились неврологические и двигательные показатели, они меньше худели, чем контрольные животные, и дольше прожили (медиана выживаемости увеличилась со 151 до 164 дней). Также у них было больше живых мотонейронов.
Исследование фармакологической безопасности FP802 с помощью радиолигандных анализов связывания не обнаружило значительного взаимодействия ни с одной с 30 протестированных мишеней. У получавших FP802 животных не было выявлено существенных отличий показателей сыворотки крови, которые говорили бы о возможных повреждениях печени, почек и сердца.
Наконец, ученые получили индуцированные плюрипотентные стволовые клетки (иПСК) от пациентов со спорадической или наследственной форм БАС и вырастили из них органоиды переднего мозга человека. Органоиды из клеток больных были чувствительнее к токсичности NMDA-рецепторов, чем органоиды из здоровых иПСК. FP802 блокировал дозозависимым образом NMDA-индуцированную гибель нейронов в органоидах, полученных от пациентов с БАС.
По мнению ученых, открытие этого нового фармакологического класса лекарств открывает многообещающий путь для борьбы с БАС. Междисциплинарный центр нейронаук Гейдельбергского университета (IZN) в сотрудничестве со стартапом FundaMental Pharma планирует оптимизировать препарат на основе FP802 для применения на людях, а затем провести клинические испытания.
Трансплантация предшественников нейронов в спинной мозг при БАС оказалась безопасной
Источник
Jing Y., et al. TwinF interface inhibitor FP802 stops loss of motor neurons and mitigates disease progression in a mouse model of ALS. // Cell Reports Medicine. Published:February 06, 2024. DOI: 10.1016/j.xcrm.2024.101413








 Меню
Меню





 Все темы
Все темы
 Credit: Cell Rep Med. 2024. DOI:
Credit: Cell Rep Med. 2024. DOI:





 0
0