Гигантские вирусы приходят в клетку амебы со своими факторами инициации трансляции
Исследователи из США и Франции установили, что гигантский вирус амеб не пассивно использует аппарат синтеза белков хозяина, а «взламывает» его, чтобы переключить с хозяйских белков на свои. Геном вируса кодирует три белка комплекса инициации трансляции, аналогичного эукариотическому eIF4F. Вирусный комплекс избирательно связывает вирусные матричные РНК, направляя их в рибосомы, и клетка-хозяин производит вирусные белки. Это поднимает новые вопросы об эволюции трансляции и о границе между клеточной и бесклеточной биологией.
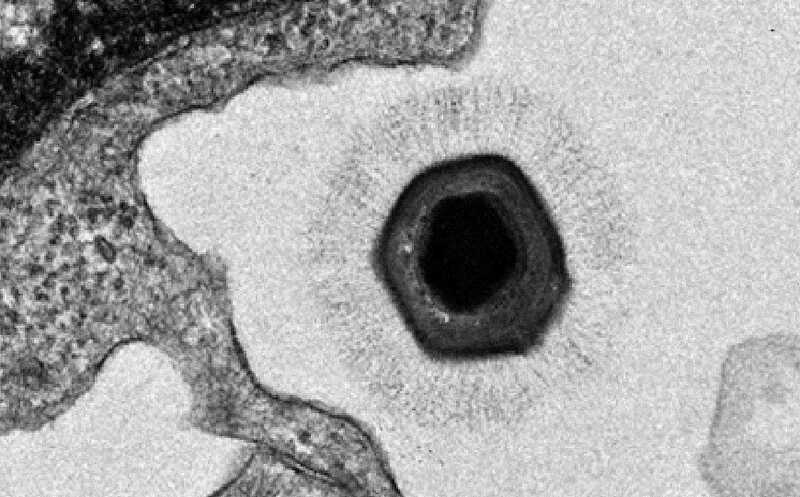
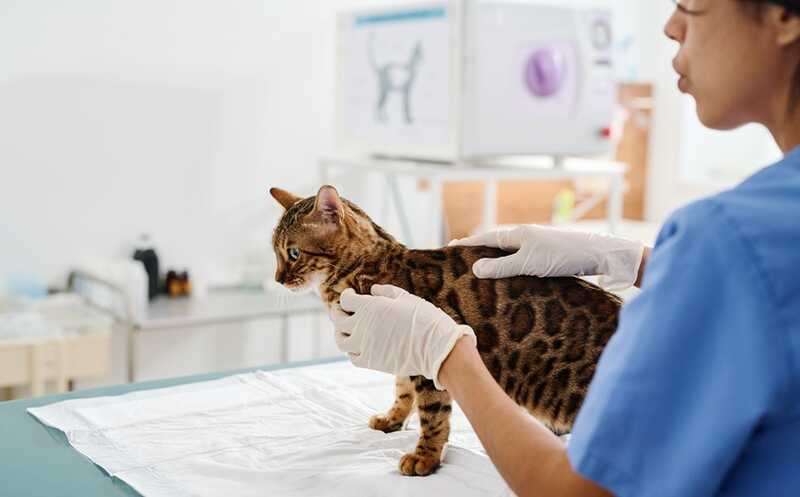
Мимивирус APMV проникает в макрофаг
Credit:
PLoS Pathog 4(6): e1000087. DOI: 10.1371/journal.ppat.1000087 | OA CC
Авторы статьи в Cell изучили, что происходит внутри амеб, зараженных мимивирусом. Оказалось, что он и другие гигантские вирусы не только используют механизмы клетки-хозяина, чтобы синтиезировать собственные белки, но и кодируют в своем геноме необходимые для этого элементы.
Долгое время считалось, что вирусы не обладают собственными механизмами трансляции (синтеза белка на мРНК) и продукция их собственных белков полностью зависит от трансляционного ваппарата хозяина. Этот принцип был поставлен под сомнение открытием крупных ДНК-вирусов класса Megaviricetes, также называемых гигантскими вирусами.
Вирус, поражающий клетки амеб, исследователи из Средиземноморского университета, который сейчас стал частью Университета Экс-Марсель, описали в 2003 году. Препарат, где он был выявлен, сделали в 1992 году в Брэдфорде (Великобритания), но из-за крупных размеров (диаметр капсида около 500 нм), белковых нитей, похожих на жгутики, и окрашивания по Граму его приняли за бактерию. Название «мимивирус» происходит от mimicking microbe virus.
С тех пор были открыты и другие гигантские вирусы. Они инфицируют простейших и многоклеточные организмы и отличаются от других вирусов не только крупными размерами, но и большими геномами, кодирующими до тысячи белков. В общей сложности у гигантских ДНК-вирусов обнаружены сотни генов, гомологичных генам тРНК, аминоацил-тРНК-синтетаз (ааРС) и даже, возможно, эукариотических факторов трансляции.
Исследователи из Гарвардского университета, Института Даны – Фарбера (США) и Университета Экс-Марсель показали, что мимивирус Acanthamoeba polyphaga (APMV) — тот самый, который был открыт первым и сначала принят за бактерию, — кодирует комплекс инициации трансляции IF4F, отличный от эукариотического. Этот комплекс управляет синтезом белка в зараженной клетке, заставляя хозяина производить больше вирусных белков и «тем самым размывая границу между клеточной и бесклеточной биологией», пишут авторы статьи.
Ключевые адаптации синтеза белка у эукариот —мРНК с кэпом, то есть 7-метилгуанозином (m7G) в 5’-положении и комплекс связывания кэпа — eIF4F. Этот комплекс представляет собой гетеротример, то есть содержит три компонента — белок связывания кэпа eIF4E, каркасный белок eIF4G и eIF4A, необходимый для связывания мРНК с рибосомой и расплетания двухцепочечных участков.
Исследователи сравнили состав полирибосом из инфицированных и неинфицированных клеток амебы и идентифицировали связанные с ними вирусные белки, гомологичные eIF4A (R458) и eIF4E (L496), а также структурный гомолог среднего домена eIF4G (R255).
Вирусные гомологи эукариотических белков авторы называют, соответственно, vIF4A, vIF4E и vIF4G. Далее они задались вопросом, могут ли эти белки образовывать комплекс, аналогичный eIF4F. Рекомбинантная экспрессия белков APMV давала препараты, непригодные для биохимической характеристики. Поэтому авторы идентифицировали vIF4A, vIF4E и vIF4G в другом гигантском вирусе амеб — котонвирусе Cotonvirus japonicus (CJ), и использовали эти белки, которые активно экспрессировались, в биохимических анализах.
Бактериальные белки образовывали гетеротример vIF4F, который взаимодействует с рибосомой хозяина во время инфекции. Нокаут каждого из трех белков APMV снижал продукцию вирусных частиц — титр вируса уменьшался на 3–5 порядков по сравнению с диким типом. Таким образом, эндогенные белки eIF4F хозяина не могут поддерживать вирусную репликацию в штаммах с нокаутом vIF4F, то есть этот комплекс необходим для вирусной репликации.
Чтобы изучить влияние вирусного комплекса на трансляцию, авторы провели рибосомное профилирование и РНК-секвенирование амеб, инфицированных вирусом дикого типа или вирусом с делецией одного из трех белков. Делеции не влияли на уровень вирусной мРНК, но существенно подавляли ее трансляцию на поздних стадиях инфекции. Отсюда можно было сделать вывод, что вирусный комплекс инициации «переключает» трансляцию в клетке на продукцию вирусных белков. Ожидаемо это влияло на сборку вирусных частиц: хотя «фабрики вирусов» образовывались во всех клетках, в отсутствие компонентов vIF4F их производительность была близка к нулю.
Структурный анализ вирусного IF4F показал, что субъединица vIF4E, связывающая кэп, избирательно взаимодействует с кэпами вирусных мРНК. Благодаря этому и происходит переключение от трансляции белков хозяина к трансляции вирусных белков. Вирусные и хозяйские m7G-кэпы структурно идентичны, однако 5′-нетранслируемые области (UTR) вирусных мРНК имеют высококонсервативные особенности, не свойственные мРНК хозяина. Важную роль в избирательном распознавании вирусных матриц для синтеза белка может играть метилирование аденозина в определенной позиции, осуществляемое вирусными кэп-метилтрансферазами.
В отдельной серии экспериментов авторы показали, что вирусные белки могут инициировать трансляцию даже в условиях дефицита питательных веществ и окислительного стресса, которые обычно снижают общий уровень продукции белка в клетках хозяина. Для вирусов одноклеточных организмов такая возможность имеет особое значение, поскольку клетка-хозяин обитает в более изменчивой среде, чем клетка млекопитающего. Возможность «перехватить управление» трансляцией при дефиците ресурсов и сохранить способность к репликации дает эволюционное преимущество. Тем не менее холодовой шок подавлял репликацию вируса.
Авторы предполагают, что аналогичные адаптации могли способствовать эволюции сложной, высокоспециализированной трансляции, наблюдаемой у эукариот. Возможно, вирусы могли повлиять на это и более прямо. «Хотя вирусы являются патогенами, они также стимулируют молекулярную эволюцию во всех доменах жизни, — говорится в заключительной части статьи. — Мы предполагаем, что способность вирусной инфекции обеспечивать пластичность синтеза белка в ответ на внешние и внутренние стрессы может оказаться фактором, формирующим эволюцию клеточной пластичности».
Горизонтальный перенос транспозонов вирусами оказался важным источником новых интронов
Источник
J. Maximilian Fels, et al. Giant DNA viruses encode a hallmark translation initiation complex of eukaryotic life // Cell. Published online February 17, 2026. DOI: 10.1016/j.cell.2026.01.008


 Меню
Меню





 Все темы
Все темы




 0
0