Ответ на новые штаммы SARS-CoV-2: влияние на существующие методы диагностики и клиническую эффективность дифференцирующих тестов
Расшифровка вебинара, проведенного порталом 360Dx при поддержке компании Agena Bioscience. В ходе вебинара доктор Мартин Штюрмер, Томас Алеф и доктор Дэррил Ирвин рассказали о разработке, характеристиках и преимуществах масс-спектрометрического теста, распознающего различные штаммы SARS-CoV-2.

Новые штаммы SARS-CoV-2 несут мутации, которые могут повлиять на работу сущестующих диагностических тестов. Кроме того, эти мутации потенциально приводят к изменениям функций вирусных белков, а значит, его инфекционности, что сказывается на распространении штаммов и протекании COVID-19. Компания Agena Bioscience разработала масс-спектрометрический мультиплексный тест, нацеленный на характерные мутации различных штаммов SARS-CoV-2.
Ниже мы приводим расшифровку вебинара, прошедшего 26 февраля 2021 года при поддержке Agena Bioscience. В ходе вебинара доктор Мартин Штюрмер рассказал о том, какой эффект новые штаммы SARS-CoV-2 оказывают на существующие методы диагностики, Томас Алеф описал процесс разработки новой системы для выявления штаммов, а доктор Дэррил Ирвин осветил сильные стороны этой системы.
Webinar: Responding to Emerging SARS-CoV-2 Variants from Agena Bioscience on Vimeo.
Кристи Риск: Здравствуйте! Меня зовут Кристи Риск (Christie Rizk), я старший редактор 360Dx и Genomeweb и я буду вашим ведущим на сегодняшнем семинаре 360Dx. Название сегодняшнего вебинара — «Ответ на новые штаммы SARS-CoV-2: влияние на существующие методы диагностики и клиническую эффективность дифференцирующих тестов». Наш спонсор — Agena Bioscience. Наш первый спикер — доктор Мартин Штюрмер (Martin Stürmer), вирусолог и заведующий лабораторией в IMD Labor Frankfurt. Он обсудит влияние новых штаммов SARS-CoV-2 на методы диагностики и эффективность обнаружения и дифференциации между этими штаммами в клинических условиях. После этого мы послушаем Томаса Алефа (Thomas Alef), ведущего научного сотрудника Института иммунологии и генетики и SEQ-IT в Германии. Он расскажет о том, как его лаборатория сумела быстро отреагировать на появление новых штаммов созданием мультиплексной SARS-CoV-2 панели, используя дешевые и высокопродуктивные системы Master-A от Agena Bioscience. И, наконец, нашим последним спикером сегодня будет доктор Дэррил Ирвин (Darryl Irwin), вице-президент Agena Bioscience. Он расскажет о производимой компанией новой панели для тестирования на штаммы SARS-CoV-2, предназначенной для использования с системой Master-A, и как получить доступ к этой панели уже сегодня. Вы можете задавать вопросы в любой момент по ходу вебинара. Я передаю слово Доктору Штюрмеру.

Мартин Штюрмер: Ещё раз здравствуйте, сейчас я переключусь на следующий слайд.
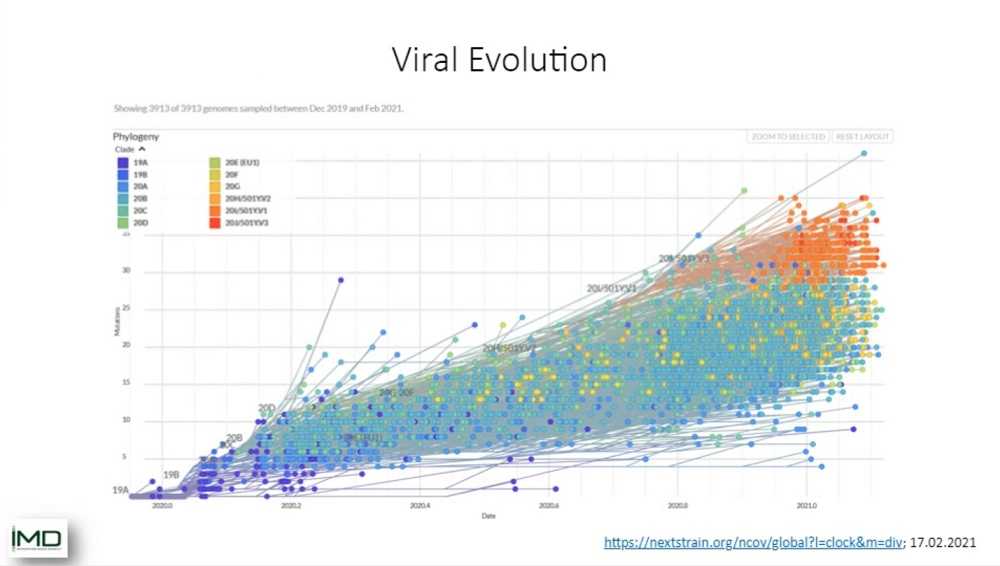
В течение следующих нескольких минут я покажу вам кое-что про новые штаммы и проблемы их категоризации и диагностики. Как вы можете видеть, вирусная эволюция происходит очень быстро. В данном случае мы видим для SARS-CoV-2, как за последние 12 месяцев, начиная с темно-синих ранних штаммов, происходит широкое расхождение в разные линии. Это и есть вирусная эволюция. И мы видим, что SARS-CoV-2 — это очень вариабельный вирус. Не такой вариабельный, как вирус гриппа, например, но все еще с очень большим количеством штаммов.
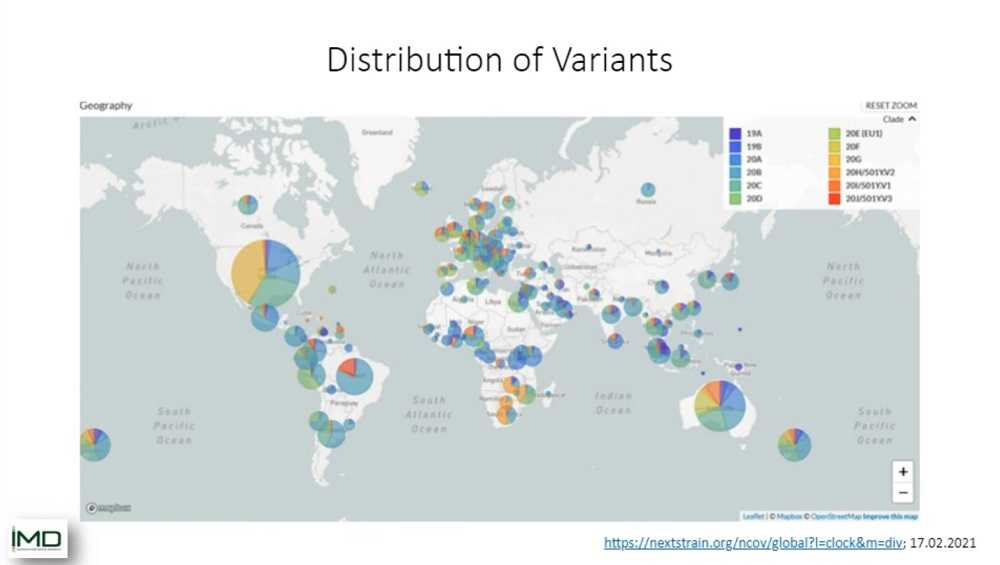
Вы также можете видеть, что штаммы распространены по миру неравномерно. Есть регионы, в которых мы видим специфические штаммы. Но на самом деле мы видим, что какие-то штаммы распространяются сильнее, чем другие, и именно по этой причине мы здесь — чтобы понять, как мы можем охватить все эти штаммы и как они распространяются.

Важный вопрос: почему мы должны беспокоиться из-за штаммов? Являются ли они всего лишь научной игрой, в которую вирусологи играют просто для того, чтобы заняться чем-то интересным? Нет, они действительно составляют проблему. И у нас нет времени перечислять все причины почему, потому что у нас нет трех часов, и я тут не один, так что мы не будем говорить о передаче, хотя очевидно, что определенные штаммы передаются более эффективно. Мы также знаем, что повторное инфицирование более вероятно для некоторых штаммов. Штаммы могут влиять на результат лечения и (или) возрастной спектр. И мы увидим дальше, что вакцины могут быть менее эффективны. И, конечно, диагностические тесты могут не работать, если мы имеем дело со специфичными штаммами. И я покажу вам слайды про вакцины, которые могут быть менее эффективны, и вы сможете увидеть, почему необходимо не только знать, что появился новый штамм, но и знать, с каким именно штаммом мы имеем дело.
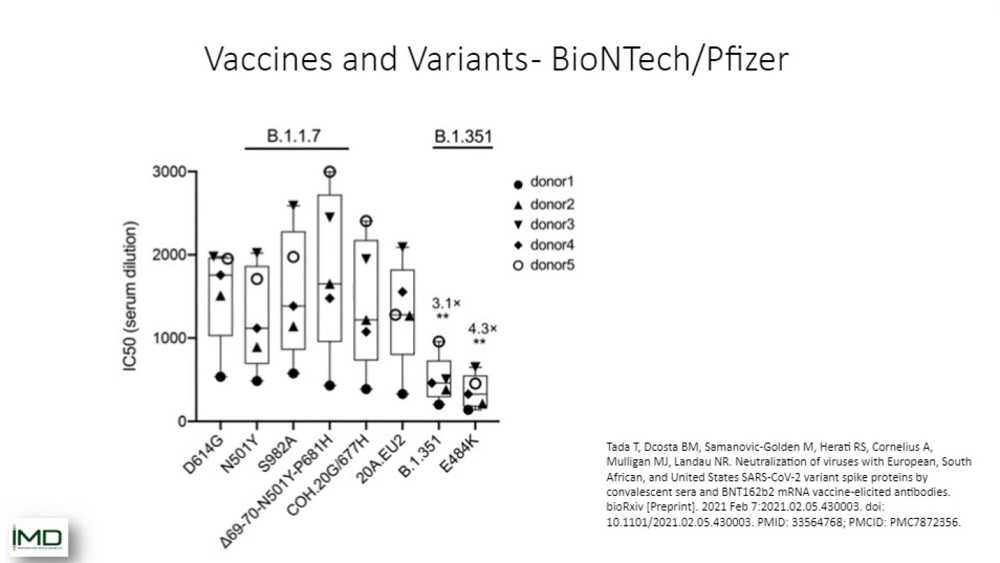
На этом слайде вы можете видеть сравнение двух штаммов — штамма B.1.1.7, так называемого «британского» штамма, и B.1.351, «южноафриканского» штамма. И вы можете видеть здесь сравнение образцов крови от инфицированных людей. Вы можете видеть, что «британский» штамм довольно хорошо нейтрализуется сывороткой, в то время как с «южноафриканским» штаммом мы видим снижение эффективности нейтрализации. Так что важно знать, с каким штаммом мы имеем дело, потому что вакцины могут давать различный эффект.
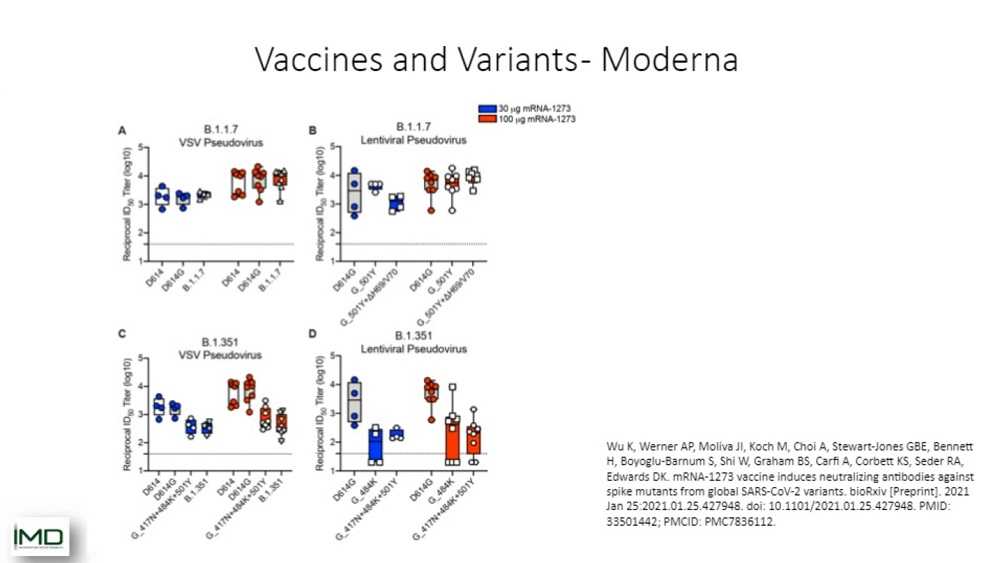
То же самое показано для вакцины Moderna. Вы можете видеть здесь, что разные концентрации работают практически одинаково. Использовали два подхода. С левой стороны вы видите, что они использовали VSV-псевдовирусы и штаммы полной длины в сравнении с лентивирусными псевдовирусами, несущими только ключевые мутации. Вы можете видеть на двух верхних графиках, что B.1.1.7 хорошо поддается вакцине Moderna. Другая картина вырисовывается в случае с «южноафриканским» штаммом. Мы видим снижение эффективности вакцины. И, опять-таки, схожая картина получена для вакцины Pfizer. Есть некоторые опасения, что эти вакцины будут работать не так эффективно, как они работают на распространенных штаммах, на «британском» штамме. Это еще один знак, что очень важно знать, с каким штаммом мы имеем дело в каждой конкретной ситуации.

На следующих слайдах я расскажу о диагностических тестах, которые могут не работать, если мы имеем дело с разными штаммами. И я расскажу про три важных составляющих диагностических тестов, которые у нас есть. Это тестирование на нуклеиновые кислоты, тестирование на антигены и тестирование на антитела.

В Великобритании после появления «британского» штамма прошло сообщение о тестировании на нуклеиновые кислоты. Большое количество лабораторий там использовали ПЦР-системы Thermo Fisher, которые представляют собой таргетный тест на три гена. При тестировании этой системой образца, у которого присутствует мутация Δ69/70, S-ген выпадает из анализа. Конечно, можно сказать, что это тест на три гена, и если результат на два специфичных гена положительный, то вам не обязательно знать, что происходит с S-геном. С другой стороны, с этим тестом у вас будет очень хорошее представление о том, присутствует ли у вас конкретный штамм, потому что, если у вас выпадает S-ген при положительном результате на два других гена, вы можете сказать: «хорошо, есть большая вероятность, что мы имеем дело с британским штаммом». Так что получается, в некотором роде, специфичная ПЦР.

Анализ антигенных тестов был проведен правительством Великобритании и опубликован в конце прошлого года. Он показал, что результат всех пяти тестов на антигены, которые у них есть, не зависит от присутствия штаммов. Однако эти тесты нацелены на белок нуклеокапсида, а мы говорим про мутации S-антигена. Томас расскажет вам гораздо более подробно, я не буду сейчас об этом рассказывать, но штаммы несут мутации также и в других частях генома, о которых мы не будем сейчас говорить. Но именно мутации в белке нуклеокапсида не влияют на результат этих тестов. Но проверку необходимо проводить регулярно. Нельзя просто сказать: «мы проверили это один раз, всё в порядке». На рынке есть антигенные тесты, которые нацелены на S-ген, и на эти тесты может сильнее влиять появление новых штаммов и новых мутаций. И, как я говорил, вирусная эволюция будет продолжаться, так что в будущем может быть больше данных о том, какие тесты могут переставать работать из-за появления новый штаммов.

Как немец, я могу посмотреть сообщения немецкого регуляторного бюро — Института Пауля Эрлиха. Они упоминали, что если антигенный тест направлен на поверхностный спайк-белок, он надежно распознает мутации, которые приводят к появлению специфичных штаммов, таких как «британский» штамм. Так что с самого начала производитель тестов должен показать, что его тесты работают в присутствии штаммов. Важно знать и помнить об этом. Потому что чего мы не хотим, так это плохо работающих тестов, в особенности антигенных тестов и тестов на нуклеиновые кислоты. Потому что мы не хотим получать ложноотрицательные результаты при диагностике.

Тесты на антитела — это сложнее, потому что до сих пор никто не знает, какой титр необходим для того, чтобы подтвердить так называемый «иммунитет». Я знаю, что в Израиле вы можете получить зеленый сигнал в мобильном приложении, если вы привиты. Мне это несколько не нравится, потому что я не уверен, что у нас достаточно данных, чтобы понять, действительно ли вакцинированные люди безопасны и не могут заразить других людей. Но мы сегодня говорим не об этом. Тесты на антитела присутствуют на рынке и активно используются для разных целей. Если вы ищете такой тест, особенно если вы ищете его после вакцинации, то вы должны искать тест на антитела к S-белку. И вы должны удостовериться в том, что тест, который вы используете, способен обнаруживать эти антитела корректно. Потому что иммунный ответ на штаммы отличается, и от S-антигена в тесте зависит то, какие антитела вы сможете обнаружить. Это до сих пор остается предметом для обсуждения, и до сих пор, ни одного хорошего анализа не было проведено, так что, к сожалению, эта проблема при использовании тестов на антитела остается.
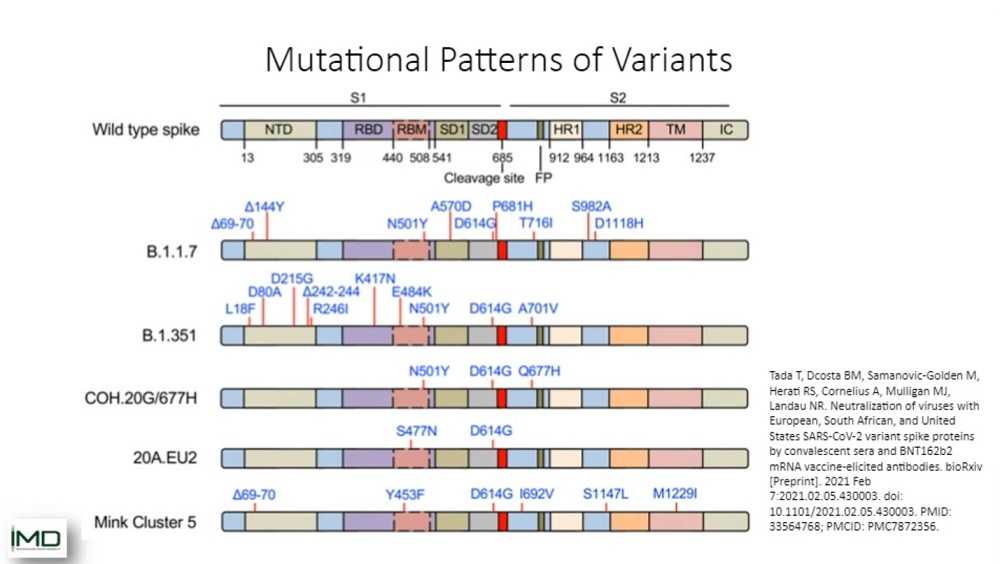
Это будет единственный слайд, на котором я покажу вам мутации, потому что это не моя тема сегодня. Просто помните, что есть мутации, которые уникальны для специфичных штаммов, и Томас расскажет вам, как использовать их, чтобы различать эти штаммы. И есть мутации, которые встречаются у нескольких штаммов.
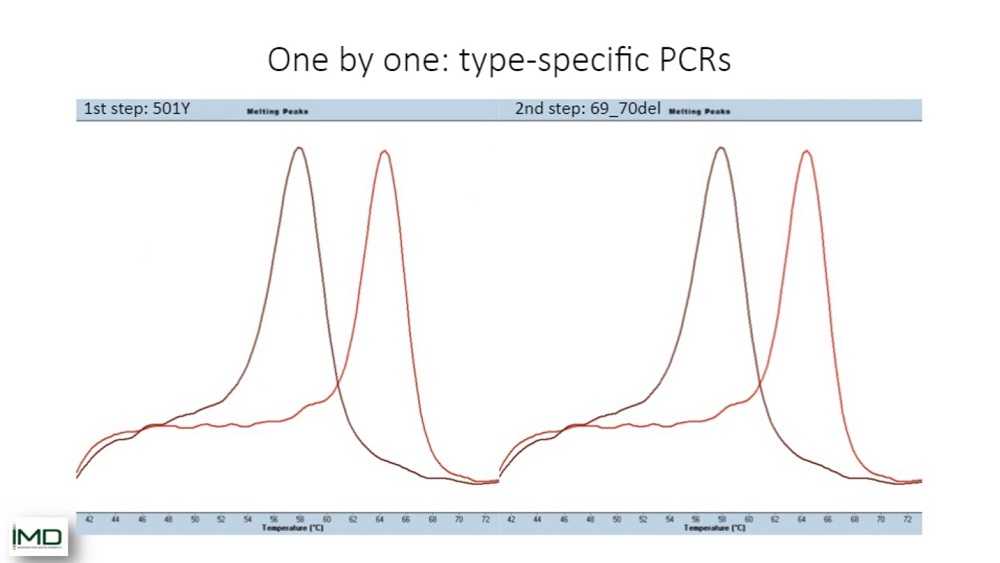
Классическая технология, которая использовалась до настоящего момента, помимо полногеномного секвенирования — типоспецифичная ПЦР — может работать только пошагово. Сначала вы проверяете одну мутацию, потом вы переходите к следующей ПЦР, в которой вы, может быть, проверите делецию, и так далее. Это очень время- и трудозатратная процедура. Именно поэтому у Томаса возникла отличная идея делать это не шаг за шагом, а все вместе, и на этом моменте я передам слово Томасу. Томас, я очень горд, что я ваш коллега, и что я могу использовать ваш тест, и я очень рад возможности посмотреть, как вы его разработали.
Томас Алеф: Большое спасибо, Мартин, и добро пожаловать, дорогие друзья. Я начну свой доклад с короткого вступления о том, кем мы являемся. Потом я проведу вас через весь процесс разработки, через который прошли мы в SEQ-IT. И в конце я покажу вам предварительные данные о достоверности, которые мы получили в нашей лаборатории.
Институт иммунологии и генетики (Institute of Immunology and Genetics) находится в Кайзерслаутерне в юго-западной части Германии и состоит из двух секций: лаборатория медицинской диагностики (Medical Diagnostic Laboratory) с одной стороны и, с другой стороны, SEQ-IT, который является отделением молекулярно-биологических сервисов (Molecular Biology Service Unit) Института иммунологии и генетики. В этих двух секциях команда из клинических патологов, генетиков человека, вирусологов, молекулярных биологов и биоинформатиков работает в тесном контакте над разработкой тестов для внутреннего использования в нашей лаборатории медицинской диагностики и для наших клиентов.

Когда мы начинаем разработку нового теста, первый вопрос всегда — каким требованиям должен отвечать этот тест. Для панели, направленной на два штамма, очевидно, что необходимо различить два наиболее важных штамма. Когда мы начали тесты несколько недель назад, наиболее распространенными, помимо дикого типа и Mink/Clister5, были «британский» и «южноафриканский» штаммы. Спустя какое-то время проявился «бразильский» штамм.

Кроме вопроса о том, какие штаммы включать, от теста также требуется, с нашей точки зрения, достаточное разрешение для надежной дифференциации, высокая чувствительность, временные затраты на проведение в пределах одного дня и, естественно, адекватная максимально низкая цена за образец.

После ответа на этот первый вопрос, необходимо ответить на следующий: какую технологию использовать для этого теста. У нас есть три кандидата, из которых можно выбрать. Первый — ПЦР в реальном времени с обратной транскрипцией. Это, определенно, очень быстрый, очень чувствительный и экономичный метод, но эффективный только для малого количества мишеней. Он не достигает необходимого разрешения. Второй кандидат — NGS, которое, определенно, дает максимально возможное разрешение, но это медленный, трудозатратный и дорогой метод. Так что масс-спектрометрия MALDI-TOF, с нашей точки зрения, попадает в золотую середину между двумя упомянутыми выше технологиями. С одной стороны, она гораздо быстрее и дешевле, чем NGS, с другой стороны, обладает гораздо более высоким разрешением по сравнению с ОТ-ПЦР, обладая сопоставимой чувствительностью при минимальной цене. Ответив на этот вопрос, мы, наконец, можем перейти к дизайну теста.
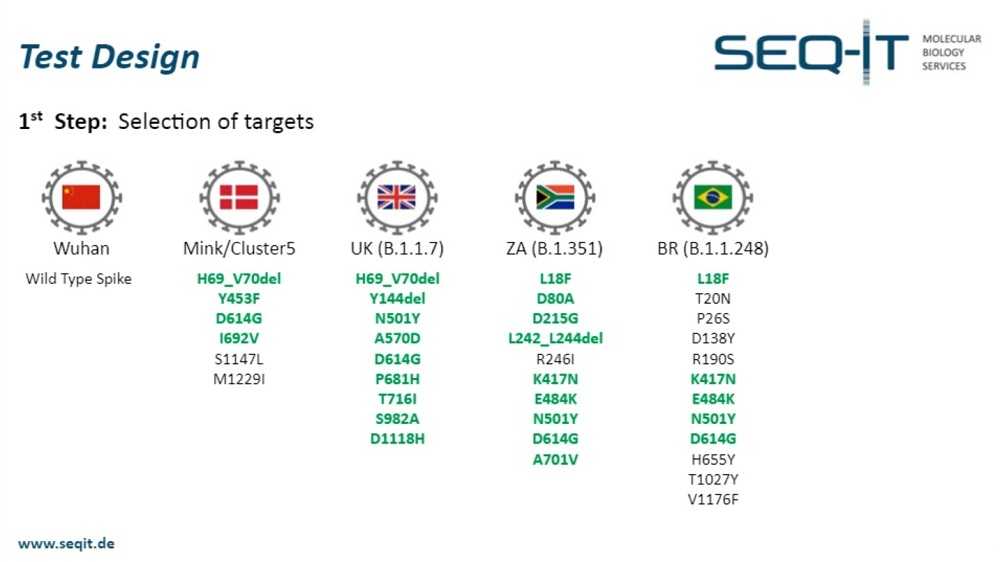
На первом этапе необходимо выбрать мишени, которые вы хотите включить в ваш тест. Когда мы начали обсуждать это несколько недель назад, «бразильский» штамм был не так популярен. Мы начали, отталкиваясь от основного кластера из пяти штаммов, затем полностью охватили «британский» штамм и почти полностью — «южноафриканский» штамм.

Мы выбрали, кроме мутаций, выделенных зеленым, две дополнительные мишени, находящиеся в позициях 417 и 501, чтобы целиком охватить эти кодоны, и добавили еще одну мишень — ген N-белка SARS-CoV-2. Более того, для каждого мультиплекса в тест должен быть включен контроль экстракции.
На следующем этапе мы выровняли более 30 000 сиквенсов SARS-CoV-2 из NCBI, чтобы найти последовательность, лежащую в основе упомянутых выше мутаций.
Наконец, на третьем этапе мы подготовили сиквенсы для Agena Bioscience Assay Design Suite v2.2, основываясь на выравниваниях второго этапа, чтобы не допустить частоты проксимальных мутаций более 1% — такие мутации могут затрагивать сайты связывания праймеров.

После того, как все это было сделано, процесс дизайна был довольно простым. Однако, как всегда, пришлось преодолеть некоторые трудности. В данном случае делеция Y144del не может быть выявлена стандартным тестом из-за приведенной тут последовательности. Если вы будете использовать прямой праймер для этой делеции, вы получите сигнал как для Y-типа, так и для делеции. Так что нам пришлось найти обходной путь, в котором мы помещали праймер не перед делецией, а на нее. В таком случае отсутствие прикрепления праймера будет означать присутствие делеции. Однако при таком подходе нам необходимо исключить выпадение всего ампликона, для чего необходимо интегрировать в панель дополнительный контроль.

Здесь показаны два изображения. Для дикого типа мы видим хороший тестовый сигнал и хороший сигнал контроля амплификации. В то время как для делеции мы видим только сигнал контроля амплификации, что позволяет нам исключить выпадение всего ампликона.

Окончательный дизайн включает в себя 24 теста, разделенных на две панели. Первая панель, как вы можете видеть, включает в себя 18 тестов и охватывает почти все релевантные мутации. Вторая панель включает на данный момент всего 6 тестов и является опциональной. Вы можете ограничиться только первой панелью, чтобы проанализировать в два раза больше образцов за ту же цену. Это может быть полезно при высокой нагрузке и необходимости анализировать большое количество образцов одновременно. Тем не менее, вторая панель необходима, так как, как сказал Мартин, вирусы эволюционируют крайне быстро, и уже появились новые мутации. В систему Agena Bioscience очень легко включить новые мутации, не меняя основного дизайна. Первая панель уже почти полностью заполнилась, так что вторая панель необходима для последующего включения новых мутаций.
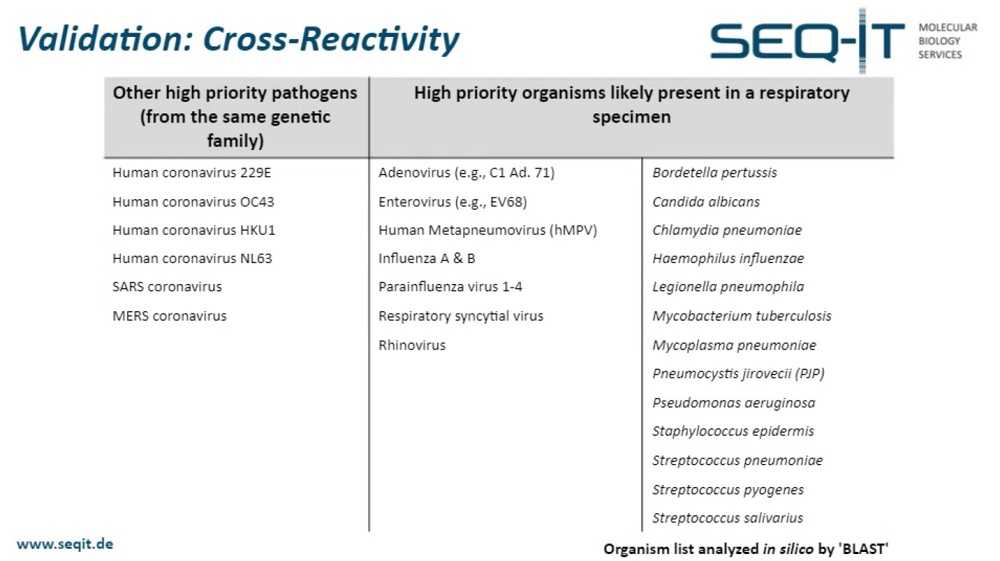
Теперь некоторые данные о достоверности, которые мы получили в нашей лаборатории. Один из вопросов, на который необходимо дать ответ — есть ли кросс-реактивность тестов с другими высокоприоритетными патогенами того же генетического семейства, такими как сезонные коронавирусы, SARS или MERS, наряду с кросс-реактивностью с высокоприоритетными организмами, с высокой вероятностью присутствующие в образце из респираторного тракта, например, другими респираторными вирусами или бактериями. Этот тест был проведен in silico с помощью алгоритма BLAST, созданного NCBI, и не показал какой-либо значимой кросс-реактивности.

На следующем этапе мы провели тестовый прогон панели. Я должен сказать, что мы использовали химическую и ПЦР-программу из панели MassARRAY SARS-CoV-2 CE_IVD Panel. То есть, мы просто заменили праймеры на наши из свежеразработанной панели. Я упоминаю об этом, потому что ни химическая, ни ПЦР-программа не оптимизированы под наш набор праймеров. Тем не менее, мы получили хорошие результаты, тестируя четыре синтетических РНК-контроля фирмы TWIST — два для британского штамма и два для дикого типа. Далее мы протестировали 20 образцов SARS-CoV-2 дикого типа, каждый из которых был до этого проанализирован с помощью ОТ-ПЦР с величинами пороговых циклов от 17 до 25, и 19 образцов «британского» штамма из наших запасов, также прежде проанализированные с помощью ОТ-ПЦР и с помощью NGS. Кроме того, нам удалось получить один образец «южноафриканского» штамма, который был прежде проанализирован с помощью ОТ-ПЦР и NGS. Мы добавили негативные контроли и контроли с человеческой РНК, чтобы проверить кросс-реактивность, которой в результате не наблюдалось. Итоговые результаты были отличными, лишь с небольшими выпадениями. Мы смогли успешно дифференцировать все 19 британских штаммов и единственный южноафриканский штамм с помощью этой панели и подтвердили наши результаты с помощью секвенирования.
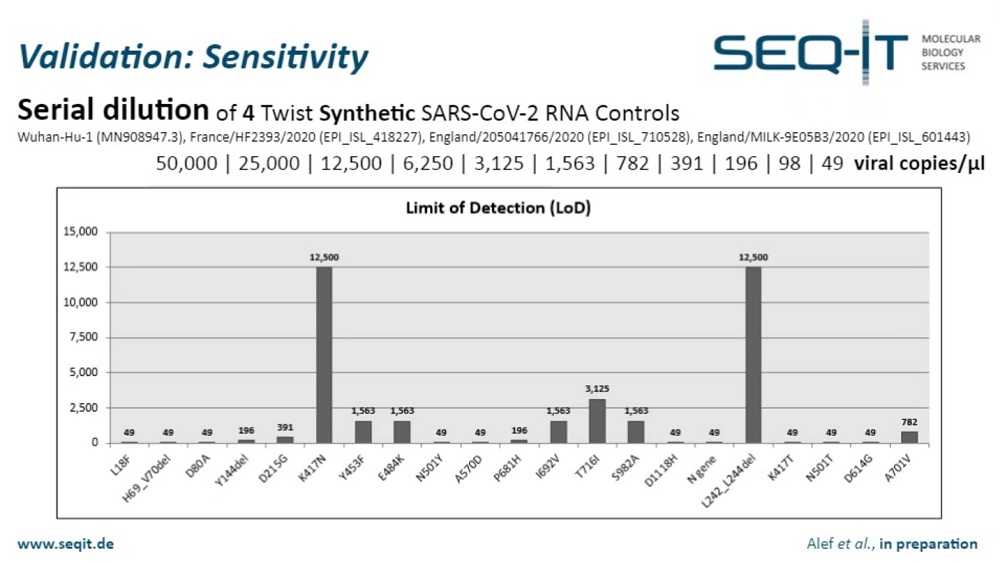
На следующем этапе мы использовали четыре синтетических РНК-контроля фирмы TWIST для последовательного разведения. Мы начали с 50 000 вирусных копий на микролитр и опустились до 49 вирусных копий на микролитр. Как вы можете видеть на этом слайде, эффективность тестов не одинакова. У нас есть два, которые, на данный момент показывают не лучшие результаты. Это анализ на замену K417N и делецию L242_244. Надо помнить, что химическая и ПЦР-программа не оптимизированы для нашего набора праймеров, так что я уверен, и проверка все еще идет у нас в лаборатории, что мы сможем вернуться к более высокому уровню чувствительности, особенно для этих двух штаммов. Все это будет опубликовано в ближайшее время, и в публикации результаты будут показаны в деталях.

Мутации можно распределить по четырем группам: группа обнаружения, включающая N-ген и D614G; группа ключевых мутаций с E484K и N501Y; две группы с определяющими мутациями для «британского» и «южноафриканского» штаммов. Уровень обнаружения каждой группы — менее 2 500 вирусных копий на микролитр, а значит, у нас все еще достаточно разрешения для надежного обнаружения штаммов. Даже если мы опустимся до 50 вирусных копий на микролитр, у нас будет достаточно мишеней, чтобы различить штаммы.

На этом я хочу завершить свою презентацию, с заключением, что панель штаммов SARS-CoV-2 для системы MassARRAY от Agena Bioscience представляет собой инновационный подход, который обеспечивает быструю и экономически эффективную дифференциацию наиболее важных в настоящий момент штаммов SARS-CoV-2 с высокой чувствительностью и достаточным разрешением.
Так как почти все необходимые мутации включены в первую панель, использование второй панели может считаться опциональным. От него можно отказаться ради удвоения числа образцов, что также снизит стоимость реагентов вдвое.
Более того, высокая гибкость тестов позволяет легко расширять панель штаммов SARS-CoV-2 и добавлять в нее новые штаммы.
На этом я передаю слово Дэррилу, спасибо за внимание.
Дэррил Ирвин: Спасибо, Томас и Мартин, за ваши доклады. Мы в Agena Bioscience гордимся своей способностью быстро разрабатывать новые тесты. Но, на самом деле, без активного сотрудничества с вами, это не было бы возможно.
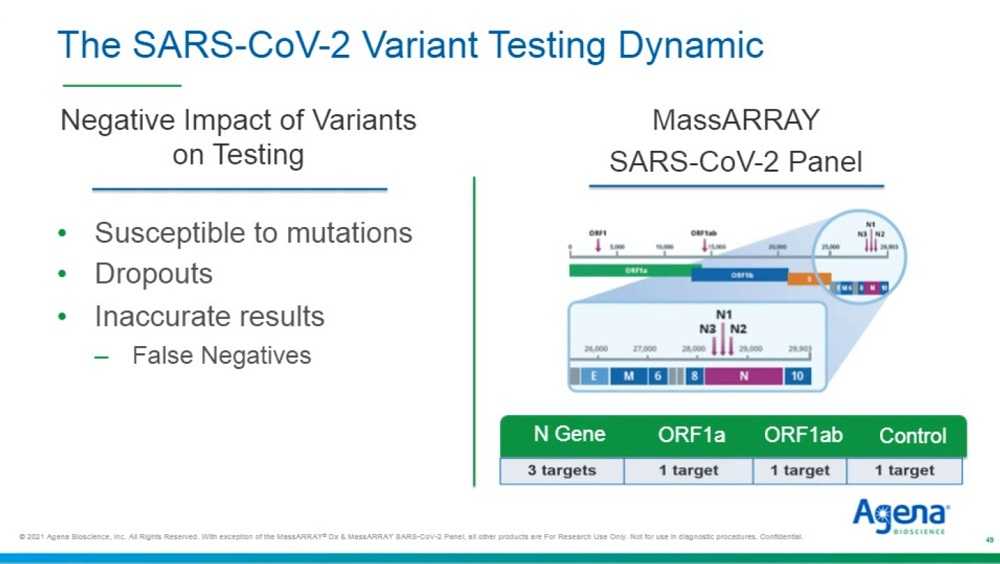
Мы уже услышали сегодня о потенциальном воздействии новых мутаций на точность диагностических тестов. Именно по этой причине, когда мы разрабатывали нашу панель MassARRAY SARS-CoV-2 CE_IVD Panel, мы включили пять мишеней, чтобы гарантировать высокие уровни избыточности. Так, в этой панели у нас есть три мишени в N-гене, одна в ORF1a, одна в ORF1ab, а также контроль. Все это ради уверенности в том, что мутации, присутствующие в образцах, не приведут к ложноотрицательным результатам. Мы уже немного слышали про концепт сбоя мишени, в частности про B.1.1.7, «британский» штамм. Так что я хотел бы рассмотреть это несколько более подробно.

Итак, это называется сбой мишени в S-гене. В частности, Δ69/70 в штамме B.1.1.7, приводит к тому, что некоторые тесты не амплифицируют данный регион. Это явление было предложено в качестве метода обнаружения штамма B.1.1.7, но у такого подхода существуют некоторые ограничения. Группа из Португалии показала, что сбой мишени в S-гене в 10% образцов проявляется в виде слабой амплификации мишени. Это не является, на самом деле, сбоем мишени. В действительности мишень амплифицировалась, просто при более высоком пороговом числе циклов, чем другие, с разницей примерно в 5 циклов. То есть, это не обязательно отсутствие амплификации. Лаборатории также должны обращать внимание на изменение в пороговом числе циклов между тестами, что довольно обременительно. Конечно, сбой мишени в S-гене говорит только о Δ69/70, которая присутствует и в других штаммах, кроме B.1.1.7. Несколько групп выпустили публикации на эту тему.
Группа в Helix секвенировала 460 образцов, показывавших сбой мишени в S-гене. Из этих 460 образцов 209 (45%) содержали B.1.1.7. Оставшиеся принадлежали другим штаммам. Группа из ARUP также опубликовала похожу работу. Опять же, из 150 отсеквенированных образцов четыре были определены как B.1.1.7, остальные были отнесены к двум другим штаммам. Это все показано на малых значениях пороговых циклов и высокой вирусной нагрузке. Когда пороговое число циклов вырастает до 30, а вирусная нагрузка снижается, мы можем наблюдать ошибочный ложный сбой мишени в S-гене. Наконец, у этого метода есть, потенциально, способность идентифицировать только B.1.1.7, но не другие штаммы.

Так что у MassARRAY есть уникальные преимущества, когда речь идет об определении штаммов SARS-CoV-2. Как мы уже слышали, мультиплексный подход позволяет уместить несколько тестов в одну реакцию, что позволяет выявить целый набор штаммов. Томас уже рассказывал, насколько экономически эффективен такой подход. Мультиплексные реакции, проходящие на нашем масс-спектрометре, являются наиболее дешевой опцией для определения вирусных штаммов на рынке на данный момент. Поставляемое в комплекте биоинформатическое ПО позволяет проводить за секунды анализ тысяч результатов в один клик без необходимости использовать сторонние программы. У системы высокий уровень чувствительности, а значит для анализа необходимо малое количество материала. Томас рассказал нам об уровнях чувствительности, которые возможны с этой системой. И, конечно, с этой системой вы можете обработать вплоть до 3 000 образцов в день на одной машине.

Здесь представлена схема панели MassARRAY SARS-CoV-2 Variant Panel v1, которую мы делаем доступной сегодня. Панель задействует собой две лунки на образец, то есть две реакции. Мы типируем шесть различных линий: британскую B.1.1.7, южноафриканскую B.1.351, бразильскую B.1.248/P1, кластер 5/Mink (датскую), D614G, который представляет штамм, проявившийся очень рано, в начале 2020 года, и, конечно, дикий тип (уханьский штамм) и, разумеется, контроль. Вы можете видеть, на слайде они обозначены цветом, у нас есть от четырех до семи тестов на линию, которые используются для идентификации присутствия конкретного штамма, так что уровень избыточности большой.
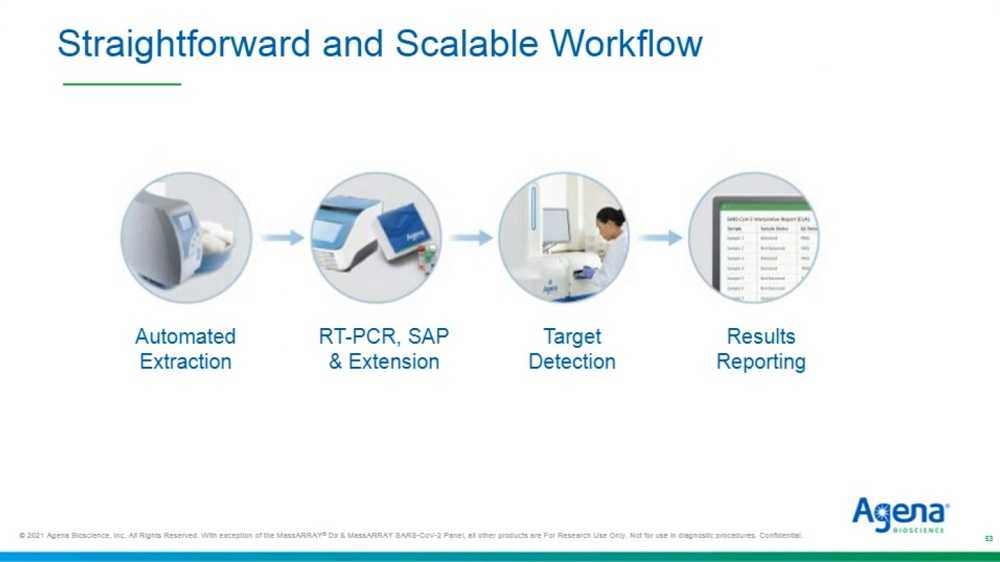
Сам процесс работы, как я уже говорил, происходит в течение одного дня. На самом деле, он занимает меньше одного дня с возможностью обрабатывать 3 000 образцов в день. Происходит автоматическая экстракция нуклеиновой кислоты, одношаговая ПЦР с обратной транскрипцией, за которой идет удлинение по одному основанию. После прохождения термоциклов плашка загружается в модуль считывания системы MassARRAY, где она плашка анализируется с выводом результатов в виде отчета.

Я хочу показать вам, как выглядит отчет по образцу. Тут мы видим пример отчета по TWIST-контролю, воспроизводящему B.1.1.7. Сверху находится информация о том, когда был составлен отчет, версии программного обеспечения, ID образца, информация о том, прошел ли он контроль качества. Если образец его не прошел, там будут детали, почему именно. Далее мы видим специфичные изменения в нуклеиновых кислотах, то есть каждую индивидуальную мутацию, которая присутствует в образце. Ниже выводятся таргетные результаты, в которых указано, какие штаммы вируса присутствуют в образце или же что там присутствует дикий тип. Тут, как вы можете видеть, B.1.1.7 и D614G отмечены как обнаруженные.

Это очень красивый форматированный отчет, но многие лаборатории хотят получать выход в виде сырых данных, которые они могут импортировать затем в их собственную лабораторную базу. Такой вариант вывода данных также присутствует. Он представляет собой очень простой csv-файл, который содержит всю ту же информацию: название образца, информацию о контроле качества, локализации, плашках. Это так же дает вам информацию о штаммах, которые были обнаружены, и всех индивидуальных мутациях. Все это вы можете легко засунуть в вашу систему обработки информации, если вы не хотите использовать наши отчеты.

Я благодарю нашу аудиторию за внимание. Как я уже упоминал, данная панель доступна с сегодняшнего дня, так что, если вы хотите получить больше информации или хотите получить доступ к панели, пожалуйста, свяжитесь с нами через форму на нашем сайте и кто-нибудь из нас очень быстро вам ответит. Мы планируем обновлять эту панель по факту появления новых штаммов вируса. И мы хотели бы, чтобы вы помогли нам с этим, так что, как глава научного отдела, я хотел бы, чтобы вы написали нам на scientificaffairs@agena.com и дали знать, если вы обнаруживаете новые штаммы, которые вам бы хотелось видеть в нашей панели. Теперь я передам слово обратно Кристи для вопросов и ответов.
Кристи Риск: Спасибо, Дэррил, и спасибо всем нашим спикерам за замечательные доклады. Давайте перейдем к вопросам. Мартин, наш первый вопрос адресован вам. Показали ли ваши исследования влияние штаммов SARS-CoV-2 на эффективность различных вакцин? Будут ли нужны бустерные вакцины?
Мартин Штюрмер: Да, я показывал два слайда про то, что штаммы будут влиять на эффективность вакцин. К настоящему моменту мы достаточно уверены, что вакцины все еще работают, особенно РНК-вакцины. Но мы не можем быть уверены, что SARS-CoV-2 не получит еще больше мутаций. Рано или поздно будет необходимо разрабатывать новые вакцины. К счастью, провайдеры этих вакцин также ведут поиск штаммов и будут способны адаптировать свои вакцины. Один из немецких производителей вакцин — CureVac — уже начал производство обновленных вакцин, так что мы можем быть спокойны. Пристальный поиск штаммов позволит нам направить разработку вакцин.
Кристи Риск: В продолжение к этому вопросу: показали ли ваши исследования, что типичные вирусные нагрузки для ранних и поздних стадий SARS-CoV-2 различаются в зависимости от того, каким штаммом заразился пациент?
Мартин Штюрмер: Я читал статью, в которой говорилось, что вирусная нагрузка для «британского» штамма не отличается от старого штамма. Так что ничто не указывает на то, что вирусные нагрузки как-то влияют на эффективность вируса. Штаммы гораздо легче связываются с клеточными рецепторами, в особенности из-за мутаций, особенно из-за мутации 501. Есть также свидетельства, что заразная фаза у штаммов длиннее обычного, и это может также обеспечивать более эффективное распространение. Это то, что показано для «британского» штамма. Для других штаммов у меня нет данных.
Кристи Риск: Отлично. На наш следующий вопрос смогут ответить и Мартин, и Томас. Рассматривал ли кто-то из вас использование микрочипов для идентификации новых штаммов? Мартин, хотите ответить первым?
Мартин Штюрмер: Микрочипы — это интересный инструмент, но, так как мы уже хорошо знакомы с системой Agena, для нас с Томасом это был более простой способ разработки нашей панели. Так, Томас?
Томас Алеф: Именно так, Мартин. Как я говорил в своем докладе, в каждой лаборатории свой набор инструментов и технологий. Мы фокусируемся в основном на секвенировании, масс-спектрометрии и RT-PCR. Именно поэтому мы выбрали одну из этих технологий для решения проблемы обнаружения штаммов SARS-CoV-2.
Кристи Риск: Томас, что происходит с неизвестными штаммами? Обнаруживает ли ваша панель какой-то штамм в принципе в такой ситуации? И в качестве продолжения к этому — как быстро новые мутации могут быть включены в вашу панель?
Томас Алеф: Я не вирусолог, но из того, что я читал и видел в прессе, и как говорил Мартин, много штаммов имеют общие мутации, такие как 501 или 484. Такая панель с 20 мутациями не может, как показано тут с «бразильским» штаммом, полностью идентифицировать новые штаммы, но вы, как минимум, получите какую-то информацию, даже без добавления новых штаммов и мутаций. Но сам процесс добавления новых штаммов в панель не займет много времени, потому что мы просто включим их в существующий дизайн без необходимости начинать с нуля.
Кристи Риск: И что считается положительным сигналом для, например, B.1.1.7? Должны ли все мишени присутствовать или только какие-то из них? Как это работает?
Томас Алеф: Ну, B.1.1.7 включен в панель целиком, то есть у нас включены все мутации, которые определяют этот штамм. Так что, если образец действительно является B.1.1.7, то вы получите положительный результат для всех определяющих мутаций. Но на самом деле, если вы посмотрите глубже в классификацию штаммов, то вы найдете случаи, когда присутствуют не все характерные мутации, а только часть. Тогда, получается, это не «классический» B.1.1.7, а какая-то его производная. Но, как я уже говорил, классический «британский» штамм включен в панель целиком, также как и «южноафриканский», за исключением одной мутации. Может, мы можем переключиться на этот слайд, и я покажу вам, как вы можете решить эту проблему с точки зрения комбинаторики.
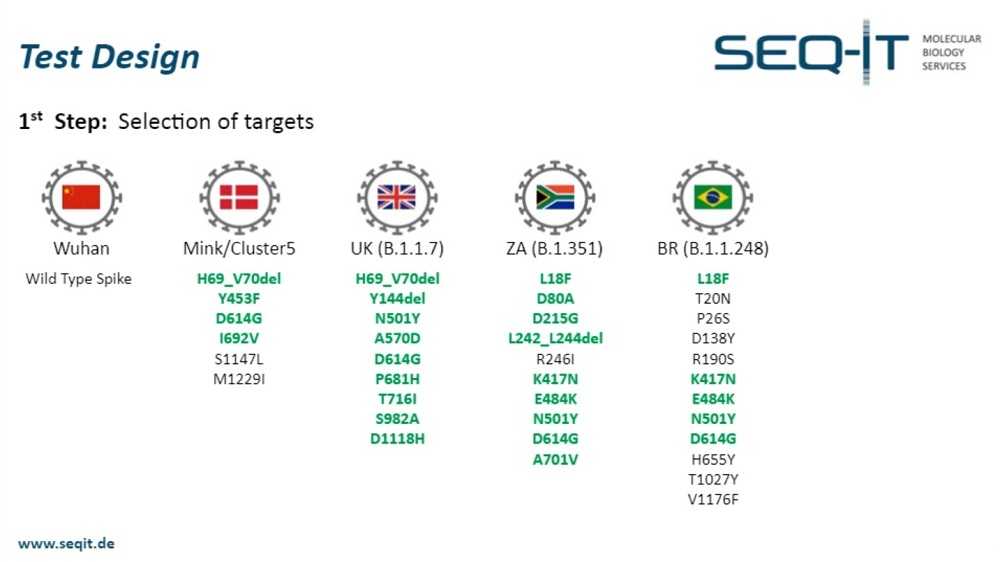
Здесь вы можете видеть, что дифференциация между, например, «бразильским» и «южноафриканским» штаммами возможна с таким набором мутаций, потому что вот эти зеленые все присутствуют в «южноафриканском» штамме, но если другие, например, A701V или D80A и D215G, не дают сигнал, а первые пять дают, то вы с большой долей уверенности можете сказать, что у вас присутствует «бразильский» штамм.
Кристи Риск: Отлично. Дэррил, у нас есть вопрос про технический потенциал расширения панели для включения большего количества мутаций. Как Agena подходит к этой проблеме?
Дэррил Ирвин: Мы рассказываем сегодня про запуск первого варианта панели, и мы уже обсуждаем включение новых штаммов, включая «калифорнийский». В принципе, добавление штамма — это быстрый процесс. Нам нужно около одной-двух недель. Нам нудно решить, с какой периодичностью мы будем добавлять новые штаммы. И я думаю, что это будет зависеть от того, с какой скоростью будут открываться новые штаммы. Добавление нового штамма занимает всего пару недель, так что все упирается в то, когда новые штаммы будут обнаружены. Тогда мы их и добавим.
Кристи Риск: Поставляется ли MassARRAY с референсными образцами, и если нет, есть ли какой-то набор, который рекомендует Agena?
Дэррил Ирвин: Мы рекомендуем референсные образцы вместо того, чтобы включать их в панель. Как вы могли видеть сегодня, мы использовали референсы производства TWIST, но другие штаммы также доступны.
Кристи Риск: Отлично. К вопросу о типах образцов, с чем лучше работает панель — с назофарингеальными мазками, слюной? И что рекомендует ваша компания?
Дэррил Ирвин: Мы тестировали все на назофарингеальных мазках. Другие группы использовали платформу с другими типами образцов, включая слюну. На данном этапе это подтверждающий тест, то есть у вас есть SARS-CoV-2-положительный образец, который вы пропускаете через эту панель. И вы можете использовать различные типы образцов, но все наши тесты были проведены на мазках.
Кристи Риск: Томас и Мартин, есть ли у вас какие-то мысли по поводу того, какой тип образцов будет в ближайшем будущем наиболее полезным с клинической точки зрения? Мартин, я думаю, это, наверное, будет наиболее релевантно по отношению к вам.
Мартин Штюрмер: Я думаю, что панель крайне важна, чтобы понять, какие штаммы присутствуют, потому что у них могут отличаться клинические исходы в случае с вакцинациями и тому подобное. Как мы уже слышали, сейчас уже есть новые штаммы, которые нам надо включить в панель, включая два интересных штамма из США. И, конечно, есть ключевые мутации, на которые нам надо обратить внимание, это мутации 501 и 484. Да, я думаю, что будущее этой панели крайне интересно, но нам надо внимательно искать новые штаммы, которые сейчас вызывают большие опасения. С клинической точки зрения очень-очень важно знать, какой именно штамм присутствует в образце.
Кристи Риск: Томас, в какой-то момент вы упоминали секвенирование нового поколения. Можете пояснить, имели ли вы ввиду секвенирование ампликонов или секвенирование с гибридизационным захватом. Потому что между ними есть довольно большая разница в требованиях ко времени. И поясните, пожалуйста, почему вы выбрали именно тот конкретный метод, который вы выбрали.
Томас Алеф: Мне очень нравится секвенирование нового поколения. Это отличный метод, но неидеальный для этой конкретной задачи быстрого тестирования. Одна из проблем — если вы маленькая лаборатория, то вы не будете запускать прибор для NGS ради одного, двух или трех образцов. Это получится слишком дорого. Подготовка библиотек для NGS на основе ампликона или гибридного захвата занимает один-два дня. Затем идет время работы прибора, которое обычно сильно больше, чем для ОТ-ПЦР или масс-спектрометрии. И потом вам нужно обработать данные и подготовить их для отчета. Так что, если вам надо было бы протестировать 50–100 тысяч образцов, этот метод будет работать хорошо. Но большинству лабораторий надо работать быстрее и с гораздо меньшим количеством образцов. Так что, с моей точки зрения, NGS — это далеко не лучший диагностический инструмент. С академической точки зрения, оно, определенно, необходимо, потому что, как я говорил, оно дает нам полную картину, включая мутации за пределами S-гена. Это инструмент другой области, нежели масс-спектрометрия.
Кристи Риск: Дэррил, можете сказать нам, какой уровень чувствительности показывает панель SARS-CoV-2 при использовании назофарингеальных мазков? А также какой предел обнаружения для этой панели?
Дэррил Ирвин: Мы все еще работам над этим и мы пишем статью, в которой будут все детали. Она должна выйти на следующей неделе. Предел обнаружения, который мы наблюдали, — это около ста копий вируса, которые попали в реакцию. А дальше вам нужно понять, чему это эквивалентно при пересчете на назофарингеальный мазок, в котором около 0,3–0,4 копий на микролитр.
Кристи Риск: И вопрос вам всем троим: каким вы видите будущее тестирования на SARS-CoV-2? Станут ли такие панели использоваться повсеместно? Какое положение займут подобные панели, относительно существующих тестов? Мартин, начнете?
Мартин Штюрмер: Я могу сказать по опыту Германии: почти все ПЦР-положительные образцы должны быть подтверждены штамм-специфичным тестом. Так что мы теперь почти ежедневно проводим такие тесты. Потому что всех беспокоит появление новых штаммов и их распространение в Германии. На данный момент, это часть моей рутинной работы. Так что очень удобно иметь подобную панель, потому что, как сказал Томас, она гораздо быстрее, чем NGS, способна дать правительству ту информацию, которая им нужна. Важно помнить о необходимости включать новые штаммы, конечно же. Но даже в текущем виде эта панель крайне полезна.
Кристи Риск: Томас?
Томас Алеф: Мне, на самом деле, нечего добавить. Мартин уже сказал все, что я хотел.
Кристи Риск: Дэррил?
Дэррил Ирвин: Нам представляется ситуация, в которой каждый положительный образец анализируется на предмет того, является ли он штаммом. Потому что только в таком случае вы можете адаптировать клиническую практику. Здесь, в Австралии, у нас очень отличается протокол для работы с штаммом B.1.1.7 от протоколов для других штаммов. Включая методы карантина, уровень карантина и прочее. И это возможно, потому что здесь мы типируем каждый положительный образец. Как многие знают, тут у нас не так много положительных образцов, но тем не менее, только если мы типируем все образцы, только тогда мы можем адаптировать нашу клиническую практику.
Кристи Риск: Отлично. Я думаю, мы на этом закончим. Я хочу поблагодарить всех наших спикеров — Мартина Штюрмера, Томаса Алефа и Дэррила Ирвина — и нашего спонсора — Agena Bioscience. Спасибо, что посетили вебинар 360Dx.
Перевод:
Петр Казимиров








 Меню
Меню





 Все темы
Все темы







 0
0