Фармакогенетика выходит за рамки анализа ферментов метаболизма лекарств: мультигенный подход для предсказания ответа на препарат
Расшифровка вебинара 2019 года, который спонсировала компания Agena Bioscience. В ходе вебинара доктор Райан Сприсслер рассказал о том, как компания Geneticure разработала тест для определения наиболее подходящего препарата при гипертонии, какие преимущества есть у этого подхода в сравнении с классическими рекомендациями, привел результаты клинических испытаний и экономические оценки.

В настоящее время многочисленные исследования генетических изменений, отвечающих за метаболизм лекарственных средств, дают более подробную картину эффективности того или иного препарата. Такие исследования позволяют более точно предсказать положительный ответ пациента на терапию, ее безопасность и риск токсического воздействия. В некоторых странах перед тем, как назначить препарат, проводится генотипирование пациента и составляется его фармакогенетический паспорт. Более того, возможны варианты модуляции фармокодинамики и фармококинетки лекарственного средства для изменения чувствительности к жизненно важным лекарственным средствам. Такой подход — одно из наиболее эффективных и перспективных направлений развития персонализированной медицины. Он позволяет повысить продуктивность и безопасность фармакотерапии и увеличить продолжительность жизни множества пациентов. В нашей стране фармакогенетика находится в зачаточном состоянии и не утверждена на законодательном уровне. Однако на рынке молекулярно-генетических исследований уже появились частные предложения по изучению индивидуальной чувствительности к той или иной терапии.
Ниже мы приводим расшифровку вебинара 2019 года, который спонсировала компания Agena Bioscience. Она занимается разработкой и поставкой оборудования и реагентов для молекулярной диагностики. В ходе вебинара доктор Райан Сприсслер рассказал о том, как их компания Geneticure разработала тест для определения наиболее подходящего препарата при гипертонии, какие преимущества есть у этого подхода в сравнении с классическими рекомендациями, привел результаты клинических испытаний и экономические оценки.
Webinar: PGx Beyond Drug-Metabolizing Enzymes: A Multigene Approach to Predicting Drug Response from Agena Bioscience on Vimeo.
Кристи Риcк: Здравствуйте, меня зовут Кристи Риcк (Christie Rizk), я старший редактор в GenomeWeb, и сегодня я буду вашим модератором. Наш спонсор Agena Bioscience. Выступает сегодня доктор Райан Сприсслер (Ryan Sprissler), ведущий научный сотрудник генетического ЦКП для клинических служб Университета Аризоны (University of Arizona Genetics Core for clinical services), соучредитель и главный научный сотрудник Geneticure. По ходу вебинара вы можете задавать вопросы. Передаю слово доктору Сприсслеру.

Райан Сприсслер: Спасибо. Я хочу поблагодарить Agena за предоставленную мне возможность выступить сегодня. Я благодарен Agena также и за то, что они являются замечательными партнерами в развитии нашей технологии. Спасибо всем слушателям за ваше время. Сделаю небольшую ремарку: я работаю в Университете Аризоны, где руковожу ЦКП и являюсь одним из основателей Центра прикладной генетики и геномной медицины. Сегодня я буду выступать в качестве главного научного сотрудника и соучредителя компании Geneticure.
Как следует из названия вебинара, я расскажу о мультигенном подходе к прогнозированию терапевтического ответа, в частности —в контексте гипертонии. Я опишу нашу панель и алгоритм, которые мы используем, расскажу о нашей тестовой платформе и ее валидации. Затем — о клинических исследованиях, и приведу экономические оценки применения панели в области здравоохранения, после чего отвечу на вопросы слушателей.

Наша миссия — использовать генетику интегративной физиологии, чтобы отказаться от метода проб и ошибок в медицине. Термин немного суров. Многие из этих стандартных алгоритмов лечения используют данные популяционных исследований, для их разработки используются эпидемиологические данные. Но это очень далеко от того, чтобы лечить пациента как индивида. Это все имеет много аспектов, которые можно улучшить.

Поэтому мы выбрали иной подход, что также отражено в названии вебинара. Он не подразумевает отказ от панели для тестирования ферментов метаболизма лекарств (DME), которые используются в фармакогенетике. Важно знать, как лекарства усваиваются, как они попадают в кровоток. Но в нам также нужно знать мишени этих лекарств и эффективность. В том числе при сложных заболеваниях, таких, как гипертония, имеющих несколько стадий развития. В случае гипертонии есть классы препаратов, имеющих несколько мишеней. Поэтому имеет смысл использовать не только скрининг DME, но и некоторую информацию о работе каждой системы органов. Еще мы стараемся как можно лучше подтвердить работу подхода: последние несколько лет мы потратили на сбор клинических доказательств, публикацию данных и получение рецензий. Нам важно убедиться, что наши методы подкреплены базой. Кроме того, недавно мы получили патент на наш анализ гипертонии, в основном для защиты некоторых алгоритмов и самого процесса.

Рассмотрим гипертонию. Я не врач-клиницист, когда мы начали эту работу шесть-семь лет назад, я был шокирован тем, как ее лечат, особенно учитывая то, что примерно каждый третий американец страдает гипертонией. Это очень дорогое заболевание, и оно лечится методом проб и ошибок. Так что это хорошая возможность усовершенствовать лечение и снизить затраты.
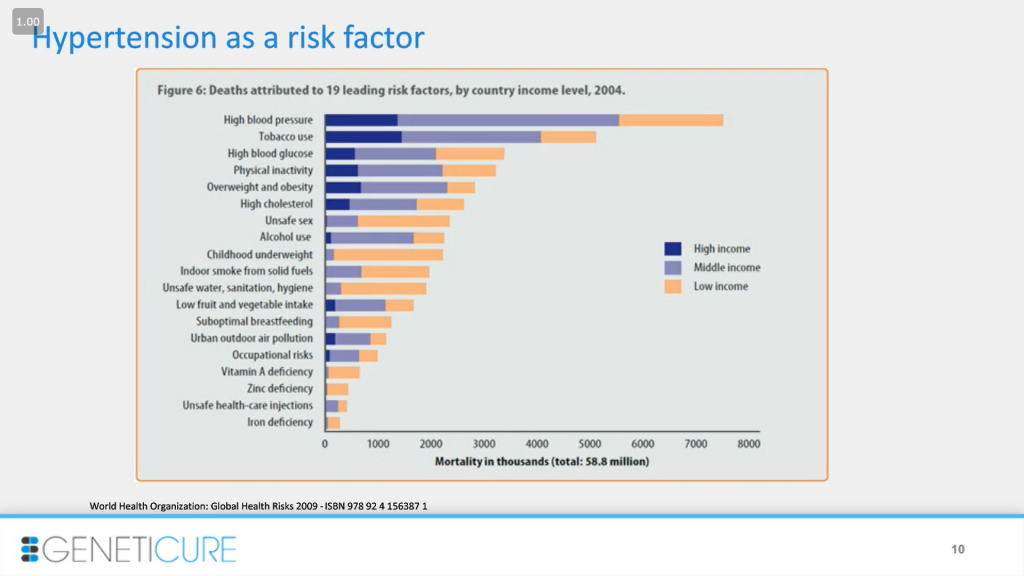
Гипертония – ведущий глобальный фактор риска смертности. Это не болезнь богатых, а болезнь бедных.

Хотя гипертония касается многих, она сильнее влияет на определенные группы населения. Так, показатели успешного лечения составляют 74%, 70% и 60% для белых, афроамериканцев и латиноамериканцев соответственно. Не ужасно, но и не хорошо. История становится гораздо хуже, если смотреть на уровни контроля заболевания: 43, 37 и 31% для этих популяций, соответственно, в этом конкретном исследовании. Эти данные связаны с использованием рекомендаций JNC-7 – объединенного национального комитета (Joint national committee-7). Сейчас используются стандарты JNC-8, и в результате наблюдаются улучшения уровня контроля до, скажем, 60, 50 и 40%. Это все равно плохо и требует изменений.
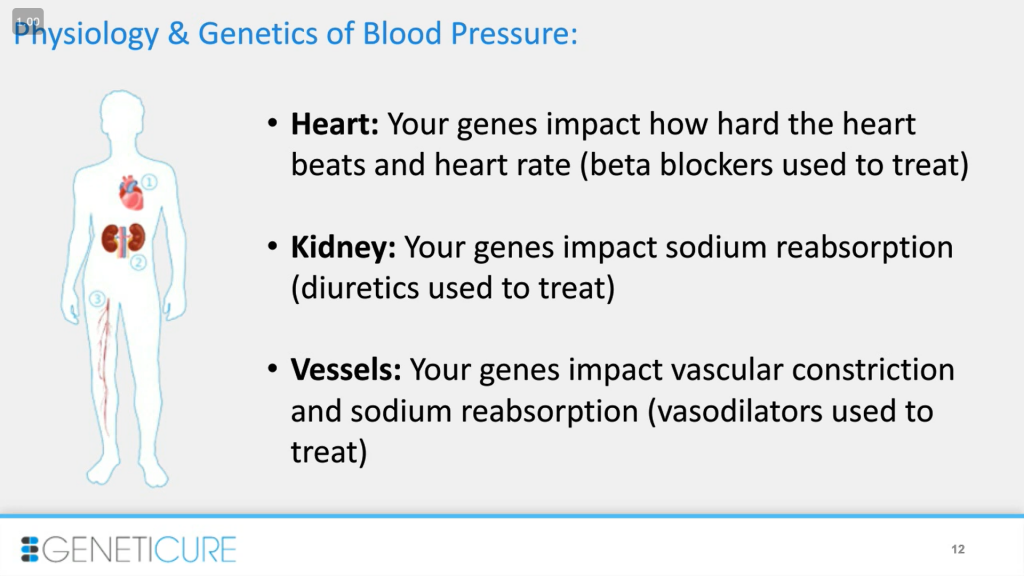
Что я имею в виду под подходом интегративной физиологии? Высокое кровяное давление – это симптом, который возникает по ряду причин. Любая из представленных систем органов может быть инициатором этой проблемы. Например, минутный объем кровообращения (сердечный выброс), который определяется тем, насколько сильно бьется сердце, сердечным ритмом. Гены влияют на это, а класс препаратов, которые используют для лечения этой системы, называется бета-блокаторы. В случае почек гены влияют на обмен натрия, тут используются мочегонные препараты. Также генетика определяет степень сужения сосудов, это явление лечится вазодилататорами. Таким образом, мы имеем дело с несколькими системами органов и несколькими классами лекарств.

В чем же проблема стандартов лечения кроме того, что они делают этого джентльмена несчастным? У нас есть стандартный алгоритм лечения, который в основном будет начинаться с монотерапии диуретиком (иногда вазодилататором). Далее идут наблюдения в течение трех месяцев, работает ли этот препарат. Если мочегонное не снижает кровяное давление, то пациента не снимают с диуретической терапии. Ему сверху назначают следующий класс лекарств, в случае приведенной схемы — вазодилататор, и ждут еще три месяца. Пациент принимает два препарата, с начала лечения проходит уже шесть месяцев, и если давление все еще не поддается контролю, добавляют третий класс — бета-блокаторы. И даже с тремя препаратами давление все равно может повышаться. В некоторых случаях цикл повторяется с корректировкой доз, но в большинстве случаев это разочаровывает пациентов. А повреждение органов происходит с того момента, как у пациента начинается гипертония, и в течение всего этого времени происходило повреждение, поскольку давление не нормализовалось. Также это наслаивание лекарств усложняет режим их приема, из-за чего многие его не соблюдают. У пациентов начинается фрустрация: «Мой доктор не знает, что он делает. Я принимаю кучу лекарств, и они не работают». И поэтому они вообще перестают принимать лекарства и посещать врача. Мы видим здесь серьезную проблему.
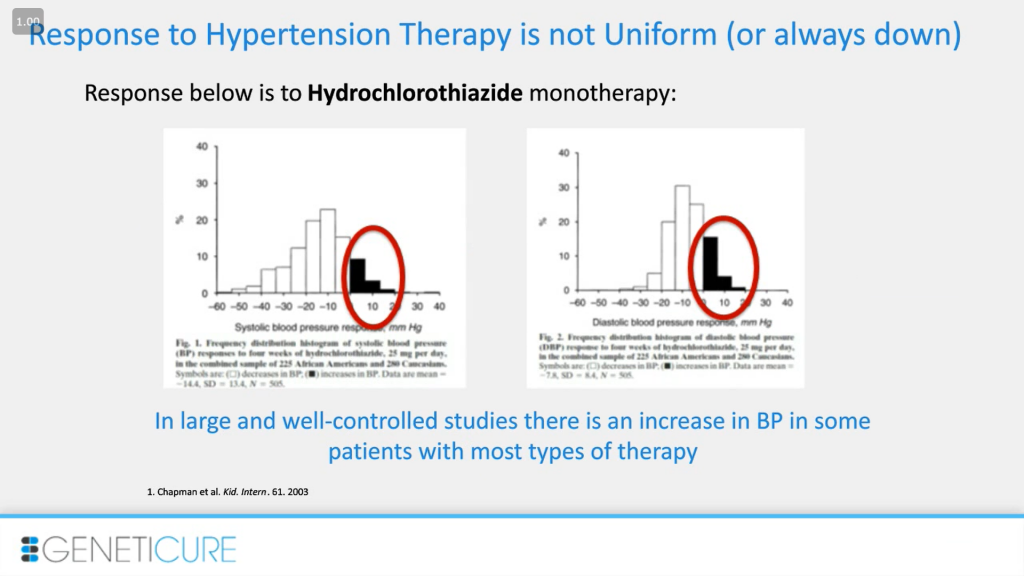
Считается, что эти лекарства довольно безопасны, они все одобрены. Но есть колоколообразная кривая, описывающая реакцию на эти препараты, которую, как мне кажется, недооценивают. Здесь представлен ответ на монотерапию гидрохлоротиазидом, это мочегонное средство. Не так плохо, чтобы считать препарат не неэффективным. Но в данном исследовании у 20% пациентов наблюдали повышение артериального давления. Так что, если лекарство не помогает, во многих случаях это имеет последствия, в некоторых случаях — делает хуже.
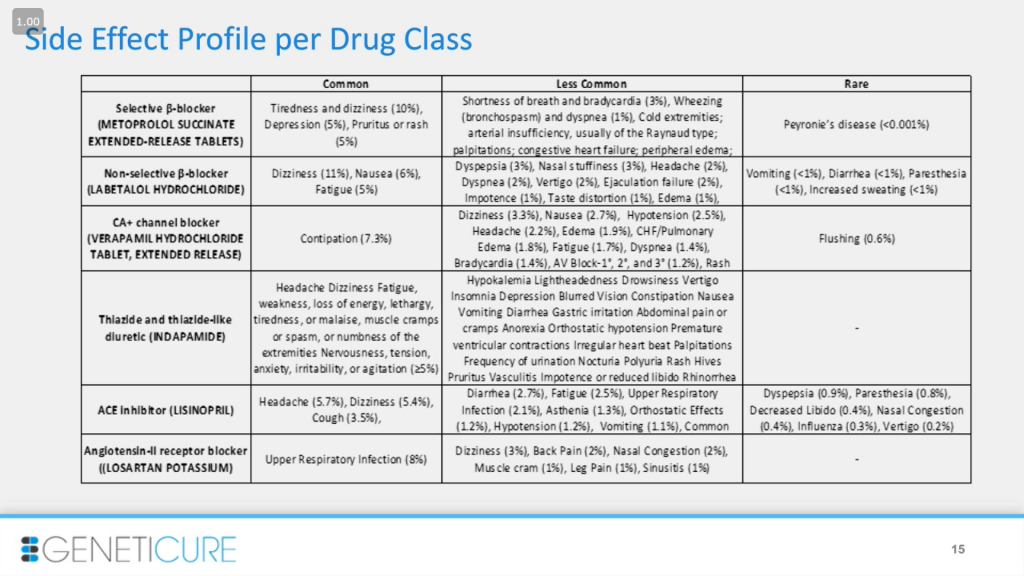
В случае с применением нескольких неэффективных препаратов у каждого из них есть ряд побочных эффектов. Препараты хорошие, одобренные, но есть последствия. Содержание таблицы не важно, она приведена для иллюстрации спектра побочных эффектов. Вы наверняка слышали аргумент: «Можно давать всем все лекарства, в чем тут проблема? Это не очень дорогие препараты». А проблема в сложности соблюдения схемы приема и побочных эффектах, которые тоже подрывают схему. Например, если пациент принимает ингибитор АПФ и у него начинается сухой кашель, он перестает принимать лекарство, даже если оно работает.

Стандарты лечения могут быть не только неэффективными, но и опасными. Есть несколько проблем. Так, средняя вероятность ответа на каждое лекарство составляет всего 50%. Терапия требует частого посещения врача. И для пациента, и для доктора было бы лучше, если число визитов было меньше. Опять же, наслоение неэффективных препаратов. Последний аспект, я не буду сильно углубляться: появляется все больше сообщений о долгосрочных побочных эффектах этих лекарств. И мы не хотим их получать, особенно если препараты не работают.

Каково решение этой проблемы? Метод тестирования гипертонии Geneticure, обзор которого представлен на слайде. Вверху справа показан набор для сбора образца буккального эпителия. Собранный образец с помощью маленького поршня вводится во флакон с лизис-буфером: на этом этапе мы лизируем клетки, чтобы их можно было отправить почтой в лабораторию, это довольно простой процесс. Итак, врач заказывает тест, проходит сбор, мы экстрагируем геномную ДНК, проводим ПЦР, делаем генотипирование, прогоняем через алгоритмы и составляем отчет, представленный справа. Он также достаточно прост, чтобы врачи могли быстро интерпретировать эту информацию и назначать лечение. Так, результаты некоторых тестов могут занимать 20 страниц, где есть много посторонней информации, которая не всегда актуальна. Мы постарались упростить отчет.

Метод должен служить инструментом для принятия решений, который клиницист может использовать для начала лечения или получения дополнительной информации о лечении. Врачи имеют больше данных о пациенте, чем мы: наличие сопутствующих заболеваний, диабетический статус, эпилепсии, прием других лекарств, которые могут взаимодействовать с нашей основной рекомендацией. Так, есть целый ряд причин, по которым рекомендованная нами терапия может не подходить для данного пациента. Окончательное решение принимает врач, и наш метод — инструмент для него.
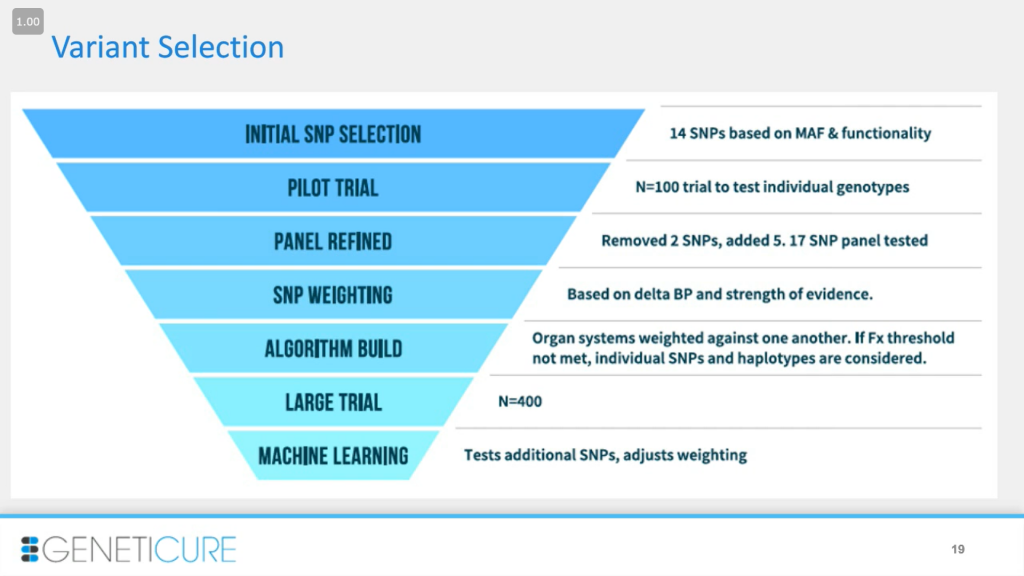
Как мы построили этот анализ? Это представлено на конусообразной схеме: мы начали с самого верха, с огромной части процесса — с первоначального выбора SNPs (однонуклеотидные полиморфизмы, single nucleotide polymorphisms) для анализа, который занял много времени. Он включал изучение литературы, клинических и доклинических исследований, рассмотрение животных моделей. Мы хотели найти конкретные варианты генов, которые ассоциировались с функционированием или специфическим ответом на терапию. Многие исследователи изучали один ген, один вариант и то, как он влияет на эти системы органов, на гипертонию, на ответ на терапию. Мы хотели не только объединить всю эту информацию, но и сократить количество вариантов. Для этого мы выбирали те, у которых частота минорного аллеля (MAF) была выше 10%, то есть встречающиеся в общей популяции, и которые функциональны. Мы не использовали редкие аллели, которые сложно выявить в клинике и для которых мало доказательств, хотя они могут иметь значительный вклад. Но мы забрасываем самую широкую сеть. Далее мы провели пробное исследование, чтобы проверить отдельные гены: какие работают, и мы их оставим, а какие — выбросим. Панель модифицировали и на этом этапе убрали два из исходных SNPs, потому что мы не видели доказательств их влияния на терапевтический ответ. Также добавили еще пять SNPs: между первым и третьим этапами прошло несколько лет, вышли новые исследования. В итоге панель содержала 17 SNPs.
Не все они одинаковы, поэтому мы оценили вес всех полиморфизмов по их влиянию на функциональность и доказательной базе. На основе этого построили алгоритм и сравнили системы органов друг с другом, чтобы можно было посмотреть на их функциональность и получить информацию о том, с какой начать лечение. Если для какой-либо системы не достигался порог, мы переходили к индивидуальным SNPs и гаплотипам. Далее мы ретроспективно тестировали этот алгоритм на большой популяции, про что я еще расскажу. После этого мы использовали машинное обучение и искусственный интеллект (ИИ), чтобы лучше настроить алгоритм.
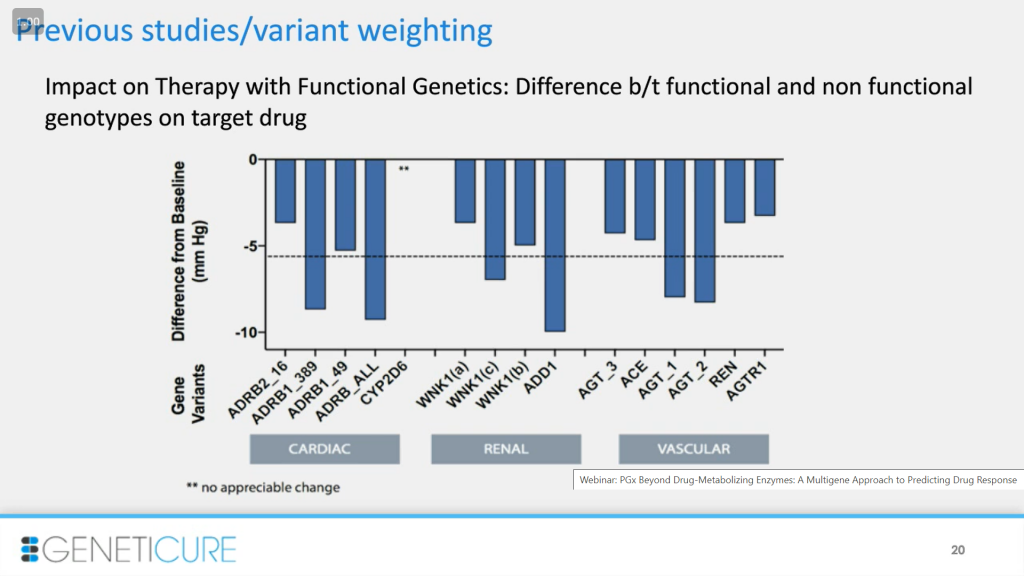
Первая часть этого процесса состояла в том, чтобы оценить вклад каждого отдельного варианта и убедиться, что мы выбрали правильные. Данные получены из предыдущих исследований, они вошли в процесс оценки. Мы рассматриваем разницу между индивидами, которые имеют функциональный и нефункциональный генотипы и находятся на целевом препарате. Например, слева в случае гена ADRB2 (бета-адренорецептор) с изменением в 16-й аминокислоте: у пациента с функциональным вариантом при приеме бета-блокатора падение давления всего на 4% больше, чем у индивида с нефункциональным. Так что не все варианты имеют одинаковый вклад: некоторые сильнее влияют на функциональность. А в случае с полиморфизмом в CYP2D6 при приеме препаратов разницы в давлении между группами нет.
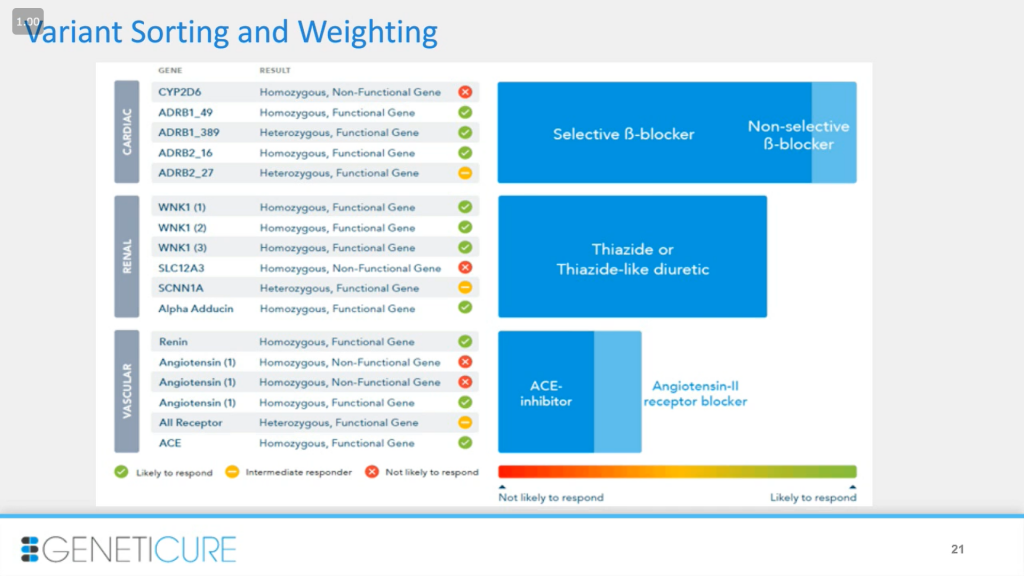
Далее мы отсортировали и оценили вес вариантов. Мы распределили их по система — сердце, почки и сосуды — и использовали генотип для оценки функциональности. Например, в случае с ADRB1_389 гетерозиготного варианта достаточно для значительного изменения ответа на препарат, для ADRB1_27 — изменение промежуточное. В некоторых случаях разницы в ответе не было. Так, мы имеем систему сигналов: красный, желтый и зеленый, чтобы оценить функциональность каждого варианта, которые объединены по системам органов. Затем, как показано справа на столбчатой диаграмме, мы используем эти данные, чтобы получить вероятность ответа на те или иные препараты. Так, мы сначала оценили вклад отдельных вариантов генов, а потом — вклад целой системы.
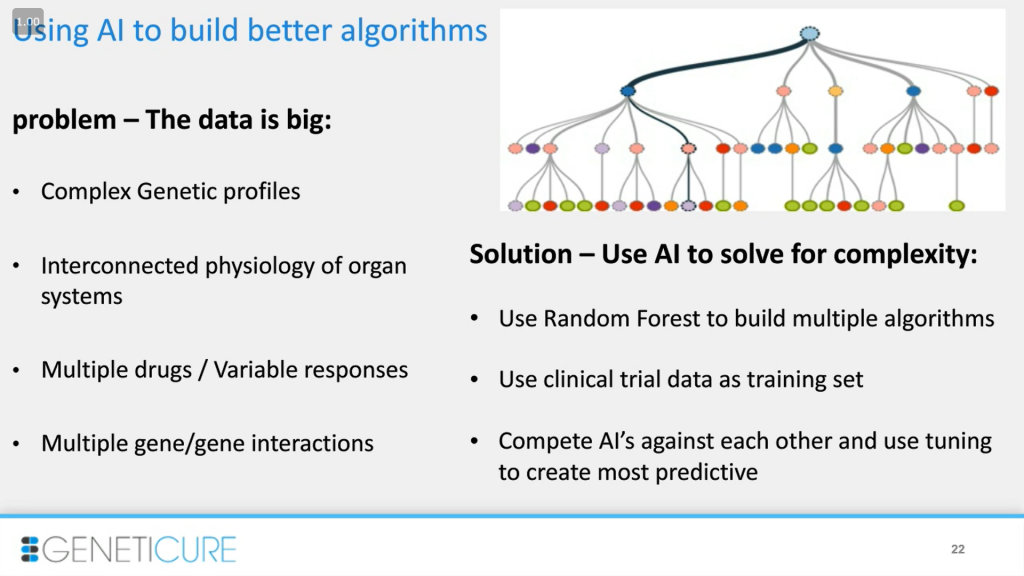
После этого мы использовали некоторые методы ИИ для решения следующих проблем: большое количество генотипов и взаимодействий генов, физиологическая взаимосвязь систем органов, множество препаратов и ответов на них. Например, в исследовании у пациента удается контролировать давление, мы проводим генотипирование и используем это как вводные данные. Так как мы анализировали данные вручную, с помощью ИИ мы хотели убедиться, что сделали все правильно и учли большую часть нюансов. Например, мы использовали алгоритм random forest («случайного леса») для классификации, где для обучения брали клинические данные: демографию, прописанные препараты, продолжительность их приема, изменения кровяного давления, возраст, рост, курение и так далее. Также мы добавили генотипы в обучение. После мы построили «среду» под кодовым названием «Thunderdome» чтобы посмотреть, какой из алгоритмов обладал наибольшей предсказательной силой.

Здесь представлены результаты. Мы получили 110 деревьев для случайных наборов из 6 генов и оценки достоверности. В крайней правой части таблицы показаны эти оценки для каждого класса препаратов. Так, у нас был способ оценки данных человеком, затем — машиной, которая стремилась к подобному результату. И алгоритмы подтверждали достоверность в большинстве случаев, то есть мы двигались в правильном направлении.

В итоге панель дает отчет, часть которого я уже показывал. В его верхней части указаны рекомендации разной силы. Хочу еще раз отметить, что мы не рекомендуем использовать какие-либо препараты, еще не одобренные для лечения гипертонии. Мы просто изменяем порядок в каждом случае в зависимости от генетической функциональности. Под каждой рекомендацией мы даем более подробное описание. Врачи также могут связаться с нами, если возникают вопросы.
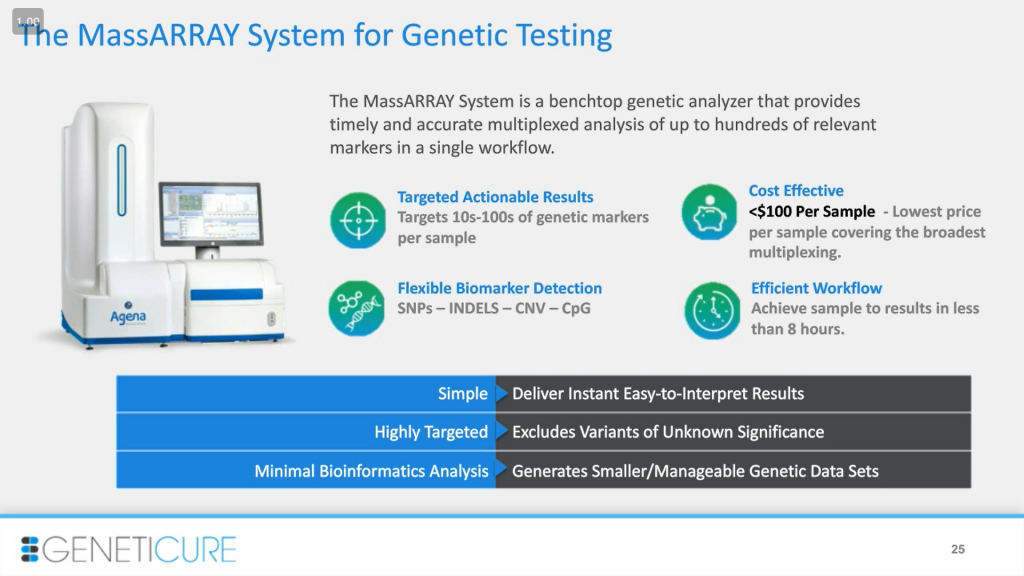
Сейчас мы обсудим платформу, а затем — клинические исследования. Система MassARRAY хорошо подошла для нашего анализа 17 генов. Мы хотели сделать его наиболее дешевым, пригодным для большого числа тестов с высоким соотношением сигнал-шум и сосредоточить его на функциональных и прогностических вариантах. Количество вариантов хорошо подошло для платформы MassARRAY, это позволило нам снизить затраты. Кроме SNPs у нас есть один индел в гене ACE: вставка примерно 280 нуклеотидов. Мы хотели совместить их все в одной платформе, а другие технологии не очень для этого подходят, в отличии от MassARRAY.
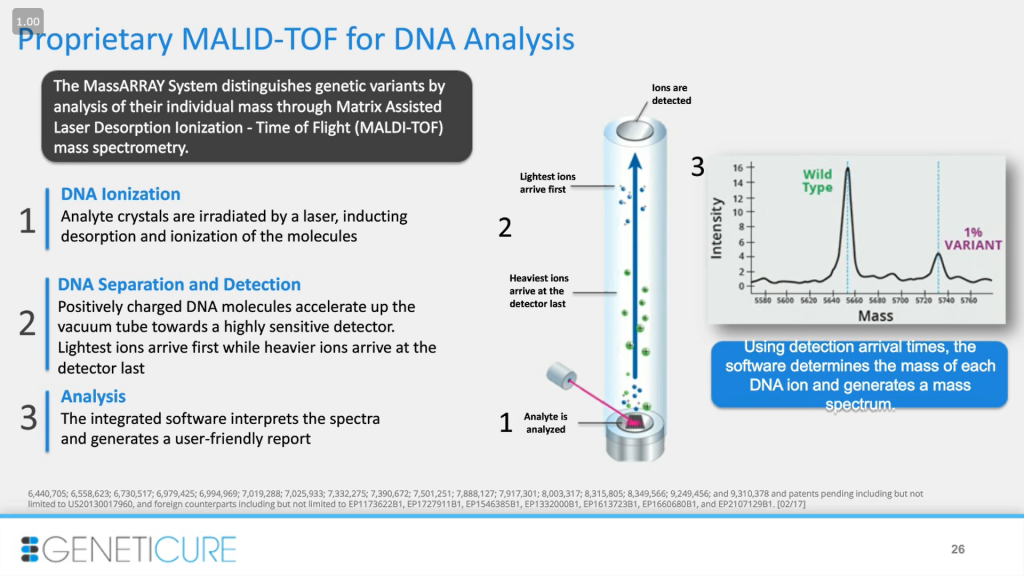
MassARRAY – эффективный инструмент генотипирования на основе массы фрагментов, основанный на технологии MALDI-TOF (времяпролетная матрично-активированная лазерная десорбция/ионизация, matrix-assisted laser desorption/ionization – Time of Flight). Первый шаг — мультиплексная ПЦР, где мы получаем сразу множество продуктов. Далее идет реакция удлинения: мы используем праймер вблизи от SNP, который удлиняется на один нуклеотид, соответствующий полиморфизму. Так как нуклеотиды имеют разную массу, мы определяем эту вставку с помощью MALDI-TOF. Таким образом, мы проводим генотипирование на основании массы.
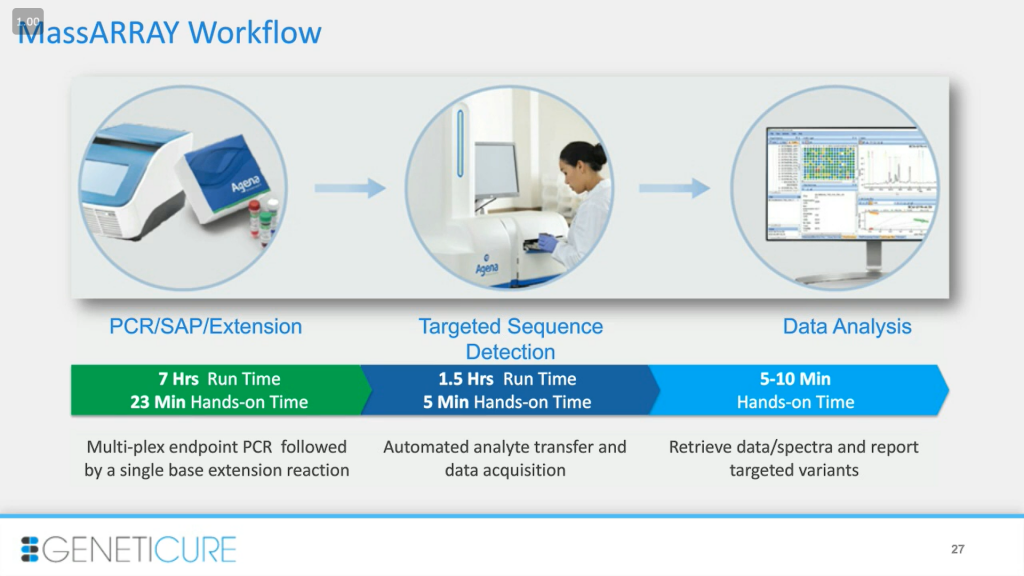
Эта технология также позволила нам сократить время получения результата. Сам анализ достаточно удобен: мы можем установить пороговые значения таким образом, что если результат соответствует этому порогу, то мы получаем высокую достоверность. Если нет, то можно провести второй запуск, и нам не нужно тратить время на разбор необработанных данных.

Здесь представлены результаты проведенной нами аналитической проверки. Столбцы соответствуют вариантам генов, которые мы тестируем, а строки — это 22 проанализированных клеточных линии. Мы хотели убедиться, что каждый вариант встречается крайней мере дважды и что мы можем достоверно их детектировать. А потом для верификации мы использовали на этих линиях другие технологии: генотипирование TaqMan, секвенирование по Сэнгеру. Так, мы провели много аналитических исследований, в том числе – с использованием реальных образцов.
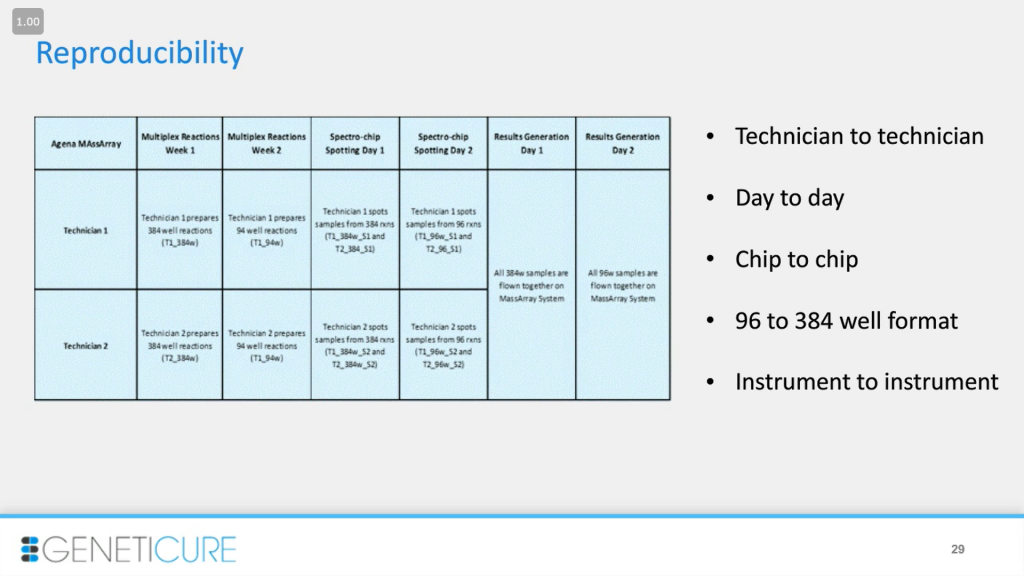
Воспроизводимость оказалась хорошей в случае разных работников, приборов, в разные дни и в разных форматах: при использовании 96- и 384-луночных систем, разных объемов. Анализ в любом случае был хорош.
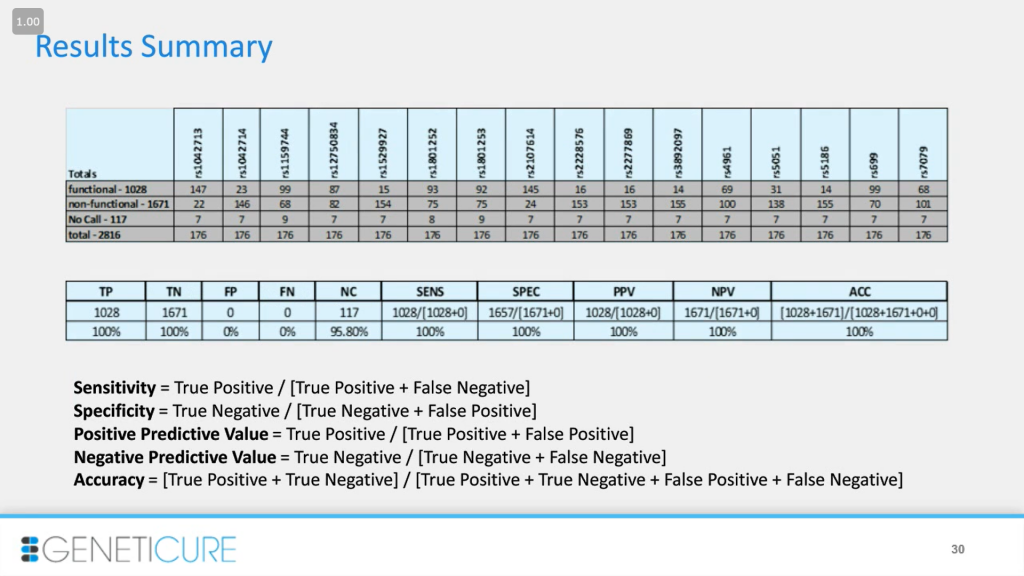
Вот некоторые из этих результатов. Мы протестировали 2816 генотипов и были довольны результатами: чувствительностью, специфичностью, прогностической ценностью и точностью. Уровень определения составил около 96%: в верхней таблице в разделе «no call» вы видите несколько семерок. Это значит, на выходе мы получаем не много неполных профилей, которые надо исправлять. Некоторые образцы были низкого качества, это связано с размером фрагментов или дизайном. Но в целом образец дает полный результат либо ничего, практически без неполных профилей.
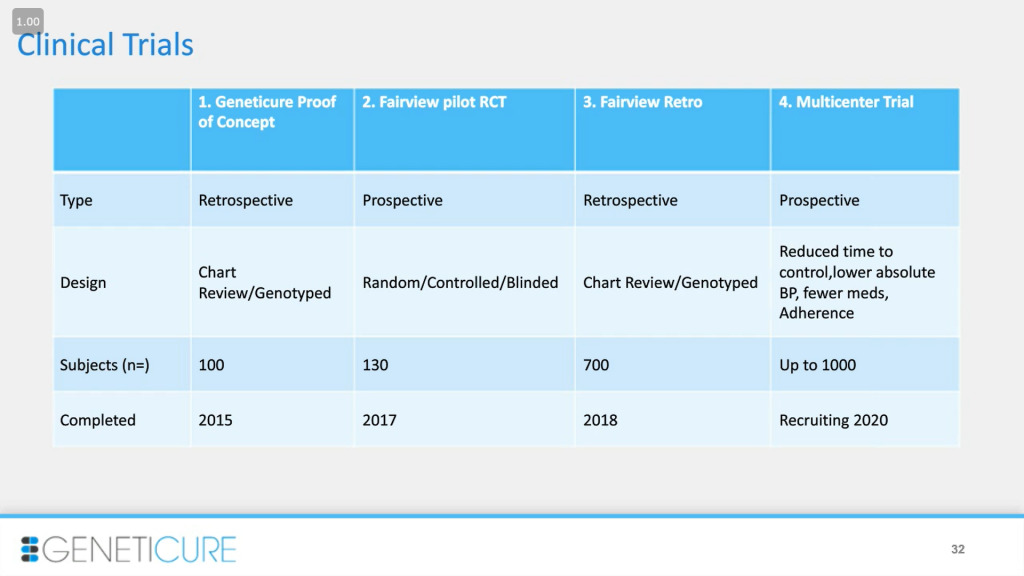
Сейчас я расскажу о наших клинических исследованиях. Если у вас будут конкретные вопросы, можно обратиться к уже опубликованным данным. Мы начали с небольшого ретроспективного исследования для доказательства эффективности методики. Здесь мы оценили вклад каждого исследуемого варианта. Далее мы провели пилотное рандомизированное контролируемое испытание (RCT) с нашими партнерами. Это была оценка качества, проспективное слепое исследование, где мы сравнивали результаты стандартных методов и генетических. Далее мы провели более крупное ретроспективное исследование с количеством объектов чуть меньше 400 (не 700 — опечатка на слайде. — PCR.news) для тестирования и настройки алгоритма. Сейчас мы разрабатываем еще более крупное проспективное исследование с участием нескольких центров и около 1000 пациентов. Это будет золотым стандартом для доказательства работы принципа. В каждом новом исследовании мы базируемся на результатах предыдущих и стремимся к конечным результатам, таким как снижение абсолютного значения артериального давления, сокращение времени, необходимого для установления контроля, использование меньшего количества препаратов и упрощения схемы приема.

На слайде показаны публикации. Я коснусь только некоторых результатов, основных моментов. Мы также изучили экономическую сторону подхода, о которой я упомяну.
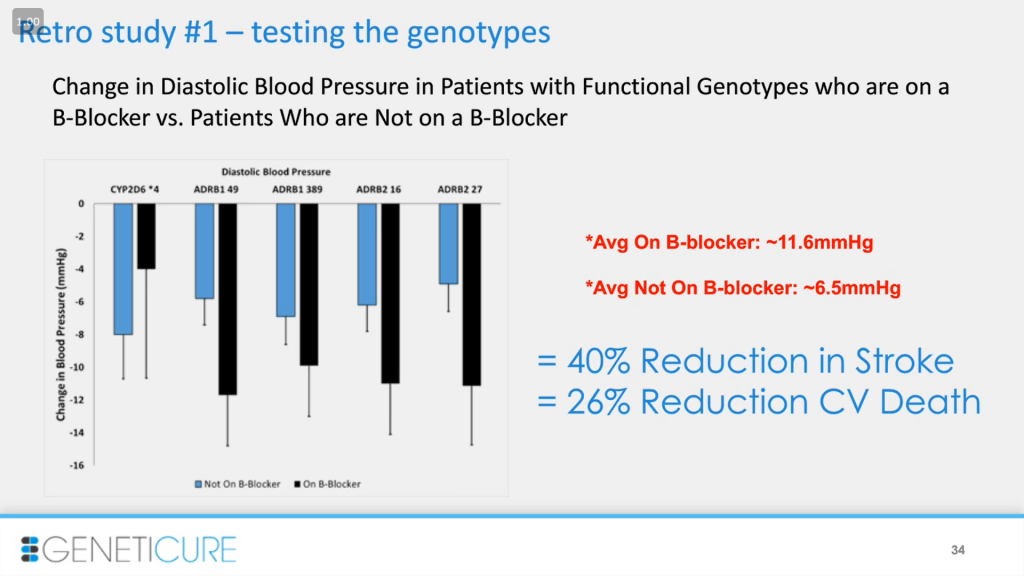
Наше первое ретроспективное исследование — доказательство работы концепции тестирования генотипов: правильно ли мы выбрали варианты. Здесь представлено изменение диастолического артериального давления у пациентов с функциональными генотипами, которые находятся на бета-блокаторах, в сравнении с изменениями у пациентов, которые их не принимают. Если не обращать внимание на CYP2D6, в случае ARDB1_49: есть два пациента, и давление в случае приема препарата падает сильнее у того, кто имеет функциональный вариант. Это и есть доказательство того, что мы выбрали правильные варианты для оценки. В данном случае при приеме бета-блокаторов диастолическое давление у пациентов с функциональными вариантами падает на 5 мм рт.ст. в сравнении с теми, кто не принимает препарат. Кажется, что это немного, но эпидемиологические исследования говорят, что снижение давления на 4-6 мм рт.ст. на 40% сокращает риск инсульта и на 26% — риск смертности из-за инфаркта.

В нашем втором пилотном RCT исследовании мы хотели убедиться, что соответствуем некоторым стандартным показателям и не отстаем от устоявшихся принципов. Что-то нам удалось лучше контролировать, но будет ли это работать через 6 месяцев? Результаты оказались хорошими. Стандартные методы в конце концов определяют нужное лекарство, но у них это хуже получается, чем у нас. Мы используем немного меньше препаратов при подборе. В случае стандартного подбора также наблюдалось больше серьезных побочных явлений — 70% от общего числа случаев побочных эффектов. Большинство из них были вызваны диуретиками, и некоторые требовали госпитализации. Это важно и с точки зрения экономики, так как побочные эффекты достаточно дорого лечить, поэтому сокращение затрат будет в том числе из-за снижения подобных случаев. Само исследование было небольшим, и мы собираемся получить больше информации в нашем более крупном предстоящем испытании.
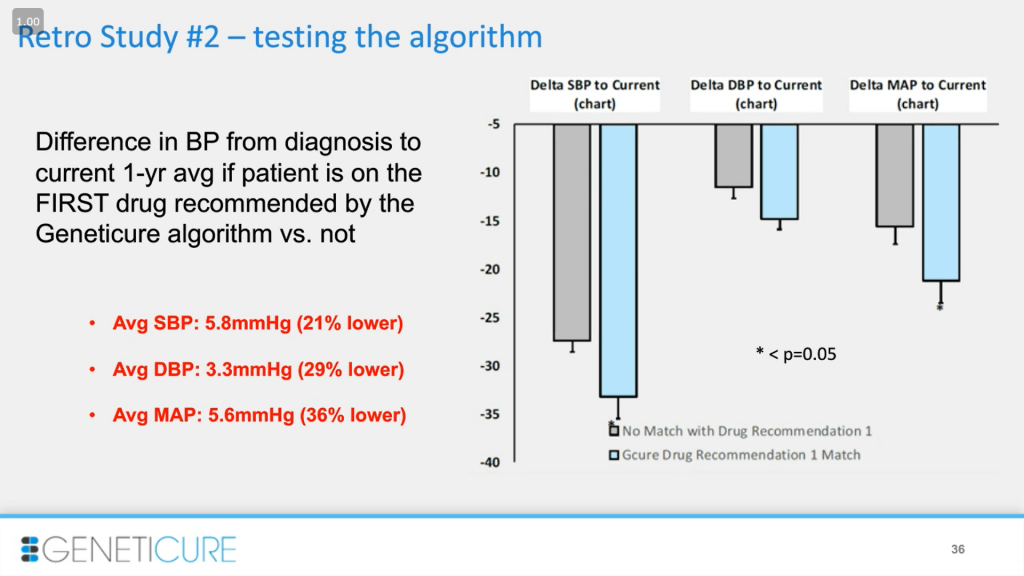
Третье исследование, которое было нашим вторым ретроспективным, также тестировало алгоритм: анализ давления у пациентов, год принимающих рекомендованный методом препарат. В правой части диаграммы — результаты сравнения среднего артериального давления (MAP): оно на 36% ниже у пациентов, принимающих первый препарат из рекомендации.
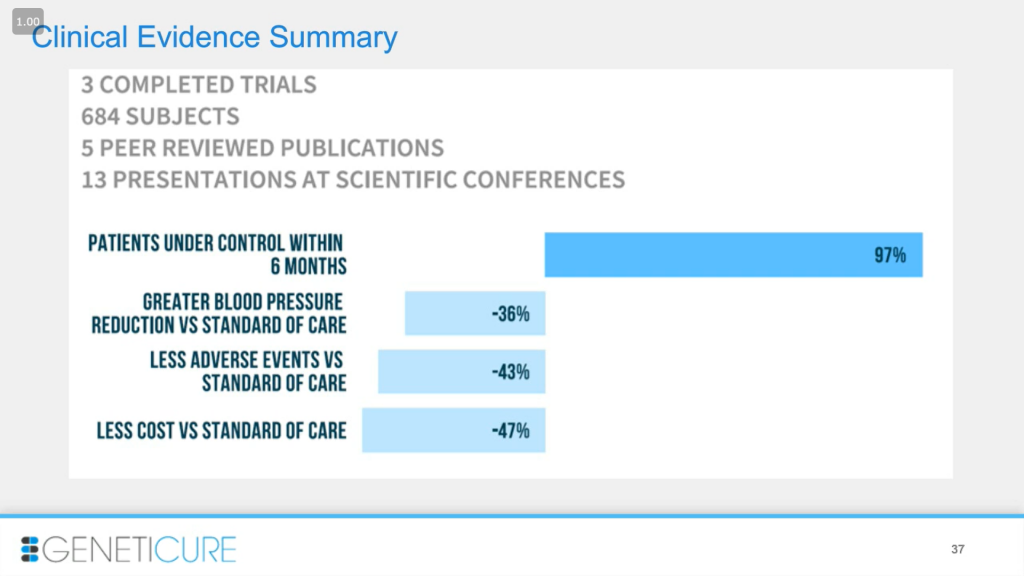
Чтобы подытожить полученные данные: мы провели три испытания, четвертое на подходе, чуть меньше 700 пациентов, публикации и доклады на конференциях. Контроль давления достигается в течение 6 месяцев, снижение кровяного давления на 30% по сравнению со стандартными рекомендациями, меньше побочных эффектов, сокращение расходов на 40%.
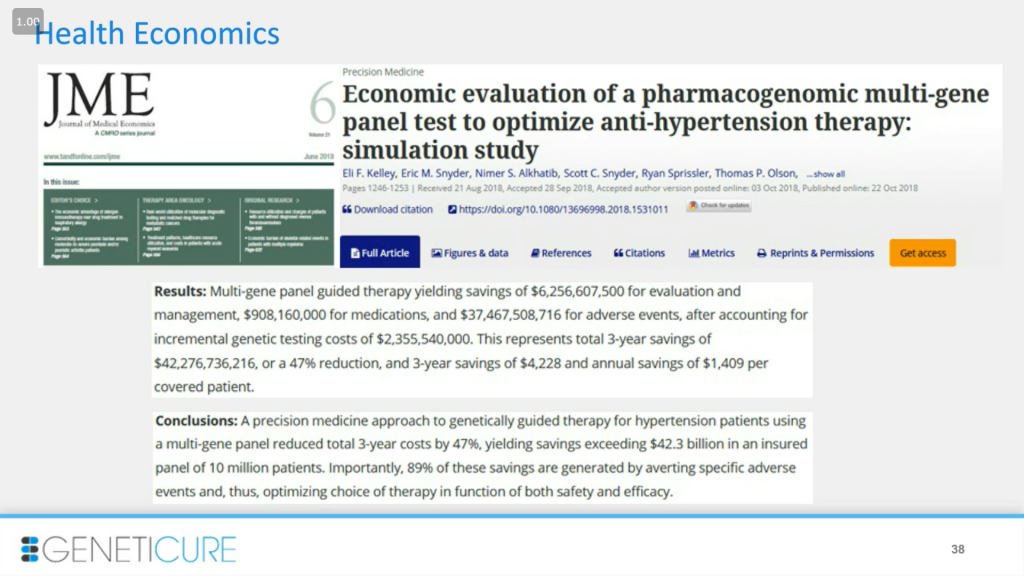
Экономическая сторона вопроса важна из-за количества людей с гипертонией в нашей стране. Так что небольшие изменения в стоимости лечения на одного пациента будут экстраполированы на огромные суммы. На слайде представлена наша публикация, мы провели моделирование на основании полученных клинических данных, чтобы приблизить модель к использованию нашего подхода в реальности. Так, в течение трех лет идет снижение затрат более чем на 40%, что составляет 42 миллиарда для выборки в 10 миллионов пациентов. Да, цифры гигантские именно из-за размера популяции с гипертонией.
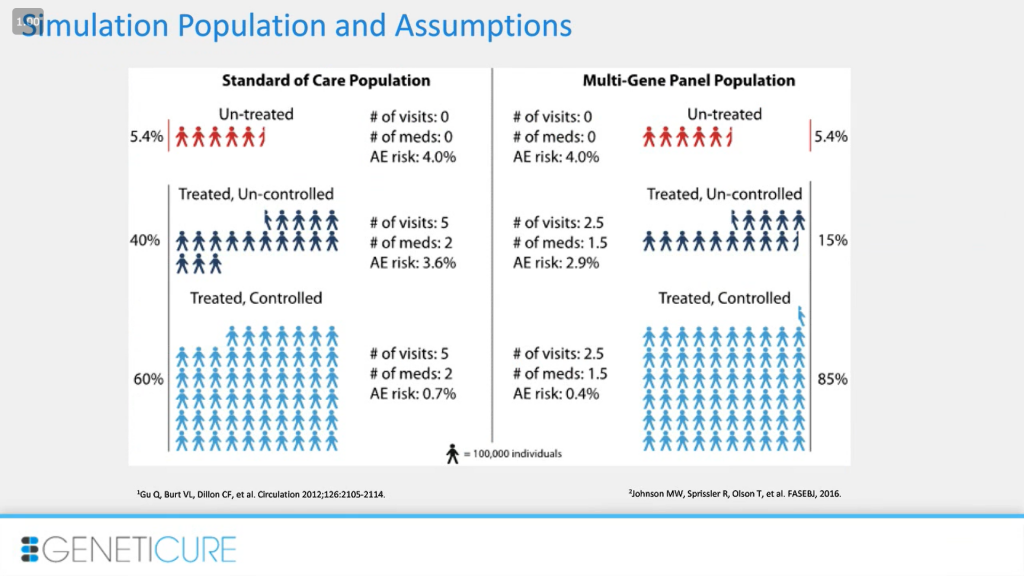
Мы также сделали некоторые общие предположения. Слева отражено реальное положение дел со стандартными рекомендациями: в среднем 5 посещений врача, 2 препарата, контроль достигается в 60% случаев, в 40%, находящихся на терапии, — нет. Правда, мы ничего пока не можем сделать с нелечеными 5,4%. Но, может быть, с увеличением количества подобных тестов и общей осознанности эти люди также начнут лечение. В наших предположениях мы были довольно консервативны (справа): контроль в 85%, в два раза меньше визитов, меньше препаратов в среднем.
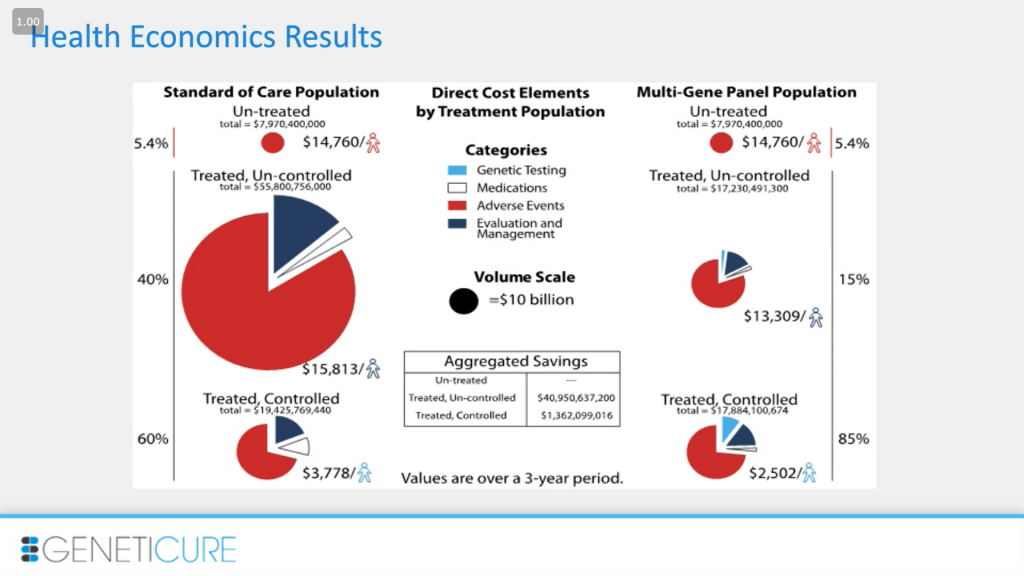
Что в конечном счете это дает. Экономия более 1 500 долларов в случае отдельных пациентов на лечении, не достигших стадии контроля, что суммарно – около 40 миллиардов долларов. Это очень впечатляет, особенно если учитывать, что изменения в подходе лечения незначительные. Сами генетические тесты стоят немного, так что это небольшие затраты, с одной стороны, и большой выигрыш — с другой.
Это часть нашей команды в Geneticure, многие из нас пришли из академической науки, большинство — из клиники Мэйо в Рочестере (Mayo Clinic). Эрик Снайдер (Eric Snyder), сооснователь, который гораздо дружелюбнее, чем можно предположить по фото, ведет много занятий в клинике, постдок в области нефрологии и гипертонии. Доктор Тим Карри (Timothy Curry) руководит программой медицинского образования в Центре персонализированной медицины клиники и является нашим медицинским директором. Том Олсон (Thomas Olson) также принимает пациентов в отделении профилактической кардиологии клиники. Один из наших соучредителей, Дэвид Герберт (David Herbert), управлял медицинскими лабораториями Майо, наверное, целую вечность. После ухода на пенсию он присоединился к нашей команде. Скотт Снайдер (Scott Snyder), наш бесстрашный лидер, который отвечает за бизнес-вопросы. Моника (Monica Akre) практически заставила нас, решала проблемы с соблюдением требований. Карл (Carl Jepsen) объединял наши усилия, чтобы убедиться, что все движется правильно. Робин (Robin Thomas) выполнил большую часть IT работы. Я благодарен этой команде, большая часть того, что я представил сегодня, — это продукт их усилий, а не моих.

Также я благодарен слушателям, вы можете связаться со мной по электронной почте. Дополнительная информация есть на нашем сайте: https://geneticure.com/.
Кристи Риcк: Спасибо, доктор Сприсслер, перейдем к вопросам: «Не могли бы вы сказать, в каких генах находятся 14 SNPs?»
Райан Сприсслер: Конечно, позвольте мне вернуться к слайду, где они показаны. CYP2D6 — цитохром P450 2D6, ADRB1 и 2 — это бета-адренорецепторы. WNK1 — ген киназы из семейства киназ «без лизина», SLC12A3 — ген симпортера ионов хлора и натрия, SCNN1A — альфа субъединица эпителиального натриевого канала, альфа-аддуцин — компонент цитоскелета. Также гены ренина, ангиотензина и ангиотензин-превращающего фермента (ACE).
Кристи Риcк: «Как вы учитывали прием препаратов, которые могли повлиять на реакцию на бета-блокаторы из-за ингибирования или индукции?»
Райан Сприсслер: Я молекулярщик, поэтому не могу ответить на этот вопрос. Многое было отражено в протоколах клинических испытаний, составленных медиками из нашей команды. Вы можете отправить этот вопрос по электронной почте, а я передам его коллегам.
Кристи Риcк: У нас есть несколько вопросов об одобрении проведения теста FDA: «Учитывая то, как FDA работает в сфере фармакогенетики, есть ли у вас одобрение, и если нет, то какие планы у вас есть, чтобы его получить?»
Райан Сприсслер: Я рад, что вы спросили. Мы согласны, что в этой сфере важно регулирование. Мы хотим собрать больше клинических доказательств и получить одобрение FDA, с которыми мы уже связались перед проведением проспективного исследования чтобы знать, какие результаты они хотят видеть. У нас хорошая лаборатория, мы проводим тесты различных уровней сложности. Наша главная цель состоит в том, чтобы генерировать доказательства, предоставлять их и позволять им говорить самим за себя.
Кристи Риcк: «Дало ли вам FDA какие-либо отзывы о вашем выборе SNPs и препаратов, которые вы рекомендуете?»
Райан Сприсслер: Не хочу вдаваться в подробности дискуссий, которые мы провели с ними. Мы не рекомендуем неодобренные препараты, а только уже используемые для лечения гипертонии, просто изменяем порядок рекомендаций.
Кристи Риcк: «Планируете ли вы модифицировать подход после будущих прорывов в области ИИ или новых научных открытий?»
Райан Сприсслер: Очень хороший вопрос. Мы не думаем, что это окончательный вид подхода. На самом деле, это уже его пятая версия, но в отношении содержания и доказательств — первая. Если мы что-либо добавим, придется заново провести все клинические исследования. Но да, будут новые версии. У нас есть ряд тестов для других заболеваний на стадии разработки. Мы как бы учимся тому, как добавлять или убирать компоненты анализа, как лучше его проверять и как собирать клинические доказательства для его подтверждения. Но да, безусловно, если можно будет добавить что-то значительное в алгоритм, что сильно поможет пациентам, мы все для этого сделаем.
Кристи Риcк: «Могут ли обычные люди заказать тест, и если да, то есть ли у вас онлайн консультации, чтобы помочь им с оценкой результатов?»
Райан Сприсслер: В настоящий момент мы так не делаем из-за особенностей регулирования. Есть такие тесты, где пациент заказывает сам, а результат приходит врачу. Но мы пока осторожны в том, что касается такого подхода. В нашем случае врач заказывает тест.
Кристи Риcк: «Не могли бы вы рассказать, как вы отправляете результаты пациентам, учитывая недавние действия FDA в отношении фармакогенетического тестирования?»
Райан Сприсслер: Конечно. Мы находимся только в начале процесса. Но сам отчет предназначен для врача, так что пациент получает результаты от него.
Кристи Риcк: «Вы работаете с какими-нибудь лабораториями или планируете для дальнейшего тестирования?»
Райан Сприсслер: Это LDT (тест, разработанный в лаборатории), который проводится только в наших условиях. Поэтому сейчас — пока нет. Но в перспективе — да, безусловно. Было бы здорово создать децентрализованную систему тестирования. Я бы хотел, чтобы этот анализ проводили в лабораториях молекулярной патологии по всей стране, в различных больницах и где-либо еще, где пациентам назначают лекарства от гипертонии.
Кристи Риcк: Спасибо, и на этом мы заканчиваем вебинар. Мы благодарим Райана Сприсслера за выступление и нашего спонсора Agena Bioscience.








 Меню
Меню





 Все темы
Все темы







 0
0