CAR-T клетки уничтожают опухоль эффективнее, если экспрессировать в них химерный вариант CTLA-4
CAR-T клетки, специфичные к CD19, — подход к лечению диффузной B-крупноклеточной лимфомы — обеспечивают долгосрочную ремиссию только у 40% пациентов. Ученые из Германии и США дополнили этот метод, экспрессировав в Т-клетках не только химерный антигенный рецептор, но и химерный рецептор контрольных точек (CCR). CCR получили на основе CTLA-4, превратив его из ингибитора в активатор T-клеток. Такая терапия показала повышенную эффективность на мышиных моделях по сравнению с обычной CAR-T терапией.
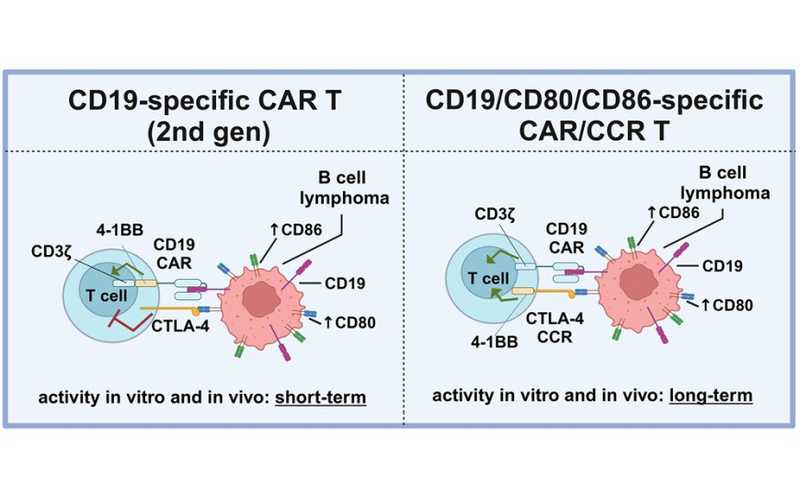
CAR T-клетки с химерным рецептором контрольных точек (CCR) дольше сохраняют активность in vitro и in vivo. CD19 CAR распознает опухолевый антиген и активирует Т-клетку, а CCR на основе CTLA-4 способствует этой активации, связываясь с CD80 на поверхности опухолевой клетки.
Credit:
Cell Reports Medicine (2024). DOI:
10.1016/j.xcrm.2024.101421 |
CC BY
CD19-специфичная CAR-T терапия показала свою эффективность при диффузных B-крупноклеточных лимфомах, однако только у 40% пациентов удается добиться долгосрочной ремиссии. Кроме того, такая терапия имеет ряд серьезных побочных эффектов, среди которых нейротоксичность и синдром высвобождения цитокинов. Перспективами обладает CAR-T терапия, комбинированная с ингибиторами контрольных точек иммунного ответа.
Немецкие и американские ученые обнаружили в диффузной B-крупноклеточной лимфоме повышенную экспрессию CD80/CD86. Это костимулирующие молекулы, которые взаимодействуют с CD28 на поверхности Т-клетки и приводят к ее активации. Ингибиторный рецептор CTLA-4 способен связываться с CD80/CD86 и блокировать активацию Т-клеточного противоракового иммунного ответа. Терапия ингибиторами контрольных точек иммунного ответа основана на использовании блокирующих антител к рецептору CTLA-4. Авторы исследования предложили ввести в CAR Т-клетки CCR — химерный рецептор контрольных точек. Для лечения диффузной B-крупноклеточной лимфомы они разработали терапию, нацеленную на CD19 и CD80/CD86.
Авторы работы сравнили, как экспрессируются CD80/CD86 в раковых клетках и в нормальных B-лимфоцитах. Оказалось, что экспрессия этих молекул повышена в образцах диффузной B-крупноклеточной лимфомы и в B-клетках, по сравнению со здоровыми донорами. Повышенная экспрессия наблюдалась как у пациентов, проходивших ранее терапию CAR-T клетками, так и не получавших такой терапии.
Разработанные исследователями CAR T-клетки экспрессировали CD19-специфичный химерный антигенный рецептор вместе с CCR. Химерный рецептор состоял из внеклеточного домена CTLA-4, слитого с костимулятором 4-1BB — такая конструкция аналогична той, что используется в составе CAR. Полученная молекула, связываясь с CD80/CD86, не ингибировала активность CAR T-клеток, а, напротив, стимулировала ее.
Для получения CAR/CCR клеток человеческие Т-клетки модифицировали с помощью ретровирусных векторов, кодирующих CAR/CCR. Эффективность трансдукции проверяли методом проточной цитометрии с использованием антител, специфичных к CD19-CAR и CTLA-4.
Для in vitro экспериментов использовали клеточные линии B-клеточных лимфом с разными уровнями экспрессии CD80 и CD86: высокий/высокий, высокий/низкий, низкий/высокий, низкий/низкий. CAR/CCR Т-клетки показывали цитолитическую активность при культивировании с клеточными линиями диффузной B-крупноклеточной лимфомы и лимфомы Беркитта. Эффективность лизиса раковых клеток была выше по сравнению с обычными CAR-T клетками.
In vivo эксперименты проводились на мышах, которым внутривенно вводили CD19+CD80highCD86high клетки Raji — культуры B-клеточной лимфомы Беркитта. Эти клетки экспрессировали люциферазу, которая позволяла отследить прогрессирование опухоли. Мыши были разделены на три группы и получали следующие Т-клетки: CD19-CAR/CTLA-4-CCR, CD19-CAR и немодифицированные Т-клетки. Наблюдение за динамикой опухоли продолжалось 71 день с начала терапии. Использование CAR/CCR Т-клеток привело к исчезновению опухоли и полной ремиссии у 5 из 6 животных. Терапия CD19-CAR T-клетками вызвала полную ремиссию только у 3 из 8 мышей.
Терапия CAR/CCR T-клетками может быть эффективна в отношении рецидивов B-клеточных лимфом после обычной CAR-T терапии. Все мыши с рецидивом опухоли, получавшие CD19-CAR T-клетки в качестве второй линии терапии, погибли в течение 21 дня. Однако 2 из 5 мышей, получавших CAR/CCR T-клетки, были живы на 63 день.
Клеточная терапия с использованием CAR/CCR T-клеток представляет собой многообещающий подход в лечении В-клеточных лимфом. Авторы исследования планируют проверить эффективность предложенной терапии в клинических испытаниях.
Цитоплазматический «хвост» из CTLA-4 повышает эффективность CAR-T клеток
Источник
Prinz LF, et al. An anti-CD19/CTLA-4 switch improves efficacy and selectivity of CAR T cells targeting CD80/86-upregulated DLBCL // Cell Rep Med. 2024. DOI: 10.1016/j.xcrm.2024.101421


 Меню
Меню





 Все темы
Все темы




 0
0








