Эволюция со скоростью света: как ИИ помог «разогнать» фотосинтез
Фотосинтез, при всей его важности и распространенности, сложно назвать эффективным. Предпринималось много попыток улучшить его природные механизмы. Группа под руководством исследователей из Киото (Япония) подошла к задаче по-своему — вместо оптимизации существующих систем ученые решили создать простой и надежный механизм «с нуля». С помощью алгоритмов искусственного интеллекта они спроектировали небольшой белковый комплекс, использующий энергию света для фиксации CO2. Дрожжи, экспрессирующие такой комплекс, активно фиксировали CO2 на свету и оказались способны выжить в безуглеводной среде. Авторы подчеркивают, что благодаря ИИ становится возможным переписывать природные механизмы, сохраняя их биологический смысл, но устраняя недостатки, снижающие эффективность и надежность.
Ernesto Del Aguila III, NHGRI/NIH | Public Domain
Растущий спрос на продовольствие, климатические и экологические перемены, стремление осваивать космос и производить пищу за пределами нашей планеты — все это подталкивает к необходимости дальнейшего развития биотехнологий, применимых в аграрной и пищевой промышленности. Производство продуктов питания ограничивается фотосинтезом, который трудно назвать высокоэффективным процессом — растения утилизируют только около 1% энергии солнечного света. Лимитирующей стадией природного фотосинтеза, как известно, служит фиксация CO2, которая катализируется рибулозо-1,5-бисфосфаткарбоксилазой — рубиско. Попыток ответить на вопрос, как же обойти это ограничение, было сделано немало, от разнообразных вмешательств в работу рубиско культурных растений до систем искусственного фотосинтеза (и некоторые из них даже не требуют солнечного света). Ученые из Японии решили de novo создать машинерию для эффективного фотосинтеза, применив для этого достижения искусственного интеллекта.
Исследователи задались целью создать белковый комплекс, способный к эффективной фиксации углерода с использованием энергии света и легко экспрессируемый в различных эукариотических клетках. В качестве фотопоглощающего элемента авторы работы выбрали LOV-домены (light-oxygen-voltage sensing domains), встречающиеся в фототропинах и некоторых других светочувствительных белках. Поглощение света заставляет домен изменить конформацию и образовать ковалентную связь с флавинмононуклеотидом (FMN) в его составе. Однако как использовать энергию этого конформационного изменения для фиксации углерода? Решением стала пьезоэлектрика.
Некоторые природные белки (например, белки паутины или крючки жгутиков бактерий) обладают пьезоэлектрическими свойствами и способны создавать электрическое поле за счет механического напряжения. Поэтому разработку дополнили пьезоэлектрическим пептидом, сшитым с LOV-доменом. По результатам компьютерного моделирования, такая конструкция должна была генерировать локальное электрическое поле напряженностью до 50 мВ.
Следующим этапом работы стала оценка работоспособности системы in vitro. Ученые внедрили два варианта пьезоэлектрического пептида в LOV-домен, после чего измерили напряженность электрических полей, возникающих в ответ на освещение. Оба конструкта показали сопоставимую конверсию энергии поглощаемого света в электрическую.
Сам фермент фиксации углерода они создали при помощи компьютерного моделирования, сгенерировав аминокислотную последовательность алгоритмами RFdiffusion.
Одна из характеристик фотосинтеза высших растений, которой ученые «пожертвовали» — это использование АТФ для фиксации CO2. Вместо него сконструированный фермент использовал энергию электрического поля напрямую, затрачивая локальный потенциал на формирование ковалентной связи между молекулами субстрата. В качестве субстрата авторы выбрали гликоальдегидфосфат — двухуглеродное соединение, в небольших количествах присутствующее в клетке.
Анализ трехмерной структуры белка с помощью криоэлектронной микроскопии подтвердил соответствие компьютерной модели. Согласно изначальному моделированию и структурным данным, механизм карбоксилирования действительно основан на преобразовании напряженности поля в химическую связь. Локальное электрическое поле в активном сайте карбоксилазы, связавшей CO₂, поляризует молекулу и увеличивает ее электрофильность. В таких условиях гликоальдегидфосфат может атаковать CO₂ с образованием глицеральдегид-3-фосфата — хорошо известного продукта цикла Кальвина.
Авторы отмечают ограничение работы — субстрат, используемый для фиксации CO2, обнаруживается в клетках в довольно малом количестве. Впрочем, руководитель исследования видит в этом недостатке возможность: «Помимо контроля сборки нашей молекулярной машины, который позволил бы регулировать интенсивность фотосинтеза, мы можем управлять этим и через биохимию самой клетки, — объясняет профессор Таичи Сиратори из Института нейровычислительных технологий в Киото. — Использовать редкое соединение для такого активного процесса, как фотосинтез, кажется неинтуитивным на первый взгляд, но именно эта редкость может позволить человеку вмешаться в процесс при необходимости».
Отобрав несколько кандидатов из предложенных алгоритмом белков, исследователи получили их в очищенном виде и протестировали в бесклеточной системе. Скорость фиксации CO₂ измеряли при помощи ¹⁴C-изотопного мечения. Наилучший показатель составил около 4,9 мкмоль/мин/мг белка (против 1,7–2,1 у рубиско в аналогичных условиях), и для дальнейшей работы ученые выбрали его.
Чтобы убедиться в применимости разработанной системы искусственного фотосинтеза, ученые экспрессировали потенциалчувствительную карбоксилазу и LOV-пьезоэлектрические сенсоры в клетках дрожжей Saccharomyces cerevisiae. Для обеспечения передачи энергии белки соединили пептидными линкерами различной длины (всего было протестировано 26 вариантов). В трех вариантах ученым удалось подтвердить синтез ¹⁴C-меченного глицеральдегид-3-фосфата на свету, в остальных случаях итоговые конструкты не обеспечивали достаточный выход целевого продукта или плохо экспрессировались. Эффективность процесса резко падала в темноте, подтверждая активную роль пьезоэлектрического фотосенсора в работе данной системы.
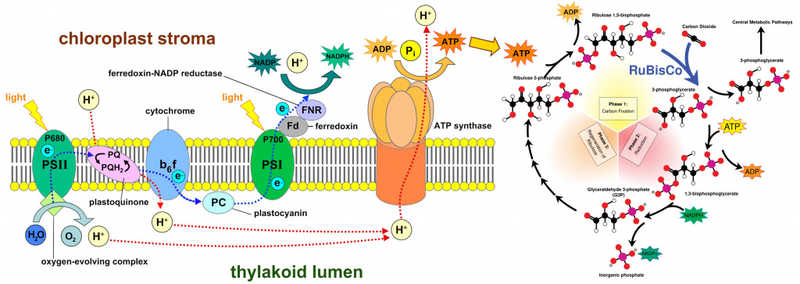 Принцип использования энергии света в классическом C3-фотосинтезе, который характерен для большинства высших растений.
Принцип использования энергии света в классическом C3-фотосинтезе, который характерен для большинства высших растений.Credit:
www.wikimedia.org (с изменениями)
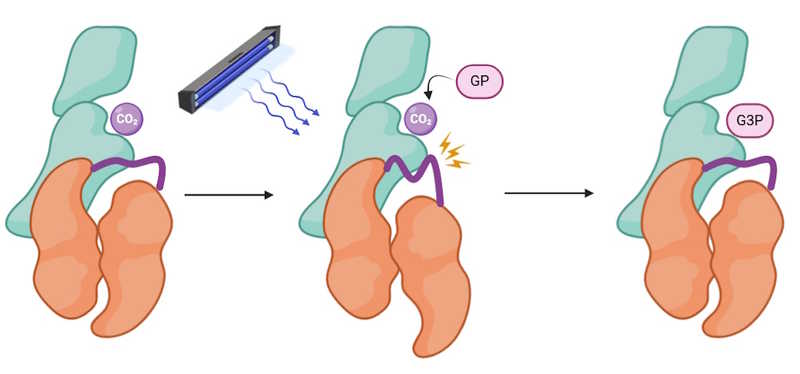 Альтернатива природным системам фотосинтеза содержит гораздо меньше компонентов. Обозначения: GP — гликоальдегидфосфат, G3P — глицеральдегид-3-фосфат.
Альтернатива природным системам фотосинтеза содержит гораздо меньше компонентов. Обозначения: GP — гликоальдегидфосфат, G3P — глицеральдегид-3-фосфат.Credit:
Synthetic Metabolism and Biohybrid Engineering (2025). DOI: 10.1124/synmbioeng.2024.73j3k
Наконец, ученые решили дополнительно «усилить» разработанную машинерию фотосинтеза, объединив отдельные конструкты в крупные белковые комплексы. Для этого в последовательность потенциалчувствительной карбоксилазы, слитой с LOV-пьезоэлектрическим белком, внесли небольшие петлевые домены, которые, по данным моделирования, должны были обеспечить взаимное и специфичное узнавание молекул. Благодаря этой модификации сконструированные ферменты действительно собирались в клетке в многодоменные белковые гранулы.
Ученые дали этим гранулам название «хикасомы» (от hikari — «свет» на японском). Сборка белковых фотосинтетических комплексов позволила еще увеличить эффективность фиксации углерода.
Одним из важных преимуществ разработки стали небольшой размер белковых компонентов и их малое количество — такую систему гораздо легче доставлять в клетки и экспрессировать, чем все ключевые компоненты хлоропластов. «Идея состояла в том, чтобы получить систему из ограниченного числа компонентов, — комментирует профессор Сиратори. — При всем уважении к эволюции, она неспособна направленно оптимизировать получившиеся системы так, как это можем сделать мы при помощи искусственного интеллекта, без достижений которого подобная разработка была бы невозможна. Наша же цель состояла в том, чтобы сохранить саму концепцию фотосинтеза, зародившуюся так давно, и облечь ее в простую и изящную систему, лишенную множества необходимых на тот момент, но избыточных сейчас компонентов».
Источник
Takahashi, Y., et al. A light-driven piezoelectric enzyme for ATP-independent CO₂ fixation in synthetic yeast systems. // Synthetic Metabolism and Biohybrid Engineering (2025). Published April 1st. DOI: 10.1124/synmbioeng.2024.73j3k


 Меню
Меню





 Все темы
Все темы



 0
0