Состоящие из D-аминокислот монотела селективно связываются с человеческим белком
Синтетические белки, построенные из D-аминокислот, — перспективный инструмент для исследований и терапии, так как они стабильнее L-аминокислотных белков и неиммуногенны. Ученые из Германии и США синтезировали D-монотела (миметики антител) и показали, что их можно специфично нацелить на онкогенную тирозинкиназу в клетках человека.
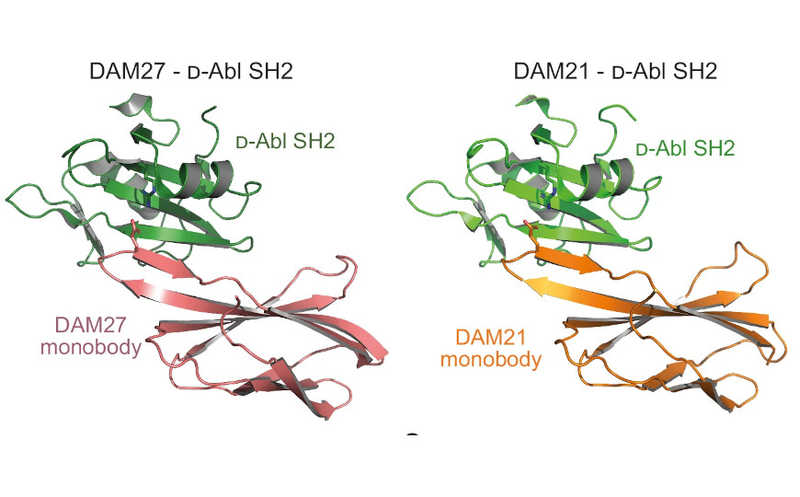
Структура D-варианта SH2-домена онкогенной киназы с монотелами DAM27 и DAM21. Пока что монотела состоят из L-аминокислот — это промежуточный этап создания D-варианта связывающего белка.
Credit:
Nature Communications (2024). DOI:
10.1038/s41467-024-54901-y |
CC BY
Все белки на Земле построены на основе L-аминокислот. Именно это делает привлекательными для синтетической биологии «зеркальные» белки, состоящие из D-аминокислот — за счет противоположной хиральности они будут стабильны в организме и неиммуногенны. В Nature Communications вышла статья, авторы которой получили «зеркальные» монотела для связывания онкогенной тирозинкиназы.
Монотела — разновидность синтетических связывающих белков, не содержащих иммуноглобулинового скаффолда. Это небольшие (около 90 аминокислотных остатков) белки, которые удобно получать химическим синтезом. После синтеза пептидов из D-аминокислот их лигируют в требуемую последовательность и проводят рефолдинг — так получают целевой D-аминокислотный белок в нужной конфигурации. Аффинность полученных вариантов проверяют и оптимизируют с помощью зеркального фагового дисплея.
Первым делом авторы работы получили D-вариант SH2-домена человеческой тирозинкиназы BCR::ABL1 — гибридного белка, отвечающего за онкогенную трансформацию клеток. С помощью фагового дисплея они отобрали L-монотела, специфичные к этому «зеркальному» домену.
Два наиболее оптимальных монотела ученые использовали для того, чтобы определить структурные основы распознавания D- и L-белковых структур. Они получили кристаллические структуры комплексов монотело-SH2. В обеих структурах D-аминокислотный SH2 домен формировал димеры через дисульфидный мостик. Ключевую роль со стороны монотела играла FG-петля, которая формировала β-складчатую структуру, взаимодействующая с β-структурами D-SH2. Связывание стабилизировалось ионными взаимодействиями между остатками глутамата и аргинина в составе белков.
Для каждого из двух монотел авторы оптимизировали путь синтеза его зеркального двойника. Полученные структуры — D-DAM21 и D-DAM27 — оказались способны связывать природный вариант SH2-домена тирозинкиназы (L-BCR::ABL1) c высокой селективностью. Механизм их взаимодействия подтвердили, анализируя кристаллические структуры комплексов. Затем связывание D-монотел с полноразмерной тирозинкиназой проверили в клеточных лизатах и на пермеабилизованных клетках.
Исследователи получили лизаты клеток K562 — распространенной линии хронического миелоидного лейкоза, экспрессирующей BCR::ABL1. Биотинилированные L- и D-варианты монотел добавляли к лизатам, после чего проводили количественный протеомный анализ связанных белков. Оба D-монотела селективно связывали целевой онкогенный белок, причем делали это эффективнее, чем их L-двойники.
Наконец, взаимодействие D-монотел с мишенью внутри клетки подтвердили с помощью сортировки флуоресцентно-активированных клеток (FACS). Пермеабилизованные клетки K562 обрабатывали монотелами, свыязывание которых отслеживали по изменению флуоресцентного сигнала. Даже без оптимизации параметров анализа было очевидно, что D-монотела связывали BCR::ABL1 намного сильнее, чем L-монотела или аллостерический ингибитор AS25.
Таким образом, исследователи продемонстрировали не только концептуальную перспективность, но и применимость синтетических «зеркальных» белков. Однако узкое место такого подхода — многоэтапность и трудоемкость. Необходимо синтезировать как мишень, так и связывающий ее белок в D-конфигурации. Исследователи убеждены, что для прогресса в этом направлении необходимо воспроизводить «зеркальные» биологические молекулы и их комплексы, чтобы в конечном счете создать самовоспроизводящуюся «зеркальную» систему экспрессии. (О рисках создания клеток с иной хиральностью недавно рассуждали авторы публикации в Science — подробнее об их взглядах и опасениях читайте на PCR.NEWS).
Источник
Schmidt, N., et al. Development of mirror-image monobodies targeting the oncogenic BCR::ABL1 kinase. // Nat Commun 15, 10724 (2024). DOI: 10.1038/s41467-024-54901-y


 Меню
Меню





 Все темы
Все темы



 0
0