Генная терапия подсвечивает раковые клетки и убивает в них митохондрии
Исследователи из США предложили новый подход к генной терапии опухолей — митохондриальную люминоптогенетику (mLumiOpto). В опухолевые клетки избирательно доставляется ген светочувствительного каналородопсина и ген нанолюциферазы, излучающей синий свет. Каналородопсин встраивается во внутреннюю мембрану митохондрий, активируется светом и вызывает протонный ток, что приводит к деполяризации мембраны, гибели митохондрий и апоптозу клетки. В экспериментах на мышах mLumiOpto уменьшила размеры опухолей мозга и молочной железы.
Cancer Research. 2024. 84 (23): 4049–4065. DOI: 10.1158/0008-5472.CAN-24-0984 | CC BY-NC-ND 4.0
Митохондрии — не только «энергетические станции клетки», но и регуляторы ключевых процессов, необходимых для роста и функционирования клетки. Команда из университетов штатов Огайо и Алабама разработала новый подход к генной терапии, нацеленной на митохондрии раковых клеток. Свою технологию они назвали «митохондриальной люминоптогенетикой» (mitochondrial luminoptogenetics, mLumiOpto). Этот подход приводит к деполяризации внутренней мембраны митохондрий и вызывает гибель раковых клеток.
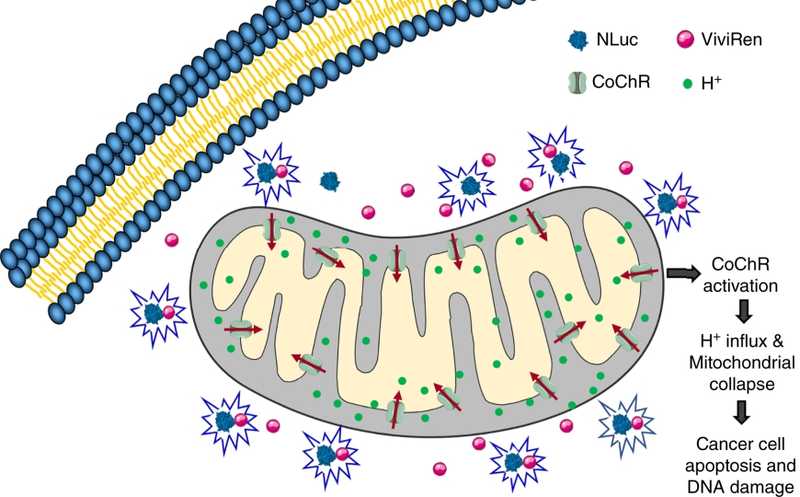
Терапия вызывает продукцию во внутренней мембране катионного каналородопсина — ионного канала, который под воздействием синего света индуцирует ток ионов. Голубой свет обеспечивает нанолюфицераза — биолюминесцентный белок, который экспрессируется в цитоплазме той же клетки.
«Мы разрушаем мембрану, поэтому митохондрии не могут работать функционально, чтобы производить энергию или работать как сигнальный узел. Это вызывает повреждение ДНК и запрограммированную гибель клеток», — сказал соруководитель работы Луфан Чжоу из Университета штата Огайо.
Повредить митохондрии сложно, так как внутренняя мембрана устойчива к фармацевтическим воздействиям. В лаборатории Чжоу пять лет назад была реализована альтернативная идея — подействовать на потенциал внутренней мембраны. Во внутреннюю мембрану митохондрий встроили каналородопсин, который создает ток протонов через мембрану. Этот белок индуцируется светом, и ученые активировали его с помощью лазера, однако в таком варианте всегда остается вопрос, каким образом опухоль будет освещаться в клинических условиях. В этой новой работе к каналородопсину добавили внутриклеточный источник света.
Гены светочувствительного каналородопсина из одноклеточной водоросли Chloromonas oogama (CoChR) и нанолюциферазы глубоководной креветки Oplophorus gracilirostris (NLuc) упаковали в вирусную частицу. При этом ген CoChR слили со специальной конструкцией, направляющей белок в митохондрии. После доставки в клетку, когда гены экспрессируются и в митохондриях появится CoChR, а в цитоплазме NLuc, инъекция люциферина ViviRen «включает» нанолюциферазу, затем активируется CoChR, и в результате митохондрии погибают. Работоспособность системы подтвердили на культурах раковых клеток. Также выяснили, что гибель митохондрий активирует апоптоз клеток.
После этого систему проверили на мышах. Лаборатория другого соруководителя работы из Университета Огайо, Сяогуан Маргарет Лю, специализируется на таргетной противораковой терапии. В новой работе для доставки генов использовался аденоассоциированный вирус (AAV) — коммерческий гибридный серотип AAV-DJ/8 с мутацией домена связывания гепарина, который успешно инфицирует клетки in vivo. Чтобы повысить онкоспецифичность, гены CoChR и нанолюциферазы поставили под промотор cfos, который увеличивает экспрессию в раковых клеток.
Для более эффективной и точной доставки вирусные частицы с генами выращивали в специальных клетках, которые упаковывали их в естественный наноноситель, напоминающий внеклеточные везикулы, которые циркулируют в крови и других биологических жидкостях человека. Такая конструкция обеспечивает стабильность в организме. Кроме того, частицы несли на себе моноклональное антитело, распознающее рецептор EGFR на поверхности раковых клеток.
Авторы испытали стратегию mLumiOpto на мышиных моделях двух быстрорастущих, трудно поддающихся лечению видах рака — глиобластомы мозга и трижды негативного рака молочной железы. Терапия экзосомами, несущими вирусы, значительно снизила опухолевую нагрузку по сравнению с нелечеными животными и увеличила выживаемость мышей с глиобластомами. Эффекты генной терапии были ограничены раковой тканью, нормальные клетки не экспрессировали CoChR и не погибали. Присоединение моноклонального антитела давало дополнительное преимущество, усиливая проникновение дендритных клеток и CD8 + T-клеток в микроокружение опухоли.
В настоящее время авторы работы изучает дополнительные потенциальные терапевтические эффекты mlumiOpto при глиобластоме, трижды негативном раке груди и других видах рака. Университет штата Огайо подал предварительную патентную заявку на эти технологии, сообщает Genetic Engineering and Biotechnology News.
Источник
Kai Chen, et al. MlumiOpto Is a Mitochondrial-Targeted Gene Therapy for Treating Cancer // Cancer Research. 2024. 84 (23): 4049–4065. DOI: 10.1158/0008-5472.CAN-24-0984


 Меню
Меню





 Все темы
Все темы




 0
0








