За рамками EGFR: оценка технологии молекулярно-генетического тестирования немелкоклеточного рака легких
Ниже мы приводим расшифровку вебинара, который провела в конце июля компания Agena Bioscience. Она занимается разработкой и поставкой оборудования и реагентов для молекулярной диагностики. В первой части вебинара доктор Эрван Панкреаш рассказал о том, как их лаборатория использует систему MassARRAY, разработанную компанией, для типирования немелкоклеточного рака легких (НМРЛ). Во второй части Александр Сартори описал различные варианты применения системы для анализа образцов тканей и жидких биопсий.

Элизабет Лэмб: Всем доброго дня. От имени Bio-IT World — серии вебсимпозиумов — и нашего спонсора Agena Bioscience приветствую вас на вебинаре. Меня зовут Элизабет Лэмб (Elizabeth Lamb), и я ведущая и модератор сегодняшнего мероприятия. Наш первый докладчик — Эрван Панкреаш (Erwan Pencreach), PhD, PharmD, отдел молекулярной онкологии Университетской больницы Страсбурга, Франция. Наш второй выступающий — доктор Александр Сартори (Alexander Sartori), научный сотрудник отдела исследований Agena. К сожалению, из-за изменений в расписании Эрван не может присоединиться к нам. Он записал свое выступление.
Эрван Панкреаш: Сегодня я представлю эволюцию нашей стратегии молекулярного тестирования с 2005 года и ее влияние на разные аспекты организации нашей работы. Как вы знаете, лечение рака легких вступило в новую эру с момента открытия активирующих мутаций в EGFR и перестроек генов. Все пациенты с раком легких должны пройти молекулярное тестирование на момент постановки диагноза. У пациентов с прогрессирующим НМРЛ обращают внимание на наличие или отсутствие драйверных мутаций, которые изменяют прогноз и определяют направление терапии. В настоящее время существует большое количество молекулярных тестов, и в течение последних 15 лет многие медицинские центры стали предоставлять пациентам оценку драйверных мутаций.
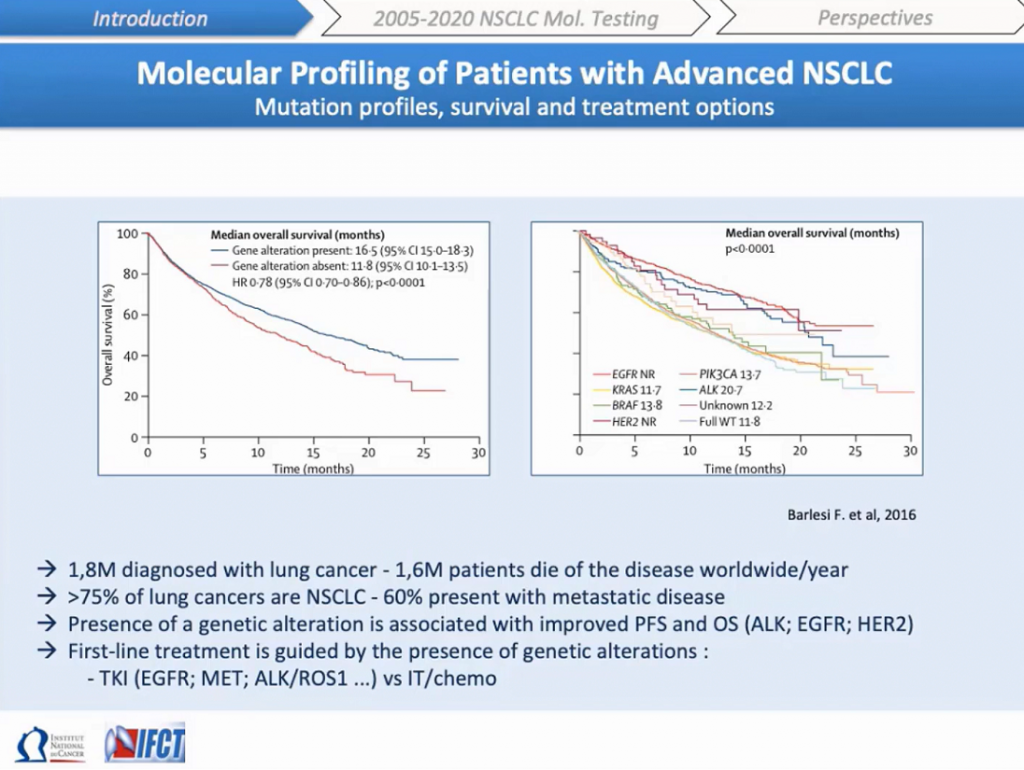
Рак легких является самой частой причиной смерти от онкозаболеваний во всем мире. Его диагностируют у 1,8 миллиона пациентов, НМРЛ составляет 80–85% этих диагнозов. Более чем у 50% этих пациентов развиваются метастазы с пятилетней выживаемостью меньше 5%. Молекулярное тестирование этих опухолей в настоящее время является стандартом диагностики пациентов с метастазами и рекомендуется для выявления генетических изменений. Некоторые из них были ассоциированы с увеличенной безрецидивной выживаемостью (PFS, progression-free survival) или общей выживаемостью (overall survival): например, активирующие EGFR мутации, транслокации в ALK и инсерции в HER2. Первоочередная терапия основана на выявлении онкогенных факторов, пациентов с подобными мутациями лечат ингибиторами тирозинкиназ, нацеленными на EGFR, ALK или MET.
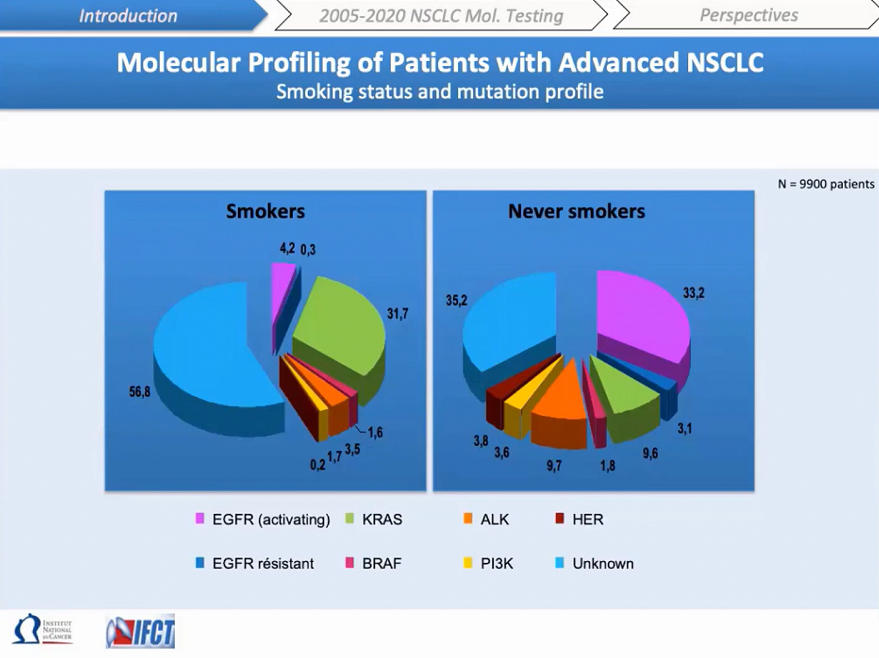
Мутации выявляются в 45–65% образцов НМРЛ. Курение, этническая принадлежность и пол являются значимыми факторами, определяющими частоту молекулярных изменений. Здесь представлены молекулярные профили курильщиков и некурящих. Генетически курение связано с более высокой распространенностью мутаций KRAS, в то время как изменения EGFR или ALK чаще встречаются у никогда не курящих или редко курящих.

Национальный институт рака во Франции в 2006 году разработал специальную программу по организации молекулярного тестирования во Франции и создал сеть из 28 молекулярно-генетических платформ в региональных больницах. Их цель — сделать доступными для всех пациентов в регионе молекулярные тесты, независимо от учреждения, где они проходят лечение: университетские больницы, онкологические центры или частные учреждения. Для этого организовали общенациональную сеть, чтобы можно было быстро обработать образцы опухолей в подразделении, связанном с другими, и гарантировать равный доступ к инновационным и существующим методам лечения.
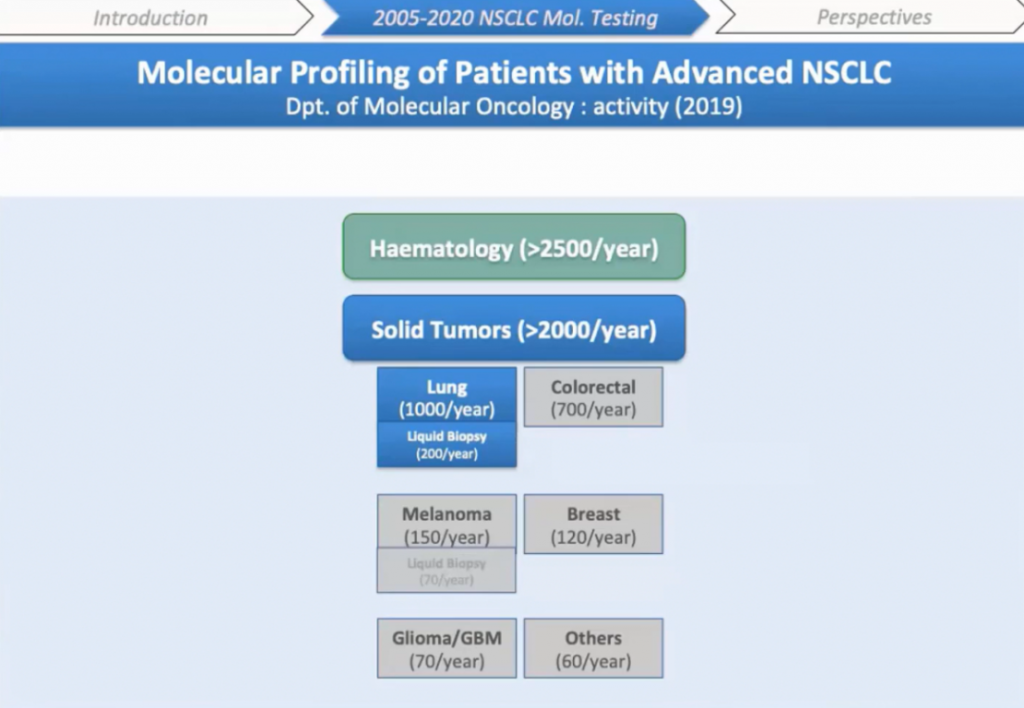
Наша университетская больница в Страсбурге является одной из 28 национальных платформ, посвященных молекулярному тестированию. Каждый год мы анализируем более двух тысяч образцов солидных опухолей на момент постановки диагноза или рецидива. Рак легких составляет более 50% этого количества: 1000 образцов солидных опухолей и 200 жидких биопсий, анализируемых каждый год.

Мы начали молекулярное тестирование рака легких в 2005 году с кПЦР и секвенирования по Сэнгеру. Десять лет спустя мы стали использовать цифровую капельную ПЦР, особенно для жидких биопсий, и секвенирование нового поколения (NGS). В 2018 году купили новый прибор для анализа слияний РНК. Я представлю эволюцию нашей стратегии диагностики с 2018 года, когда мы решили перейти к таргетному мультиплексному подходу с системой MassARRAY®, основанной на технологии MALDI-TOF (времяпролетная матрично-активированная лазерная десорбция/ионизация, matrix-assisted laser desorption/ionization — Time of Flight).
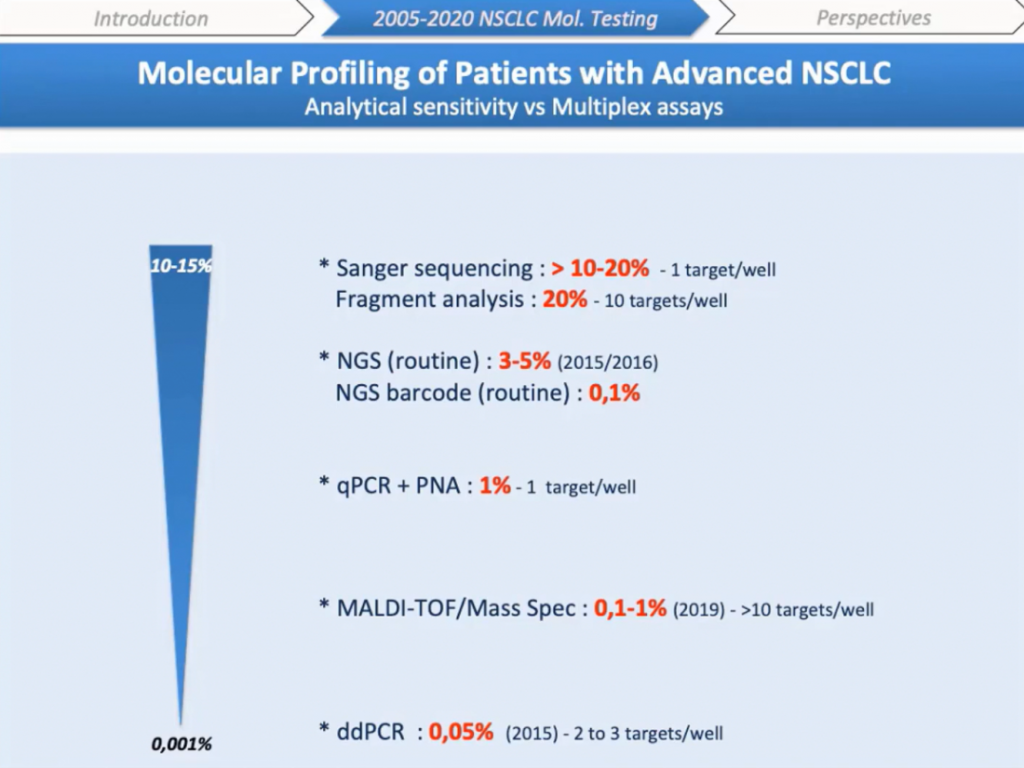
Вернемся к различным методам, которые использовали в лаборатории, и рассмотрим их ограничения с точки зрения чувствительности и возможности мультиплексирования. Одним из недостатков сверхчувствительных методов является ограниченная возможность мультиплексирования — идет анализ двух-трех мишеней, как в случае с цифровой ПЦР. Напротив, методы секвенирования с анализом большого количества образцов не обеспечивают достаточного уровня чувствительности для поиска субклонов в опухолях. NGS позволяет идентифицировать мутации с чувствительностью 3–5%, но не 1% или меньше. Были разработаны более чувствительные методы баркодирования, они еще не получили широкого применения на платформах секвенирования для диагностики. Такие системы, как технология MassARRAY®, дают возможность анализировать больше 100 образцов за один раз с пределом обнаружения 0,01–1%.
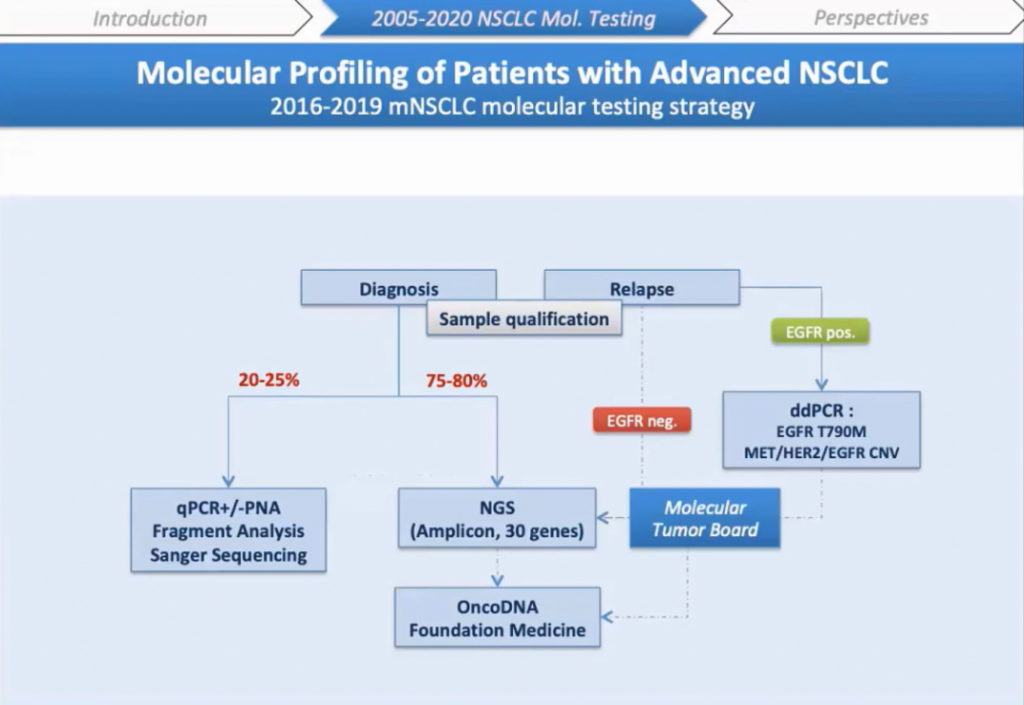
Основываясь на этих технических подходах, мы разработали стратегию тестирования метастатического НМРЛ в период с 2016 по 2019 год. Я сосредоточусь на стратегии первичной диагностики — важной части нашей работы после выделения ДНК, количественной и качественной оценки. Так, образцы анализируют либо с помощью NGS, либо с помощью комбинации кПЦР анализа и секвенирования по Сэнгеру. Это зависит от количества или качества ДНК. По нашему опыту только 75% образцов FFPE (Formalin-fixed paraffin-embedded) можно использовать для NGS.
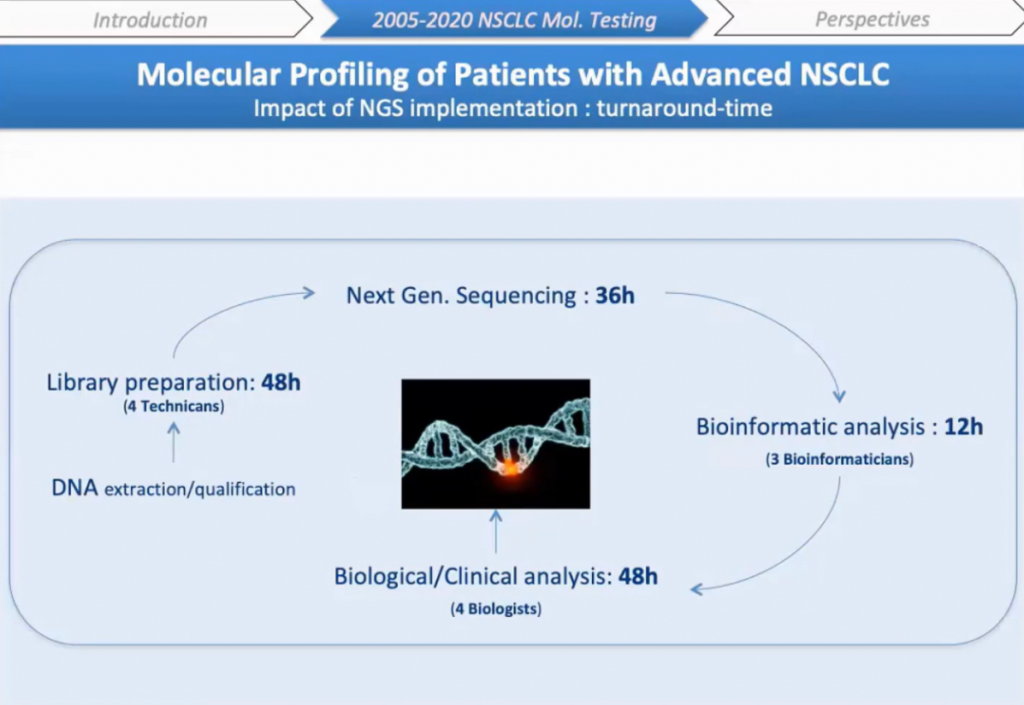
Внедрение NGS оказало значительное влияние на организацию лаборатории. 48 часов в среднем нужно для подготовки библиотеки четырьмя обученными техническими специалистами, 36 часов — на секвенирование, 12 — на биоинформационный анализ, трое специалистов были наняты для разработки программ. И наконец, 48 часов для биологического и клинического анализа, в котором участвуют четыре биолога.
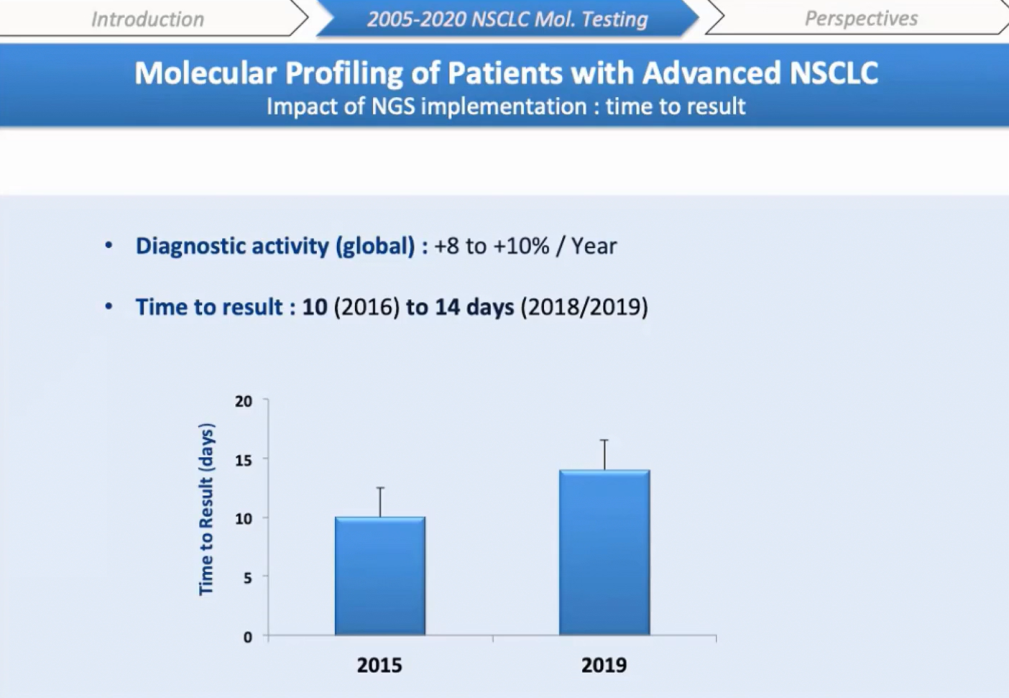
В целом это привело к значительному увеличению времени получения результатов, которое коррелировало с ростом общей работы платформы в области гематологии и солидных опухолей примерно на 8-10% в год в течение последних четырех лет.

Внедрение NGS тестирования является сложной задачей с технической и экономической точек зрения. Хотя общая стоимость секвенирования снизилась за последние 10 лет, новые методы появлялись в контексте растущей озабоченности по поводу расходов на здравоохранение. Молекулярное тестирование нужно для назначения дорогостоящей таргетной терапии или иммунотерапии, и секвенирование распространилось раньше, чем была продемонстрирована его ассоциация с лучшей выживаемостью, при этом — без экономической оценки. Кроме того, во многих исследованиях не учитывались затраты на компьютерный анализ, разработку программ и хранение данных. В недавнем общенациональном французском исследовании представлена оценка затрат на NGS для панелей генов: она составила около 607 евро. И это вызывает вопросы о биологической и клинической эффективности по сравнению с более таргетированными подходами.
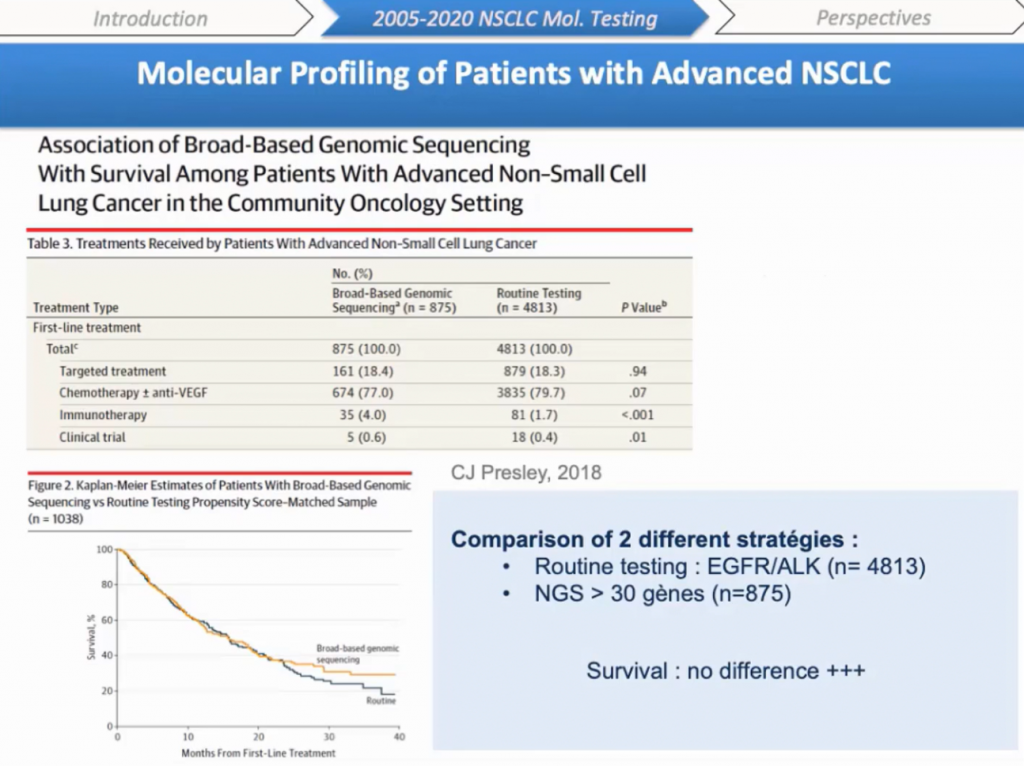
Нет никаких доказательств того, что универсальное (broad-based) секвенирование улучшает выживаемость у популяции пациентов с прогрессирующим НМРЛ. И одно из первых рандомизированных клинических испытаний геномного секвенирования не обнаружило никакого роста безрецидивной выживаемости. Более того, в недавнем ретроспективном исследовании, опубликованном Кэролайн Пресли (Carolyn Presley) из Университета штата Огайо, NGS подход не был связан с лучшей выживаемостью по сравнению c обычным определением мутаций в EGFR и ALT.

В целом эти технические, клинические и экономические данные поставили вопрос об эффективности использования NGS для постановки первичного диагноза.
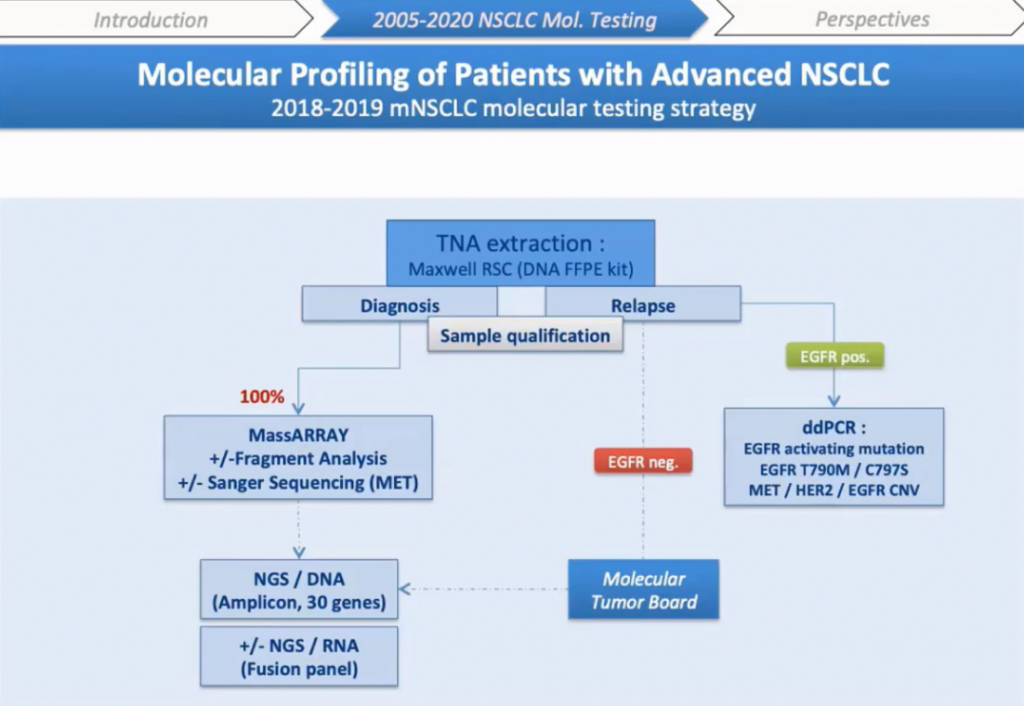
Я представлю технический подход, который мы оценили в 2018 году и внедрили в нашей лаборатории в прошлом году для первичного молекулярного тестирования НМРЛ. Наша первая цель была — разработать целевой мультиплексный подход для сокращения времени выполнения работ и снижения затрат без уменьшения ежедневной производительности. Мы решили оценить технологию MassARRAY®, которая представляет собой открытую платформу, подходящую для любого дизайна ПЦР, а также имеет валидированные панели для тестирования при раке легких, опухолях толстой кишки, молочной железы или меланоме. Мы сравнили полученные результаты посредством технологии iPLEX® HS, которую я опишу далее, с NGS подходом. В течение шести месяцев мы протестировали FFPE образцы и жидкие биопсии в ретроспективном исследовании. И, наконец, мы оценили работу системы MassARRAY® в реальных тестах в течение трех месяцев параллельно с универсальным секвенированием.
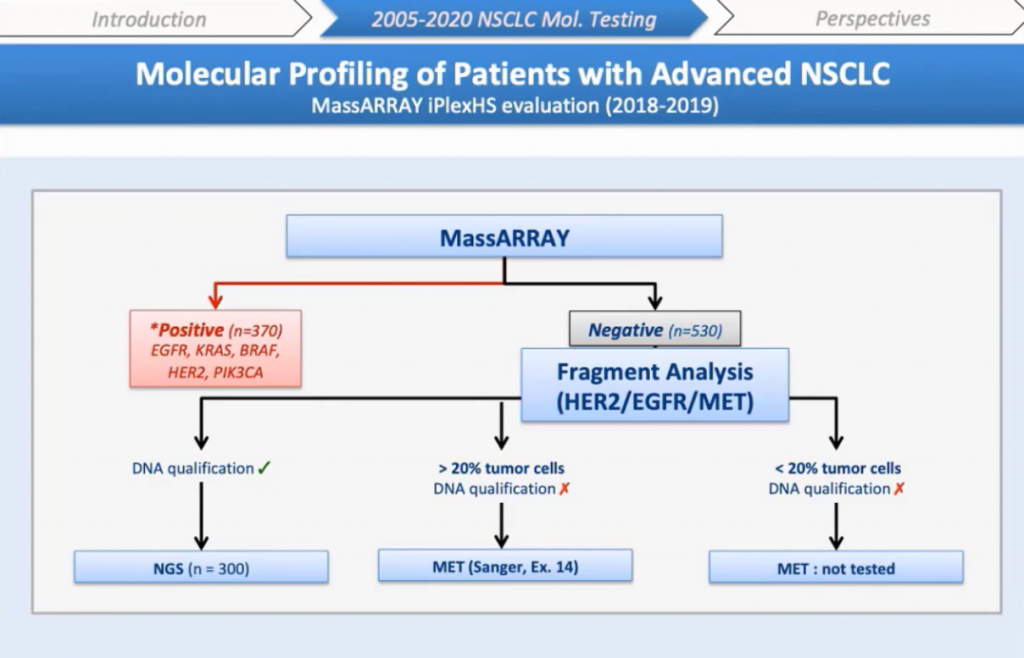
Я опишу технические результаты, а также экономическую оценку, основанную на нашей деятельности в 2017 году, где мы тестировали 900 образцов НМРЛ. Мы идентифицировали мутации в EGFR, KRAS, BRAF, HER2, PIK3CA в 370 образцах, 530 образцов были негативными по этим мутациям. Поэтому мы решили сначала проанализировать все образцы c помощью MassARRAY®, а затем отрицательные образцы были протестированы методом анализа фрагментов для экзонов 19 и 20 EGFR, экзона 20 HER2 и экзона 14 MET. Затем оставшиеся отрицательные образцы анализировали либо NGS, либо секвенированием по Сэнгеру в зависимости от качества и количества ДНК, процента опухолевых клеток.
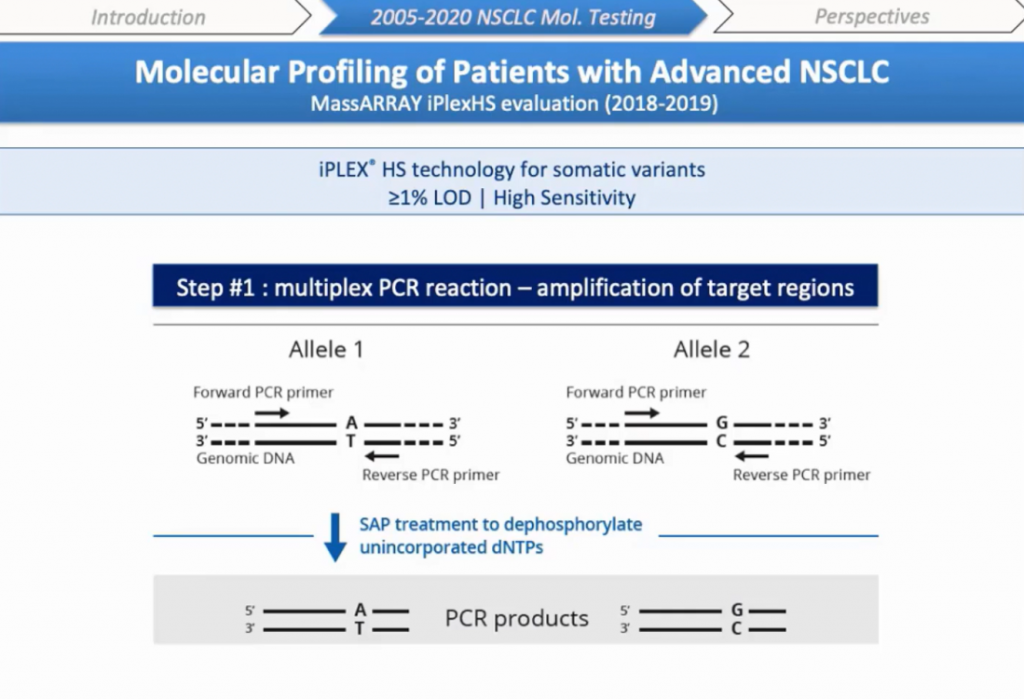
Как работает технология iPLEX® HS? Процесс начинается с мультиплексной ПЦР-амплификации мишеней BRAF, EGFR, KRAS, HER2, PIK3CA с 10 нанограммов (нг) исходного материала. В конце ПЦР нуклеотиды дефосфорилируются фосфатазой SAP.
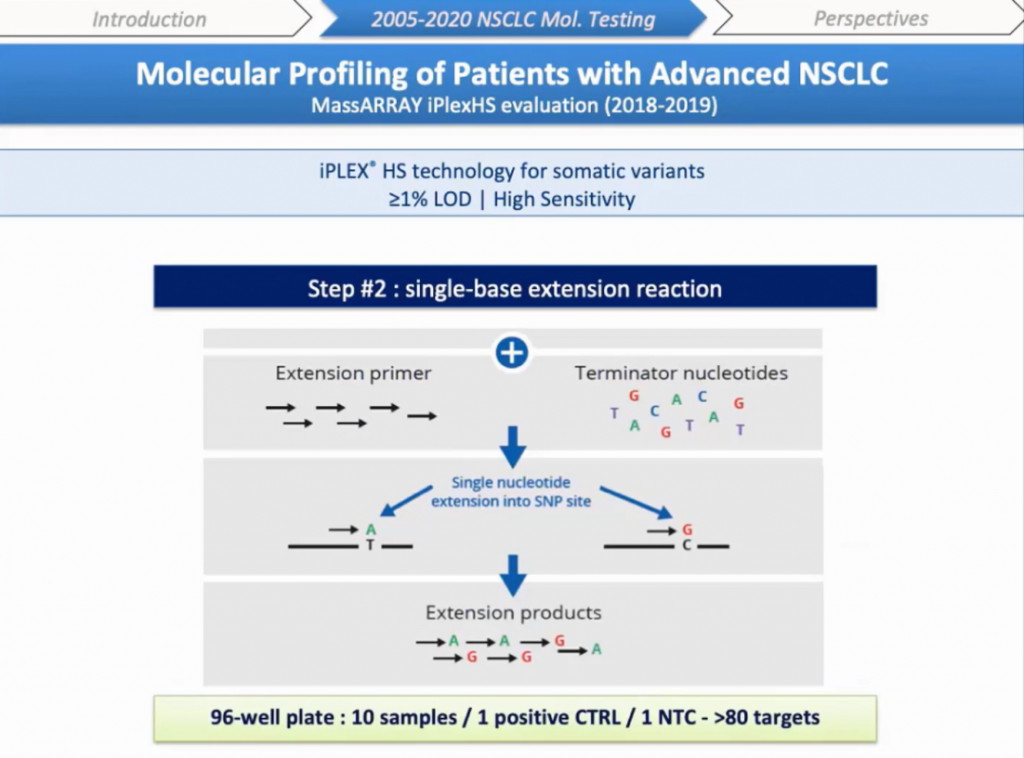
Далее идет реакция понуклеотидного удлинения праймеров (single-base extension). К продукту добавляется смесь, содержащая праймеры для удлинения, которые отжигаются на амплифицированных фрагментах, фермент и дидезоксинуклеотиды-терминаторы. После отжига праймеры удлиняются на нуклеотид, соответствующий сайту SNP, который также и останавливает реакцию. Мы можем проанализировать 10 образцов за один раз в 96-луночном планшете с одним положительным и одним отрицательным контролем, с более чем 80 анализируемыми мишенями.
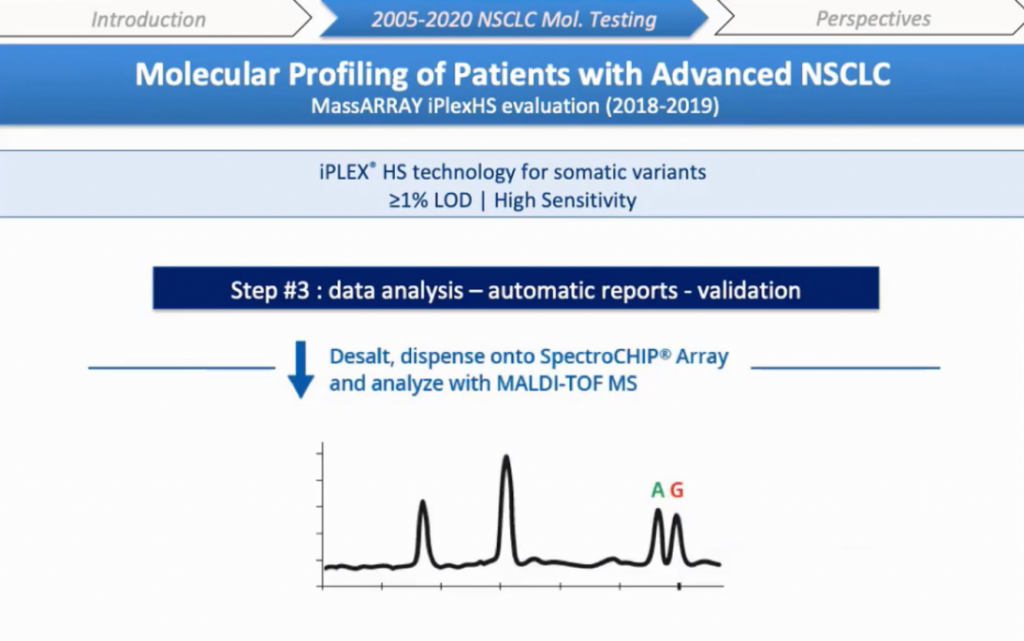
Наконец, продукты реакции осаждают и переносят на SpectroCHIP® (чип) с помощью автоматического нанодиспенсера, где ДНК кристаллизуется на нанесенном матриксе. Чип загружается в MassARRAY® анализатор, где под действием лазера происходит десорбция и ионизация ДНК. Положительно заряженные молекулы ускоряются и летят в сторону детектора, разное время полета определяется массой отдельных молекул. После каждого облучения прибор определяет время полета удлиненных продуктов, результаты обрабатываются автоматически. Общее время обработки составляет около 10 часов от амплификации ДНК до конечного результата для десяти образцов с одним положительным и одним отрицательным контролями; 2,5 часа — ручная подготовка, и около 30 минут на анализ спектрограмм для десяти пациентов.
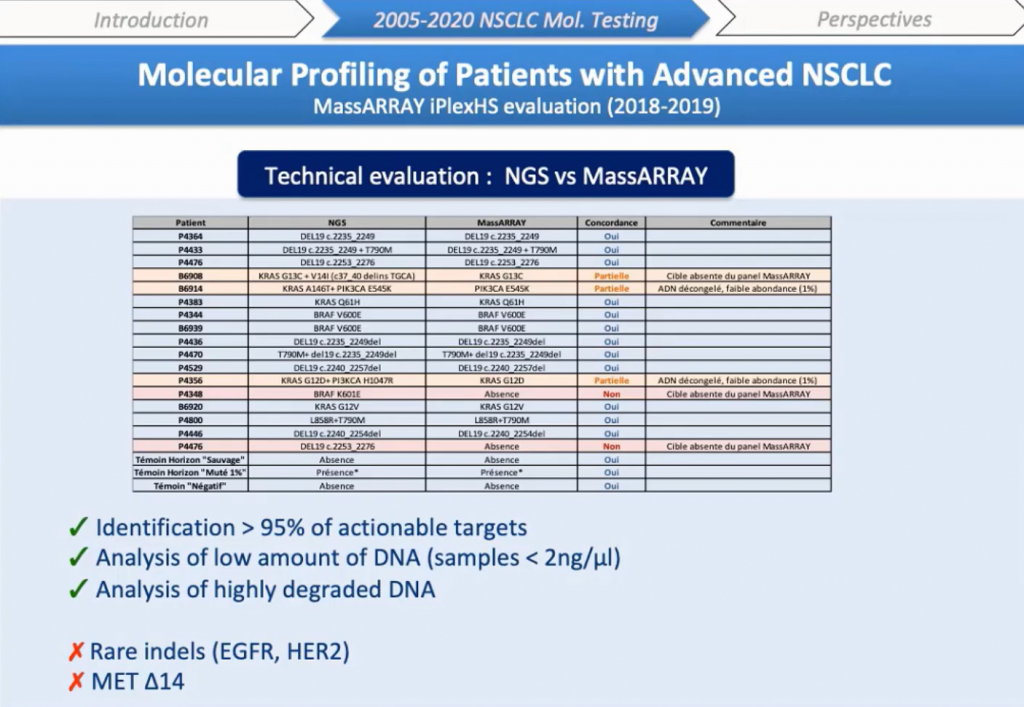
Итак, мы определили более 95% мишеней, первоначально выявленных NGS. Как и ожидалось, редкие делеции в экзоне 19 EGFR или инсерции в экзоне 20 HER2 не были обнаружены. В ретроспективном исследовании большинство несогласованных результатов наблюдалось в случае замороженных образцов, вероятно, из-за деградации ДНК. Интересно, что образцы низкого качества, старые FFPE образцы, а также очень низкая концентрация ДНК или низкий процент опухолевых клеток (<5%) не влияли на амплификацию и анализ. И мы смогли выявить мутации в некоторых образцах, которые не могли быть проанализированы с помощью NGS или секвенирования по Сэнгеру.
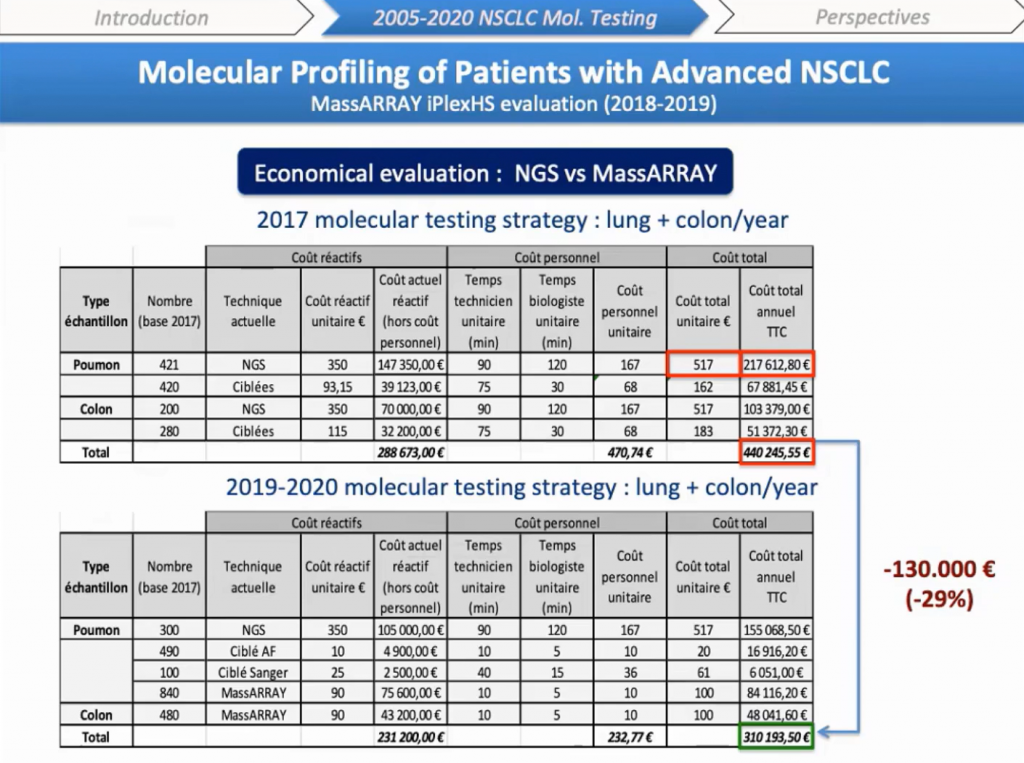
Про изменение затрат. Представленные результаты были рассчитаны на основе нашей работы в 2017 году в области молекулярного тестирования рака легких и толстой кишки, которая составляет более 80% нашей диагностической активности. Мы подсчитали, что внедрение MassARRAY® может сократить наши расходы почти на 30%, что составляет 130000 евро в год. Мы оценили эту новую диагностическую стратегию в апреле 2019 года, и сейчас наши экономические данные оцениваются администрацией.
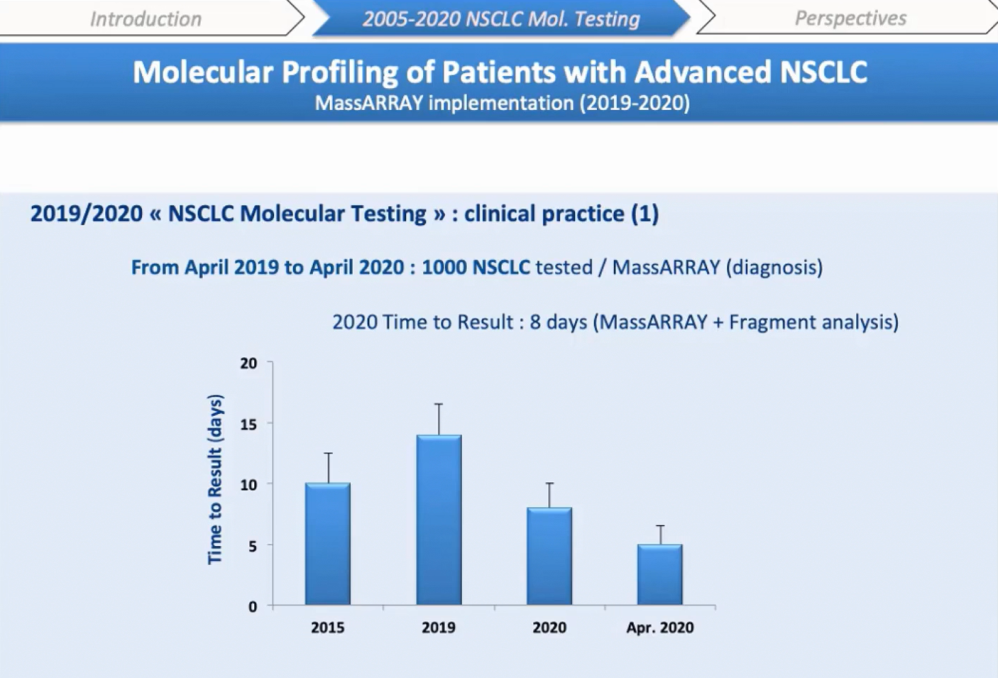
Еще один немаловажный аспект — время получения результата, которое отражает деятельность техников, инженеров и биологов. Как видите, внедрение MassARRAY® значительно сократило промежуток между поступлением образца и получением результата. 14 дней в 2018 году и восемь дней в 2020-м.

Наконец, представлю биологические данные о нашем молекулярном тестировании НМРЛ с использованием технологии MassARRAY®. Во-первых, негативные образцы после MassARRAY® и анализа фрагментов были протестированы, и мы обнаружили редкие мутации в BRAF, EGFR, KRAS, HER2, PIK3CA менее чем в 1% образцов опухолей. Внедрение технологии сократило наше использование NGS на 35%. Анализ фрагментов также позволил идентифицировать редкие делеции в экзоне 19 EGFR и вставки в экзоне 20 HER2. Мы подтвердили, что у нас нет ограничений в случае образцов с небольшим количеством ДНК или деградированными молекулами. Мы также оценили предел обнаружения — 1% для некоторых вариантов, которые были количественно определены с помощью цифровой капельной ПЦР, и продемонстрировали, что метод iPLEX® HS способен обнаруживать 30–50 копий с мутациями в одном образце.
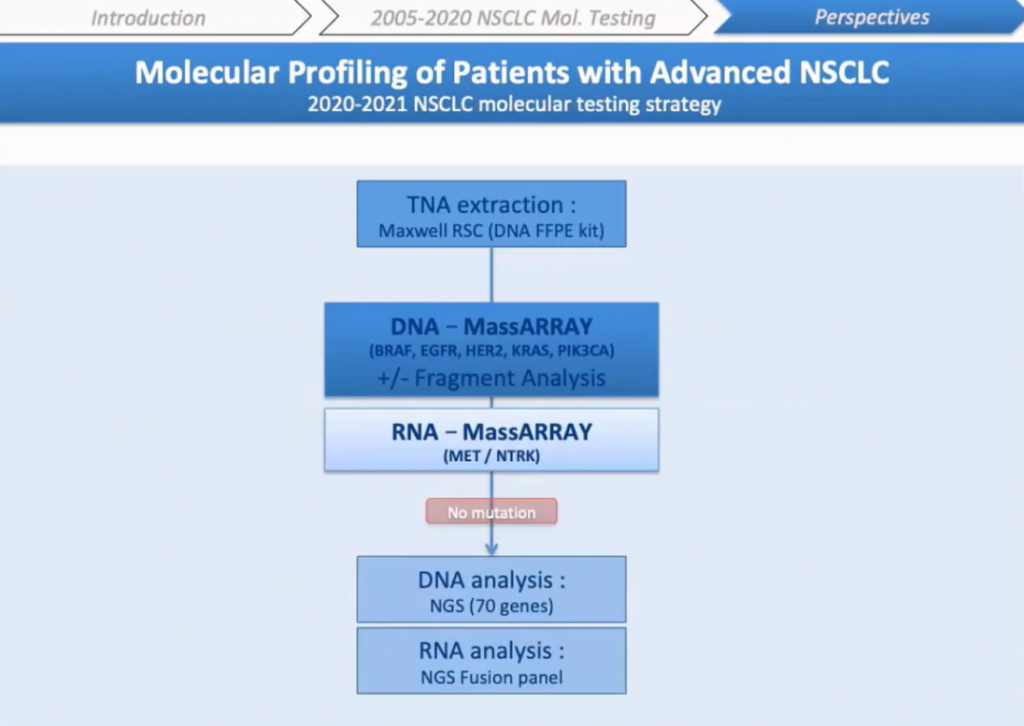
В настоящее время мы внедрили iPLEX® HS для типирования рака легких, а также рака толстой кишки и меланомы. Наша следующая цель будет заключаться в разработке анализа РНК на MassARRAY® для оценки изменений в MET и NTRK. Спасибо вам за внимание, не стесняйтесь обращаться ко мне или моим коллегам, если у вас есть вопросы.
Элизабет Лэмб: Спасибо. Если у вас есть вопросы, мы перешлем их ему по электронной почте. Перейдем к нашему второму докладчику, доктору Александру Сартори.

Александр Сартори: Во-первых, я хочу поблагодарить доктора Панкреаша за отличный обзор технологии MassARRAY®. Я расскажу о некоторых приложениях, которые возможны у этой системы. Меня зовут Александр Сартори, и я работаю в отделе исследований в Agena Bioscience. И я говорю с вами сегодня из Гамбурга, Германия.

Agena Bioscience® производит систему MassARRAY®. Это единственный масс-спектрометр на рынке для выявления нуклеиновых кислот: и ДНК, и РНК. Мы также разрабатываем большое количество дополнений для этой технологии и программное обеспечение. Штаб-квартира находится в Сан-Диего, штат Калифорния, и она управляет офисами продаж в Брисбене, Австралия, в Шанхае, Китай, и здесь, в Германии.

Если вы хотите узнать больше о том, как она функционирует, о его основных преимуществах, таких как расходы на эксплуатацию, масштабируемость, точность и чувствительность, посетите наш сайт agenabio.com, где вы найдете подробное видео о технологии, а также техническую информацию.
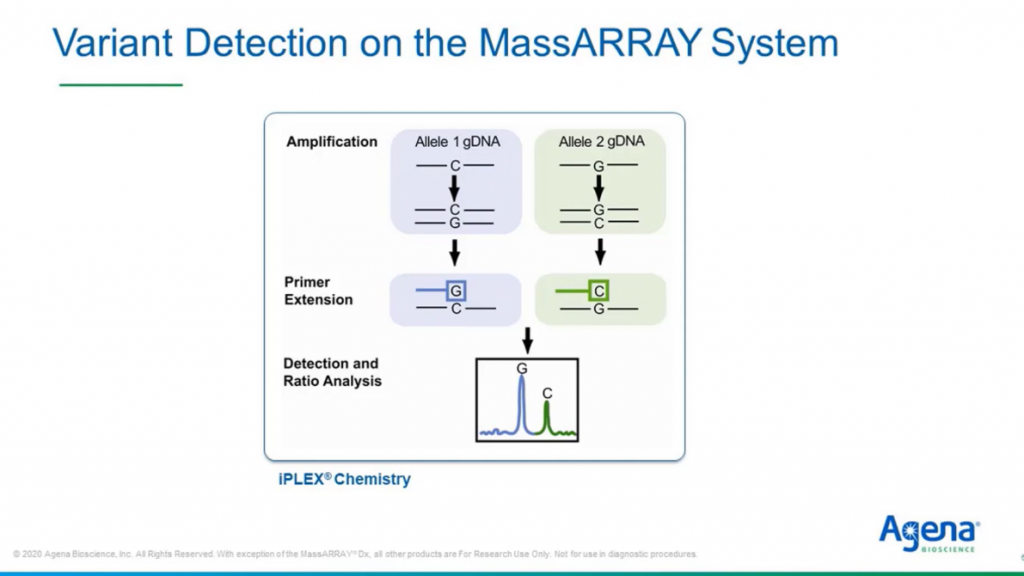
Принцип детекции мишени достаточно прост. MassARRAY® является таргетным подходом, вы начинаете с классической ПЦР-амплификации, чтобы размножить мишень. На втором этапе выполняется реакция удлинения праймеров: они отжигаются перед интересующим нас основанием, которое достраивается вне зависимости от того, является ли оно нормальным или мутантным. Как показано на графике внизу, продукты реакции незначительно различаются по молекулярной массе, что позволяет детектировать дикий тип и измененный вариант на MassARRAY®.

Основываясь на этом принципе, мы предоставляем разные варианты использования в фармакогеномике, для анализа жидких биопсий, профилирования опухолей, теста на SARS-CoV-2, в наследственной генетике, для изучения химеризма и типирования крови, а также — систему маркировки образцов.

Хотя сегодня мы говорим об онкологии, я упомяну решение Agena для борьбы с COVID-19 с помощью диагностической платформы для тестирования на SARS-CoV-2. Эта панель предназначена для in vitro диагностики и в настоящее время находится на рассмотрении FDA в США. В Европе мы работаем с уполномоченным представителем, чтобы получить маркировку CE. Панель будет доступна для продажи в Европе после получения знака. С точки зрения дизайна панель очень специфична: в качестве мишеней мы используем три участка гена нуклеокапсида, а также фрагменты ORF1 и 1ab. Помимо специфичности, технология очень гибкая с точки зрения масштабируемости, эксплуатационные расходы конкурентоспособны. И последнее, но не менее важное: Agena готова поставлять любое необходимое количество реагентов, чтобы соответствовать самым высоким требованиям производительности. На нашем сайте вы можете найти и скачать дополнительную информацию о панели SARS-CoV-2.

Там вы также можете скачать статью, в которой мы представили результаты оценки предела обнаружения вируса в образце.
Вернемся к онкологии. Итак, в случае анализа биопсий и профилирования опухолей важна предварительная оценка образца с точки зрения его качества, чистоты и количества клеток. Эти тесты суммируются в подходе Sample Integrity. Например, вы хотите знать уровень деградации ДНК в образцах FFPE, прежде чем приступать к анализу. В случае жидкостной биопсии вам нужно убедиться, что в реакцию добавляются нужные компоненты, чтобы соответствовать чувствительности. Для чувствительности в 0,1% вам нужно добавить не менее 10 нг или 3000 копий свободно циркулирующей ДНК (сцДНК) в смесь.

Принцип работы системы был объяснен ранее. Доктор Панкреаш также познакомил нас с гиперчувствительным вариантом, который называется iPLEX® HS (hyper sensitivity), который его страсбургская лаборатория внедрила для тестирования биопсийного материала опухолей с чувствительностью около 1%. Если вы хотите работать с жидкими биопсиями, Agena предлагает метод UltraSEEK®, который снизил предел обнаружения вплоть до 0,1%. Оба метода основаны на мультиплексировании, то есть вы используете свой драгоценный материал только один раз в единственной реакции. Он размножается, и с 10 нг исходного количества вы получаете достаточное количество материала для проведения анализа.
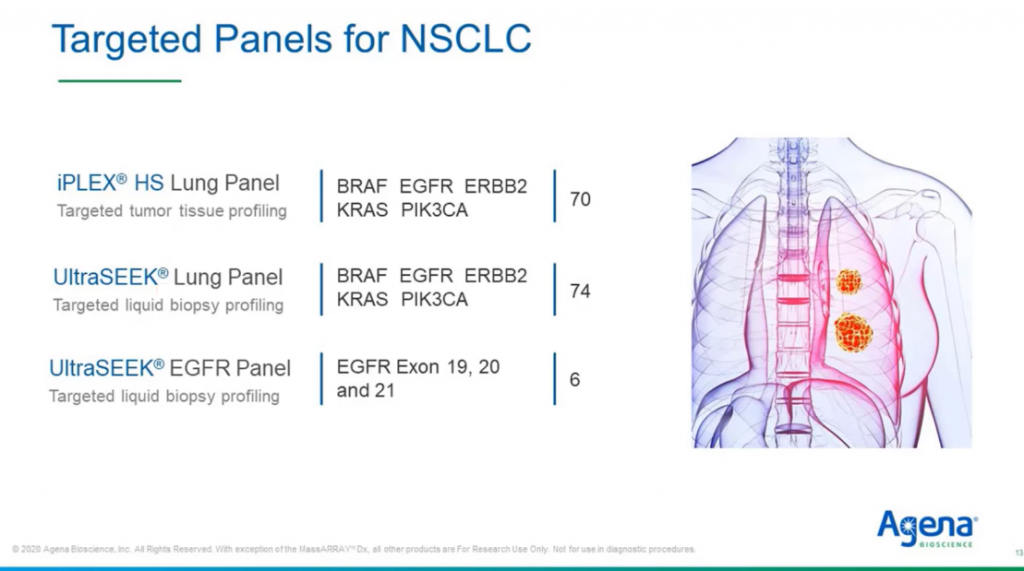
Для этих двух систем Agena предлагает ряд валидированных таргетных панелей, в частности — для профилирования НМРЛ. Две легочных панели iPLEX® HS и UltraSEEK® анализируют пять генов (ERBB2, KRAS, BRAF, EGFR, PIK3CA) и практически полностью перекрываются по содержанию: 70 маркеров в случае анализа биопсии ткани и 74 — жидкостной биопсии. Также у нас есть EGFR панель UltraSEEK®, которая анализирует только основные варианты экзонов 19-21 EGFR. Обе панели UltraSEEK® могут работать вместе. Вы можете начать с EGFR панели, более экономичной, и только в том случае, если вы не обнаруживаете ни одной из включенных мутаций, вы анализируете те же ПЦР-продукты с помощью большой панели.
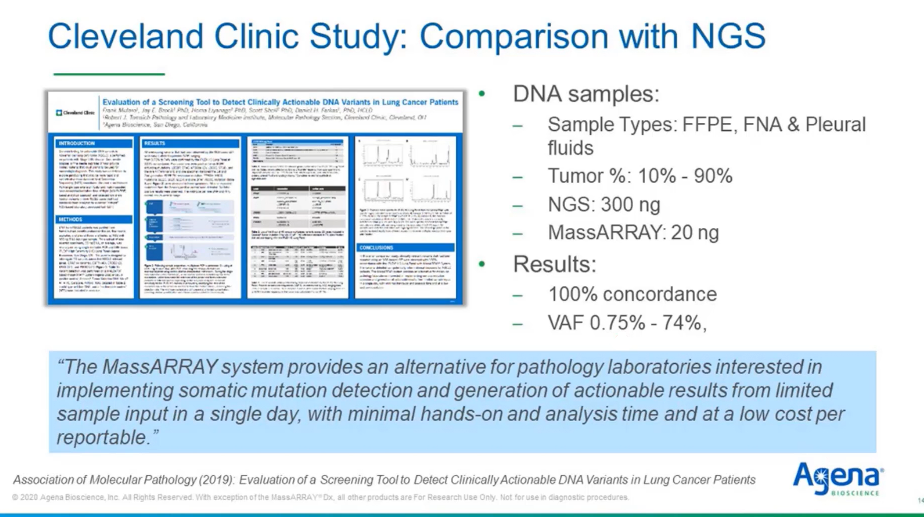
В работе, которая была сделана Кливлендской клиникой, оценили эффективность MassARRAY® в сравнении с NGS. В этом исследовании использовались образцы типа FFPE, образцы тонкоигольной аспирационной биопсии и плевральной жидкости c количеством опухолевых клеток от 10 до 90%. И для NGS использованы 300 нг в качестве входного количества, для MassARRAY® — 20 нг, что больше, чем мы рекомендуем. Группа показала 100%-ное совпадение результатов, низкую дисперсию и детектируемые частоты вариантов аллелей (VAF) в диапазоне 0,75–74%. Их выводы представлены в синей области: «Система MassARRAY® является альтернативой для лабораторий, заинтересованных в анализе соматический мутаций в небольшом объеме образца и получении результатов в течение суток, с минимальной ручной работой, временем анализа при низких затратах».

Это была демонстрация работы для НМРЛ. Agena также предлагает панели для типирования колоректального рака: iPLEX® HS и UltraSEEK® для образцов тканевой и жидкостной биопсии, которые оценивают 86 и 107 вариантов в NRAS, KRAS, BRAF, EGFR, PIK3CA, соответственно.
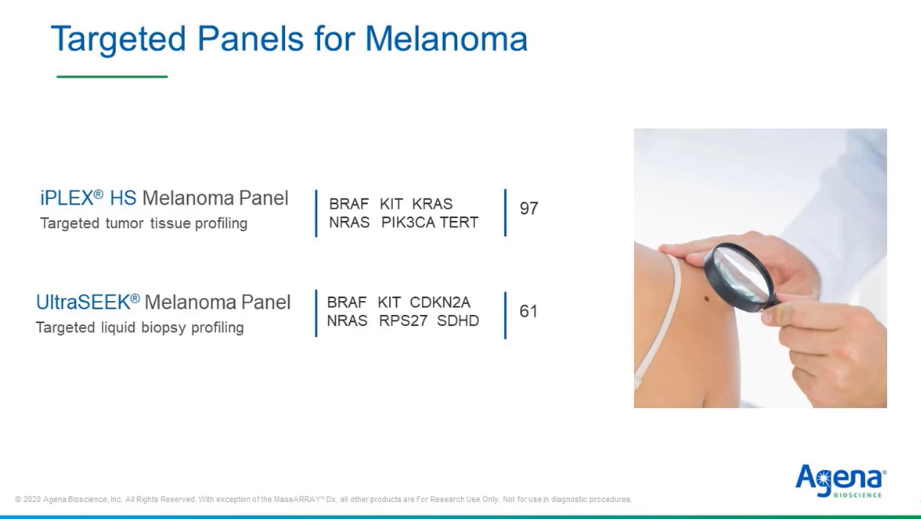
И последнее, но не менее важное: панели для тестирования меланомы с аналогичной техникой. Для одного образца вы анализируете 97 или 61 мутацию из ткани или жидкостной биопсии.

Как и деятельность лаборатории доктора Панкреаша, так и работа кливлендской группы сосредоточены на анализе тканей. Какова же фактическая чувствительность теста жидкой биопсии UltraSEEK®? Мы провели крупное совместное исследование с пятью лабораториями, где в качестве контроля использовали метод Seraseq®, на различных частотах встречаемости аллелей (VAF) от 0,1% до 2%. Для самых часто встречаемых в НМРЛ делеций в EGFR чувствительность составила 0,1-0,5%, с высокой воспроизводимостью и специфичностью, близкой к 100%.

Покажу вам постер с конференции IASLC & WCLC 2019 в Барселоне. Работа сравнивала результаты анализа 100 образцов тестом Cobas® (Roche) на мутации в EGFR и панелью UltraSEEK™. В первом случае входное количество сцДНК составляло почти 25 нг, во втором — в среднем около 9 нг. При таком сравнении согласованность составила 85%. Но когда для обеих платформ использовали по 9 нг, то MassARRAY® показал более высокую чувствительность, обнаруживая мутацию T790M в EGFR на 50% чаще. Также, в отличие от Cobas®, наша панель детектирует мутации в BRAF и KRAS,
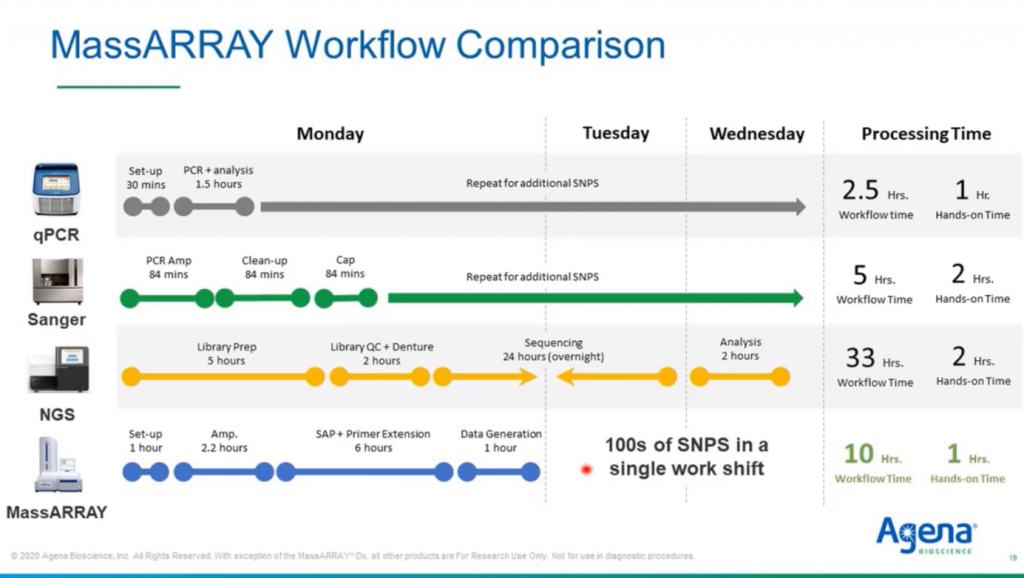
Доктор Панкреаш упоминал, что время получения результата на MassARRAY® было одним из факторов, побудивших их внедрить технологию в своей лаборатории. Здесь вы видите сравнение процессов работы разных систем. Обработка образца на MassARRAY® занимает около 10 часов, в зависимости от приложения, оно может быть еще короче. Так, вы получите свои результаты на следующий день с минимальным необходимым временем ручной работы. Отмечу, что биоинформатический анализ также не требуется: после запуска надо нажать на одну кнопку, и вы получите автоматический отчет со всей необходимой информацией.

Есть много других лабораторий, которые оценивают работу MassARRAY®. Приведу описание случая из крупной лаборатории в Северной Америке, которую не могу назвать. Они также сравнивали MassARRAY® с NGS, в синем квадрате представлены критерии, которые они оценивали.

Они подтвердили, что время получения результата у MassARRAY® значительно меньше: около 3 дней, при этом не нужно ждать обработки результатов. Эта группа увеличила свою производительность с 40 образцов до более 200 в неделю. Они также отметили снижение стоимости и затрат примерно на 2 миллиона долларов за пятилетний период.

Хочу поблагодарить вас за проявленный интерес, мы готовы ответить на ваши вопросы. На слайде вы видите контакты моей коллеги, Дивии Нилам (Divya Neelam), которой вы можете писать.
Элизабет Лэмб: Спасибо, доктор Сартори. У нас есть несколько вопросов. Первый: «Определяет ли система, какие нужно использовать методы лечения наряду с обнаруженными мутациями»?
Александр Сартори: Нет. Отчет дает вам информацию только об обнаруженных мутациях и точности анализа.
Элизабет Лэмб: Наш следующий вопрос: «iPLEX® HS, как я понимаю, анализирует 70 мутаций в пяти генах. Планируете ли вы разработку более крупных панелей?»
Александр Сартори: У нас есть бóльшие панели. Выбор панели — это всегда подробное рассмотрение и консультации с сотрудниками лабораторий. Agena старается найти золотую середину, чтобы сделать панель экономически эффективной и получать необходимое и достаточное количество информации на образец во время одного запуска. Теоретически и технически мы действительно могли бы сделать гораздо большие панели.
Элизабет Лэмб: Спасибо. Другой слушатель спрашивает: «Под опухолевой тканью вы подразумеваете тест на соматическую мутацию?»
Александр Сартори: Да, я имею в виду, что вы используете ткань в качестве источника материала, а не жидкую биопсию.
Элизабет Лэмб: Еще вопрос: «Какова минимальная и максимальная пропускная способность MassARRAY®?»
Александр Сартори: Пропускная способность зависит от ряда критериев. Например, это зависит от панели: мы рассматривали легочную и EGFR панели iPLEX® HS. Они обе начинаются с ПЦР, и затем мы используем разные доли доступного пространства на чипе для разных панелей. На чипе анализируются результаты 96 реакций, для более крупной панели легких — это восемь образцов. Agena поставляет два варианта MassARRAY® с чипами с 96 и 384 ячейками. В случае панели для тестирования SARS-CoV-2 можно достичь производительности около 7000 образцов в день. Но панели для типирования опухолей не дают больше нескольких образцов за пару дней. Так что выход в целом гибкий и масштабируемый.
Элизабет Лэмб: Отлично, последний вопрос: «Вы работаете еще над какими-нибудь панелями для тестирования опухолей?»
Александр Сартори: Есть некоторые новые, я не могу про них говорить. У нас всегда есть несколько панелей, находящихся на разных стадиях разработки.
Элизабет Лэмб: Благодарю вас, уважаемые докладчики. Я хотела бы еще раз поблагодарить Agena Bioscience за спонсирование сегодняшнего мероприятия и наших слушателей за присутствие.








 Меню
Меню





 Все темы
Все темы







 0
0