Бактерии производят супержесткие волокна из титина
Американские ученые разработали биотехнологический способ получения волокон с повышенной жесткостью из мышечного белка титина. Их производят бактерии Escherichia coli. По прочности и жесткости эти волокна превосходят многие синтетические полимеры и при этом являются полностью биоразлагаемыми.
Washington University in St. Louis | Пресс-релиз
Синтетические полимерные волокна, отличающиеся повышенной жесткостью, как правило, производят из нефти в ходе экологически грязного процесса, сопровождающегося использованием токсичных растворителей и выделением ядовитых побочных продуктов. Кроме того, синтетические полимеры, как правило, не биоразлагаемы. Группа под руководством исследователей из Вашингтонского университета в Сент-Луисе (США) разработала сверхжесткий полимер, состоящий из мышечного белка титина — одного из самых крупных известных белков. Процесс производства нового полимера безопасен для окружающей среды, так как его синтезируют бактерии.
Титин придает мышечной ткани прочность и амортизационные свойства, а также дает ей возможность быстро восстанавливаться после приложения механической силы. Дело в том, что титин — ультравысокомолекулярный белок с массой более 3 МДа, он состоит из сотен повторяющихся иммуноглобулиновых доменов. Предыдущие попытки производства титиноподобных полимеров были неудачными именно из-за его колоссальной молекулярной массы. Новый метод производства полноразмерных титиновых волокон в клетках Escherichia coli основан на in vivo полимеризации небольших фрагментов титина с помощью сплит-интеинов — самовырезающихся белковых последовательностей.
Авторы исследования получили фрагменты ДНК, кодирующие конструкцию следующего строения: N-концевой сплит-интеин — 4 иммуноглобулиновых домена — C-концевой сплит-интеин. Пары сплит-интеинов катализируют реакции самосплайсинга, в результате которых почти полностью вырезаются, а сшитые с ними белковые последовательности (в данном случае 4 Ig-домена) оказываются ковалентно соединенными пептидной связью. (См. схему из статьи.) Иммуноглобулиновые домены были позаимствованы из титина кролика. Длина одного фрагмента, состоящего из двух интеинов и четырех Ig-доменов между ними, достигала 16,4 нм. В клетках, экспрессирующих указанную конструкцию, образовывались титиновые полимеры средней массой 2,4 МДа.
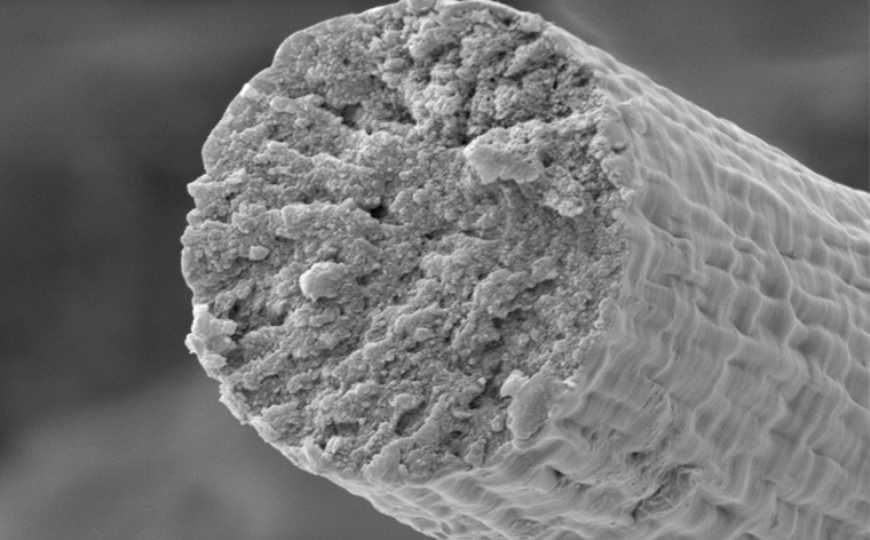
После выделения наработанных белковых полимеров спектроскопия кругового дихроизма подтвердила, что их структура соответствует структуре титиновых волокон. С помощью сканирующей просвечивающей электронной микроскопии ученые получили изображения синтезированных бактериями титиновых волокон и установили, что их диаметр достигает 6-7 нм, что примерно соответствует диаметру мышечных титиновых волокон.
Ученые смогли собрать титиновые волокна бактериального происхождения в более толстые структуры диаметром около 10 мкм, в которых отдельные волокна образуют β-листы. Полученные волокна обладают прекрасными механическими свойствами, по жесткости и прочности превосходя многие синтетические аналоги (по жесткости превосходит кевлар, отмечается в пресс-релизе Вашингтонского университета). Авторы работы отмечают, что новый материал способен найти самое широкое применение, от биомедицины до текстильной промышленности. Поскольку он практически идентичен белкам мышечной ткани, он должен быть биосовместимым и поэтому может быть отличным материалом для швов или тканевой инженерии.
Источник
Bowen, C.H., et al. Microbial production of megadalton titin yields fibers with advantageous mechanical properties. // Nature Communications, 12, 5182, 2021, DOI: 10.1038/s41467-021-25360-6.


 Меню
Меню





 Все темы
Все темы




 0
0








