Бионанопора — инструмент для изучения белок-белковых взаимодействий
Исследователи сконструировали рекомбинантную бионанопору, с помощью которой не только точно измерили константу связывания рецептор-лиганд, используя единственную пару молекул, но и продемонстрировали возможность анализа низкоаффинных взаимодействий в такой паре, а также измерение констант связывания в очень сложных смесях.
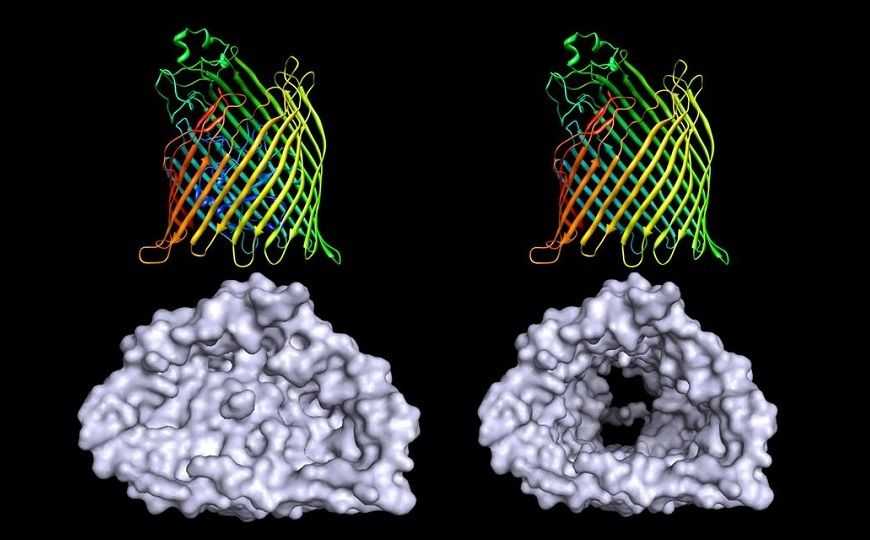
Устройства на основе нанопор для исследований в области биологии и химии за последние несколько лет превратились из лабораторных курьезов в рыночные продукты. Примером могут служить приборы британской компании Oxford Nanopore для высокопроизводительного секвенированияпротяженных (до сотен тысяч пар оснований) молекул нуклеиновых кислот. Основное преимущество нанопор — возможность оперировать единичной молекулой. При этом возрастает чувствительность и уменьшается «шум», неизбежно возникающий при измерении многих сигналов одновременно.
Одна из основных задач фундаментальной биологии и медицинской химии — измерение белок-белковых и белок-лигандных взаимодействий. Многие взаимодействия в организме низкоаффинны, как и взаимодействия прототипов низкомолекулярных лекарственных средств с мишенями, изучение их представляет большую сложность, не говоря уже об измерениях в составе сложных смесей.
Изучение белок-белковых взаимодействий (PPI) единичных молекул с использованием синтетических твердотельных нанопор возможно, но на данном этапе развития химии ковалентно связанный белок сложно ориентировать в нанопоре в строго определенном положении. Иное дело — биологическая нанопора, состоящая из трансмембранного белка, к которому можно генноинженерным путем присоединить изучаемый белковый лиганд или рецептор. Как правило, измеряют ток, протекающий через мембрану, и его изменения при связывании лиганда-мишени. Методы изготовления нанопор и реальные параметры используемой микрофлюидики обычно не публикуются, но общее устройство и принцип метода широко известны.
Исследователи из Сиракузского университета (США) сконструировали устройство на основе бионанопоры для измерения слабых белок-белковых взаимодействий. Пора сформирована липидной бислойной мембраной и погруженным в нее белком — импортером железосодержащих комплексов FhuA. Белок поры соединили гибким линкером с модельной РНКазой барназой, инактивированной точечной мутацией; гибкая связь обеспечивала рецептору барназы конформационную свободу. С барназой взаимодействовал ее ингибитор, небольшой бактериальный белок барстар, образуя очень прочный комплекс, для сравнительного изучения слабого связывания использовали низкоаффинный мутантный барстар. Авторам удалось выявить сигнал (электрический ток определенного направления и силы), при котором происходила ассоциация барназы и барстара и противоположно направленный ток иной силы, наблюдавшийся при их диссоциации.
По временной продолжительности измененного тока прямого или противоположного направления, исследователи рассчитали константу связывания в комплексе барназа-барстар. Данные соответствовали значениям, полученным ранее из альтернативных источников. Более того, при увеличении концентрации барстара до миллимолярной соотношение сигнал-шум не изменялось — это особенно важно для практических применений метода анализа PPI, таких как разработка лекарств.
Основные проблемы детекции низкоаффинных взаимодействий, регулирующих клеточные сигнальные пути, — высокая скорость диссоциации, низкая скорость ассоциации или то и другое вместе). Чтобы проверить возможности нанопоры, использовали мутантный барстар со значительно сниженной аффинностью. Даже при наномолярной концентрации барстара, наблюдался сигнал, свидетельствующий о формировании комплексов с константой связывания на два порядка меньшей, чем у барстара дикого типа. Классические биофизические методы, как правило, неспособны детектировать столь короткие взаимодействия. Кроме того, бионанопора позволяла одновременно детектировать связывание низко- и высокоаффинного вариантов.
Последнее по порядку, но не по важности наблюдение было сделано в эксперименте с анализом связывания в сложной смеси — фетальной сыворотке крови телят. Для этого использовали конструкт, в котором барназа и барстар были связаны пептидным линкером, а детектируемый барстар находился в смеси. Прямая детекция растворенного барстара в концентрированной смеси белков оказалась невозможной: по-видимому, молекулы смеси блокировали пору. Но когда пора большую часть времени была блокирована барстаром, ковалентно связанным с барназой, исследователям удалось детектировать события, в которых «ковалентный» барстар замещался растворимым. Удалось рассчитать и константу связывания, которая согласовалась с теоретической.
Технология бионанопоры исследователям не только надежно регистрировать связывание единственной пары молекул, но и «заглянуть» в ранее неизученную область PPI — в области коротких низкоаффинных взаимодействий и сложных смесей. Эта технология представляет большую ценность как для фундаментальной науки, так и для биомедицины и медицинской химии.


 Меню
Меню





 Все темы
Все темы




 0
0