Чувствительность к боли от перегрева у дрозофил контролируют два нейрона
Калифорнийские ученые описали клеточные и молекулярные механизмы регуляции ответа на боль от высоких температур у дрозофил. Авторы идентифицировали пару нейронов, которые активируются через термочувствительный ионный канал Painless. Их активация ведет к выбросу нейромедиаторного пептида AstC, а он, в свою очередь, снижает чувствительность к болевым стимулам.
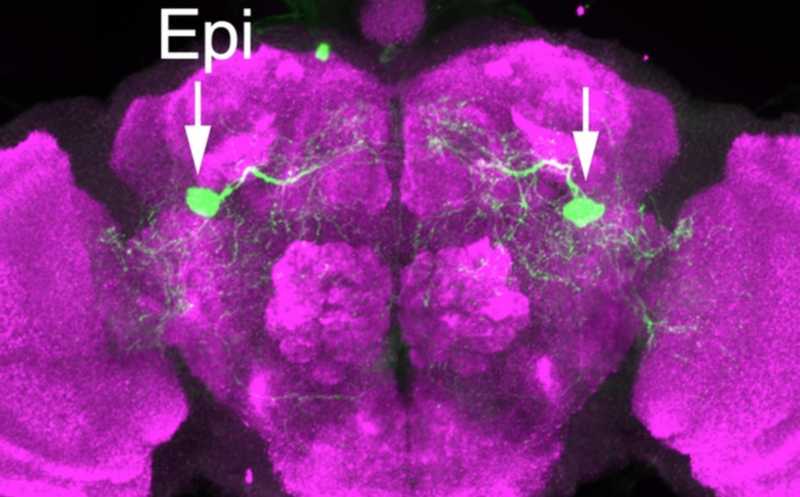
Epi нейроны, регулирующие болевую чувствительность дрозофилы.
Credit:
UC Santa Barbara
Эндогенные системы подавления боли имеют большой потенциал для терапии хронических болей. На человеке было показано, что в подавлении ноцицепции (физиологической боли) задействовано множество участков мозга и различные нейромедиаторы. В опытах на дрозофилах установили, что мембранный канал Painless, родственный TRP каналам, играет ключевую роль в восприятии теплового воздействия. Однако, конкретные нейроны, задействованные в управление ноцицепцией, до сих пор оставались не идентифицированными. В новой работе ученые из Калифорнийского университета в Санта-Барбаре описали пару нейронов, подавляющих передачу болевого сигнала, вызванного тепловым воздействием.
Авторы разработали специальную систему для оценки болевого ответа на тепловое воздействие. Дрозофил с ампутированными крыльями помещали на платформу, нагретую до определенной температуры, после чего замеряли процент подпрыгнувших в течение первых 10 секунд и среднее время до прыжка. В опытах с контрольной группой при температурах 29–30°С прыжки наблюдались у 17,2% мух. При температурах 38–44°С подпрыгивали почти все мухи (92,6–100%); при температурах выше 44°С — все мухи.
Для поиска нейронов, задействованных в регуляции ноцицепции, ученые использовали систему Gal4-драйверов. Она состоит из двух частей и служит для изучения роли генов и паттернов их экспрессии. Gal4 в такой системе экспрессируется под промотором гена, чью роль хотят изучить, а экспрессия Gal4, в свою очередь, способствует экспрессии репортерного белка. В данном случае под действием различных Gal4-драйверов, ассоциированных с интересующими ученых генами, экспрессировали специальный Na+ канал NaChBac. Такой подход позволяет обеспечить хроническую и специфичную активацию нейронов, в которых экспрессируется тот или иной ген. Изменение болевого ответа наблюдалось только для двух драйверов, ассоциированных с геном нейромедиатора AstC — AstC-Gal4-1 и AstC-Gal4-2. При активации нейронов, экспрессирующих AstC, наблюдалось значимое снижение процента прыгающих мух при температурах 45–46°С, а также увеличение задержки между помещением мухи на платформу и прыжком. Схожий эффект показали, используя оптогенетический подход: в линиях с AstC-Gal4-1 и AstC-Gal4-2 экспрессировали светочувствительные ионные каналы, которые затем стимулировали лазером.
Для идентификации конкретных нейронов, принадлежащих к этим двумлиниям, авторы экспрессировали маркерный зеленый флуоресцентный белок (GFP) под действием тех же самых Gal4-драйверов, после чего проводили анти-GFP окрашивание. Нейроны, несущие AstC-Gal4-1, присутствовали в большом количестве регионов мозга, в то время как к другой линии принадлежала всего одна пара крупных нейронов (хотя экспрессия AstC-Gal4-1 в них также наблюдалась). Авторы обозначили идентифицированную пару как Epione (Epi) нейроны в честь греческой богини Эпионы, облегчающей боль.
Далее исследователи изучили роль AstC в функции Epi нейронов. Для этого они сначала провели нокдаун AstC в Epi нейронах, а затем получили мутантов с нефункциональным AstC геном. В обоих случаях наблюдалось значимое увеличение числа подпрыгивающих мух. Такой же эффект наблюдался у мух с мутантными генами рецепторов к AstC.Оверэкспрессия AstC в Epi нейронах, напротив, снижала число прыгающих мух.
Следующим шагом стала проверка предположения, что Epi нейроны сами по себе способны чувствовать нагрев. Для этого в них искусственно экспрессировали Ca2+ сенсор GCaMP6f. Флуоресценция этого кальциевого сенсора позволяет отслеживать активацию нейронов. Авторы обнаружили две фазы активации в ответ на нагрев. Первая (слабая) наблюдалась при температурах 18–40°С; вторая (сильная) — при температурах выше 40°С. При такой тепловой активации наблюдалась экспрессия AstC.
Наконец, ученые протестировали роль Painless канала в функционировании Epi нейронов. Экспрессия Painless в Epi нейронах была подтверждена при помощи Gal4 драйверов и GFP окрашивания. Дальнейшие опыты показали, что утрата функции Painless препятствует активации Epi нейронов при температурах выше 40°С. При этом первая (слабая) фаза активации сохранялась. Среди мух, несущих мутантный Painless, также ожидаемо наблюдалось значимое повышение процента прыгающих мух и снижение задержки перед прыжком.
Таким образом, в работе описаны молекулярные и клеточные механизмы чувствительности к тепловой боли у дрозофил. Активация Epi нейронов через термочувствительный ионный канал Painless ведет к выбросу нейромодулятора AstC, снижающего болевой ответ. Авторы отмечают, что у личинок дрозофил мутации в Painless, наоборот, уменьшают чувствительность к высоким температурам. Таким образом, один и тот же ионный канал имеет противоположные функции относительно ноцицепции у личинок и взрослых насекомых.
Болевой сигнал передается быстрее, чем мы думали
Источник
Liu J. et al. Alleviation of thermal nociception depends on heat-sensitive neurons and a TRP channel in the brain // Current Biology, published May 17, 2023. DOI: 10.1016/j.cub.2023.04.055


 Меню
Меню





 Все темы
Все темы




 0
0








