CRISPR-Cas9 терапия снижает тяжесть синдрома Ангельмана у мышей
Частичное восстановление экспрессии белка UBE3A в клетках мозга при синдроме Ангельмана — генетически обусловленном нарушении развития нервной системы — возможно с помощью системы CRISPR-Cas9, нацеленной на длинную некодирующую РНК UBE3A-ATS. Инъекции вектора, несущего систему, в мозг модельным мышам на ранних стадиях развития облегчала симптомы заболевания.
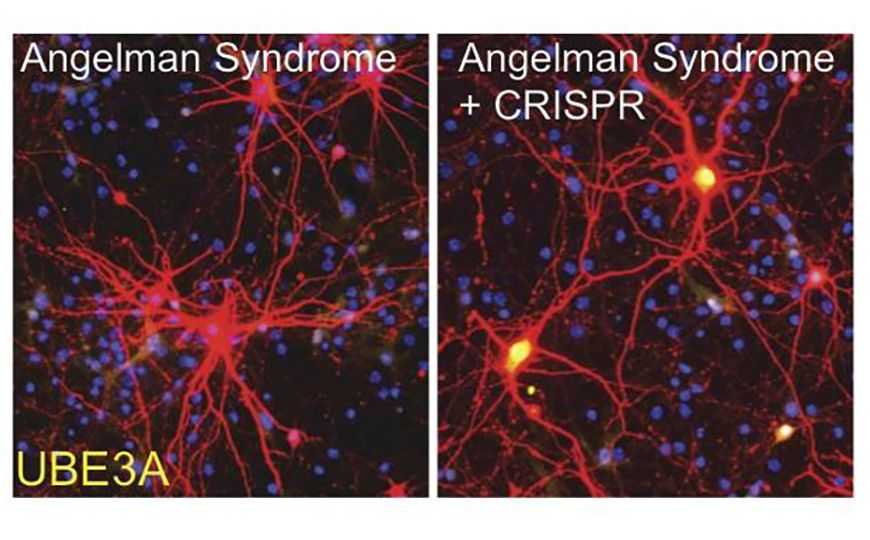
Синдром Ангельмана — это тяжелое нарушение развития нервной системы, связанное с мутацией или делецией в материнском аллеле гена UBE3A. Этот ген кодирует убиквитин-протеин лигазу E3A, которая участвует в деградации белков и поддержании нормальной функции клеток мозга. В нейронах экспрессия отцовского аллеля UBE3A подавлена длинной некодирующей РНК UBE3A-ATS, то есть при синдроме Ангельмана белок UBE3A в клетках мозга отсутствует. Это приводит к микроцефалии, интеллектуальным расстройствам, судорогам, проблемам с движением и сном. В настоящее время рассматривается возможность фармакологического ингибирования UBE3A-ATS, однако такой подход требует регулярных инъекций препарата, что нежелательно в случае наследственного заболевания. Авторы новой работы в Nature предлагают метод необратимого выключения экспрессии UBE3A-ATS с помощью мутагенеза, опосредованного системой CRISPR-Cas9.
Ученые синтезировали библиотеку гидовых РНК (gRNA), нацеленных на предположительные регуляторные последовательности в области гена Ube3a-ATS. Каждый вариант gRNA клонировали на отдельную плазмиду, несущую последовательность Cas9 бактерии Staphylococcus pyogenes (SpCas9), и трансфецировали плазмидами клетки мышиных кортикальных нейронов с флуоресцентной репортерной системой. Первичный скрининг показал, что репрессия отцовского аллеля UBE3A снимается при таргетировании комплексом SpCas9-gRNA кластера генов Snord115, кодирующего малые ядрышковые РНК. В ходе дальнейших экспериментов было установлено, что эффективность экспрессии отцовского Ube3a увеличивалась при одновременном внесении множества разрывов в последовательности-мишени. Эффективность системы SpCas9 с гидовыми РНК к SNORD115 была подтверждена на первичной культуре человеческих нейронов.
Для экспериментов in vivo на мышиной модели синдрома Ангельмана необходимо было упаковать последовательность Cas9 и гидовые РНК на один вектор на основе аденоассоциированного вируса (AAV). Емкость вектора ограничена, поэтому ученые заменили SpCas9 на Cas9 бактерии Staphylococcus aureus (SaCas9), так как ее последовательность короче на 1 т. п. о. AAV, несущий SaCas9 и примерно 75 гидовых РНК к различным мишеням Snord115, вводился в головной мозг мышам дважды: на стадии эмбриона со сроком развития 15,5 дней и мышатам в первый день после рождения.
Анализ головного мозга модельный мышей на 90-й день после рождения, проведенный с помощью вестерн-блоттинга, показал восстановление экспрессии UBE3A в коре головного мозга, гиппокампе и спинном мозге на 37%, 38% и 40% соответственно относительно контрольных мышей дикого типа. При этом изменений экспрессии генов Snord115 или паттернов сплайсинга их белковых продуктов не наблюдалось. Не было и побочных эффектов, таких как нейровоспаление или потеря предшественников нейронов гиппокампа. Мышей наблюдали до 17 месяцев, и все это время в их мозге сохранялась экспрессия UBE3A с отцовского аллеля.
Инъекции AAV с SaCas9 модельным мышам снимали анатомические и поведенческие признаки синдрома Ангельмана. В частности, масса мозга у них была выше, чем у мышей, не получивших вектор, что говорит о частичном устранении микроцефалии. Улучшались двигательные функции задних конечностей и контроль за положением тела в пространстве. Влияние инъекций вектора на когнитивные функции на мышиной модели проверить невозможно, однако в целом полученные данные говорят о возможности устранения многих симптомов заболевания на длительный период с помощью предложенной системы.
Секвенирование ДНК нейронов головного мозга мышей, получивших инъекцию AAV с системой SaCas9, и ОТ-ПЦР-анализ показали, что интеграция вектора в сайты-мишени нуклеазы приводит к нарушению транскрипции Ube3a-ATS, что и делает возможным экспрессию отцовского Ube3a.
«Результаты раннего лечения <мышей> многообещающие. Мы убедились, что можем облегчать симптомы синдрома Ангельмана у мышей, и теперь мы оптимизируем наш метод таким образом, чтобы он подходил и для людей», — говорит один из авторов исследования Джастин Уолтер, постдок Центра неврологии Университета Северной Каролины в Чапел-Хилл.
Источник
Wolter, J.M., et al. // Cas9 gene therapy for Angelman syndrome traps Ube3a-ATS long non-coding RNA. // Nature, published: 21 October 2020; DOI: 10.1038/s41586-020-2835-2
Цитата по пресс-релизу

 Меню
Меню





 Все темы
Все темы




 0
0








