Делеция, вызывающая повышенную общительность при синдроме Вильямса, подавляет развитие органоидов мозга
Для людей с синдромом Вильямса (делеция участка 7q11.23) характерны умственная отсталость и повышенная общительность. Дупликация же этого участка приводит к гипосоциальности и расстройствам аутистического спектра. Авторы работы, вышедшей в Cell Reports, изучили роль гена GTF2I, входящего в состав делетированного/дуплицированного участка, в развитии кортикальных органоидов мозга человека. Органоиды с делецией GTF2I были меньше, в них активнее шел апоптоз и менее активно экспрессировались гены, связанные с синаптической передачей сигнала.
При синдроме Вильямса, также известном как синдром «лица эльфа», помимо характерного внешнего вида, наблюдаются такие особенности, как умственная отсталость и повышенная общительность. В основе синдрома лежит делеция участка хромосомы 7 (7q11.23), который содержит 26–28 генов. Считается, что изменения в социальной активности связаны с потерей одной копии гена GTF2I, входящего в этот участок. Интересно, что дупликация этой области приводит к противоположному эффекту: носители такого синдрома гипосоциальны, у них выявляют расстройства аутистического спектра, социофобию и селективный мутизм. Авторы новой работы, вышедшей в Cell Reports, с помощью органоидов человеческого мозга выявили возможные причины нарушения развития мозга при делеции GTF2I.
Белковый продукт гена GTF2I функционирует не только в ядре, но и в цитоплазме клетки. Ранние исследования на животных показали, что гетерозиготная делеция GTF2I приводит к гиперсоциальности. Так, дрозофилы с делецией гена предпочитают питаться вместе, а мыши становятся дружелюбнее. Более того, считается, что изменения в гене, регулирующем активность GTF2I, могли повлиять на повышенную дружелюбность собак по сравнению с волками. Элисон Муотри из Калифорнийского университета в Сан-Диего, ведущий авторы исследования, описала GTF2I как «ген предубеждения». «Без него все в мире — твои друзья», — говорит она.
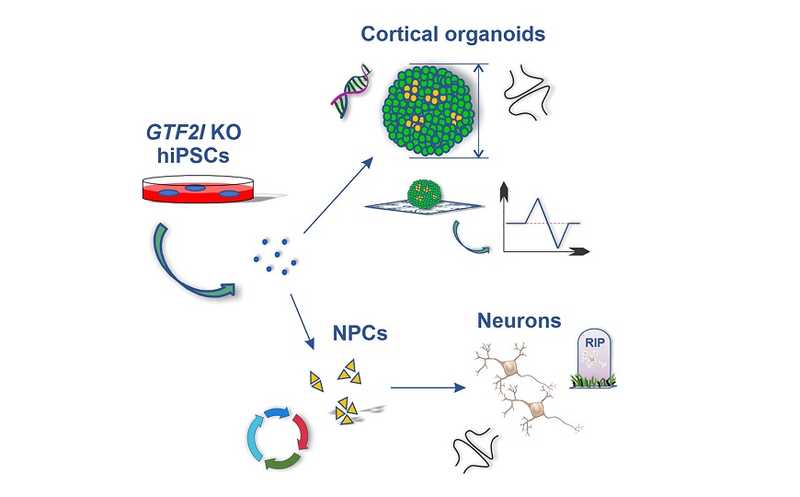
Чтобы исследовать, как GTF2I влияет на развитие головного мозга человека, авторы провели нокаут этого гена с помощью CRISPR-системы в клетках двух линий человеческих индуцированных плюрипотентных стволовых клеток (hiSPC). После этого стволовые клетки дифференцировали в нейрональные клетки и получили кортикальные органоиды. Сравнение транскриптомных профилей двухмесячных органоидов с нокаутом GTF2I и без показала значительное изменение в паттерне экспрессии генов: экспрессия 456 генов повысилась, а 404 — понизилась. Гены, экспрессия которых понизилась, были ассоциированы в том числе с синаптической передачей сигнала, в частности, посредством глутамата. Гены, экспрессия которых повысилась, были связаны с апоптозом.
Предыдущие исследования показали, что у мышей делеция GTF2I приводит к снижению массы мозга и толщины коры. Оказалось, что двухмесячные органоиды из hiSPC с нокаутом по GTF2I тоже уступали контрольным органоидам в размере, более того, в них интенсивнее шел апоптоз. Чтобы оценить, как делеция GTF2I влияет на клеточный цикл, выживаемость и пролиферацию, hiSPC с нокаутом GTF2I дифференцировали в клетки-предшественники нейронов (NPC). Оказалось, что экспериментальные NPC делятся быстрее, чем контрольные, и делеция GTF2I приводит к нарушениям в клеточном цикле, но не гибели клеток.
Дальнейшие исследования показали, что у нейронов, дифференцированных из NPC с делецией, снижена электрофизиологическая активность, а также экспрессия ряда белков, ассоциированных с синапсами: синапсина, VGlut1, Homer1.
Таким образом, белок GTF2I играет важнейшую роль в развитии головного мозга на всех стадиях дифференцировки нейронов. Авторы работы отмечают, что для полного понимания развития гиперсоциальности у пациентов синдромом Вильямса необходимо изучить взаимодействие GTF2I с другими генами, входящими в состав делетированного участка хромосомы 7.
3D-органоид нервной трубки поможет отследить раннее развитие ЦНС
Источник:
Jason W. Adams, et al. Loss of GTF2I promotes neuronal apoptosis and synaptic reduction in human cellular models of neurodevelopment // Cell Reports, published February 27, 2024, Vol. 43, Issue 3, DOI: 10.1016/j.celrep.2024.11386








 Меню
Меню





 Все темы
Все темы






 0
0