Иван Шатский: «Ученый-исследователь — человек свободный»
Рибосома, молекулярная машина для производства белков в клетке, как известно, неисчерпаема. Схемы трансляции — синтеза белка на матричной РНК — вошли в школьные учебники, но детали этого процесса изучаются до сих пор. Об этом направлении молекулярной биологии и его истории рассказывает заведующий лабораторией регуляции белкового синтеза НИИ физико-химической биологии А.Н. Белозерского МГУ Иван Николаевич Шатский.

Иван Николаевич Шатский, доцент МГУ, доктор химических наук, член Европейской академии наук
Геология — химия — биология
Я родился 4 октября 1942 года в Башкирии, в Уфе. Семью нашу эвакуировали, когда немцы уже стояли под Москвой. Но в Уфе я и года не пробыл. Как только немцев погнали, нас тут же вернули обратно, так что в 1943-м мы уже были опять в Москве.
Отец мой — Николай Сергеевич Шатский, выдающийся геолог, тектонист (тектоника — это наука о движении земной коры.) Его именем названа огромная подводная платформа в Тихом океане к востоку от Японии: Shatsky Rise, Поднятие Шатского. Он преподавал в Московском геологоразведочном институте, возглавлял Геологический институт АН СССР. У него было много известных коллег, включая отца академика Богданова — тоже Алексея Алексеевича Богданова, геолога. Отец был ярким представителем своей профессии.
Почему я не пошел по стопам отца и не стал геологом? Во-первых, я вообще старался быть в этом вопросе самостоятельным. А во-вторых, хотя папа очень хотел, чтобы я тоже был ученым (он вообще интересовался разными науками), он не хотел, как мне кажется, чтобы я был геологом. Может быть, потому что его сын от первого брака стал геологом, но совсем не достиг таких высот, как отец.
Отец умер скоропостижно, в 1960-м, мне было 18 лет. В день смерти отца, первого августа, я сдавал первый экзамен на химфак МГУ, сочинение. Я еще не знал, что отец умер. Иначе не знаю, смог бы сдавать или нет. Умер он на даче на Николиной Горе. Незадолго до своей смерти отец мне рассказывал, что есть вообще интересного в разных науках. В том числе — про безобразия с лысенковщиной и гонения на генетику. Так что я решил стать химиком.
Надо сказать, что я даже дома «баловался» химией, реакции ставил. Химия мне казалась интересной, увлекательной. Помню случай, когда к отцу пришли сотрудники из его института, а я в это время получал сероводород из какого-то сульфида, провонял всю квартиру.
То, что я стал химиком, как мне кажется, определило мои научные пристрастия и их дальнейшие трансформации. На четвертом-пятом курсе у меня пошел уклон в биологию. Но не в классическую, а в молекулярную биологию, то есть исследование живых клеток с точки зрения поведения макромолекул, биологических биополимеров, каковыми являются белки и нуклеиновые кислоты, ДНК и РНК.
Как раз в этот момент я, будучи еще студентом, пришел на кафедру химии природных соединений химфака, где работал Алексей Алексеевич Богданов-младший, который интересовался структурой рибосом — частиц, на которых синтезируются все белки в любых клетках животных и растений. Вот там, на кафедре химии природных соединений, и состоялся мой выбор: перейти из химии природных соединений в молекулярную биологию.
Где у рибосомы вход и выход?
Важным моментом в моем становлении как ученого было решение моего шефа А.А. Богданова отправить меня на короткую стажировку к Александру Сергеевичу Спирину, знаменитому нашему академику-биологу. Он как раз тогда очень интересовался структурой рибосом и механизмами синтеза белков в живых клетках.
Там, в лаборатории Института биохимии имени Баха, я много чего полезного узнал. И, наверное, именно тогда я всерьез заинтересовался структурой рибосом и тем, как эти фабрики белков работают.
Здесь, пожалуй, следует рассказать поподробнее, что такое рибосома и что она делает. Как уже сказано, это своеобразная фабрика белков в клетке. На рибосомах синтезируются все белки клеток любого организма, а, например, в животных клетках насчитываются десятки тысяч разных белков. Среди них есть белки-ферменты, которые осуществляют разного рода химические реакции в организме, есть белки, которые формируют разные структуры в живой клетке, а есть белки-регуляторы, которые контролируют, сколько и каких белков должно производиться в данной клетке, в данный момент, на данной стадии ее роста или дифференцировки. Нарушение регуляции синтеза белков ведет к серьезным заболеваниям, в том числе онкологическим и нейродегенеративным. Напомню, рибосомы синтезируют разные белки согласно информации, которую в них приносят информационные биополимеры, а именно молекулы матричной РНК (сокращенно мРНК).
В 1965 году я окончил химфак МГУ, а в 1967 году стал младшим научным сотрудником созданной по инициативе академика А.Н. Белозерского Межфакультетской лаборатории биоорганической химии, которая позже была трансформирована в существующий и поныне НИИ физико-химической биологии А.Н. Белозерского МГУ. Работал в лаборатории уже упомянутого мною А.А.Богданова-младшего, ныне академика РАН. В этом Институте я работаю и по сей день, возглавляя лабораторию регуляции белкового синтеза.
 Научный коллектив лаборатории А.А. Богданова с гостями во время отмечания какого-то приятного события. И.Н. Шатский сидит справа, прикрыв лицо рукой, рядом с ним сам А.А. Богданов
Научный коллектив лаборатории А.А. Богданова с гостями во время отмечания какого-то приятного события. И.Н. Шатский сидит справа, прикрыв лицо рукой, рядом с ним сам А.А. Богданов
В конце 1960-х и в 70-е годы я занимался структурой рибосомы из бактериальных клеток, стараясь понять, как она устроена. Но никаких выдающихся достижений, о которых бы стоило здесь говорить, тогда достигнуто не было. Не слишком помогла моему творческому росту и десятимесячная стажировка в Париже в 1972–1973 гг. в лаборатории профессора Роже Монье, хотя впечатления от пребывания в этом городе, как нетрудно догадаться, остались яркими и в чем-то очень полезными.
Но я все еще оставался начинающим молекулярным биологом. Существенный сдвигом в моем становлении как молекулярного биолога и специалиста по рибосомам стало знакомство с электронным микроскопистом из пущинского Института белка Академии наук СССР Виктором Дмитриевичем Васильевым. Мы с ним сделали довольно значительную для тех времен работу, которая до сих пор не потеряла своего значения для понимания, как функционирует рибосома, когда она считывает информацию с цепочки связанной с ней мРНК.
Работа эта была о пути цепочки информационной мРНК через рибосому. Это было интересно. Тогда ничего не знали о том, как мРНК проходит через рибосому. А мы это как бы увидели. В лаборатории в Москве мы выделяли рибосомы и приготовляли препарат искусственной короткой мРНК. На каждый из двух концов этой короткой модельной мРНК мы по отдельности химически присоединяли динитрофенильную группу, а затем получили комплексы таких химически модифицированных мРНК с рибосомами. Потом мы отвозили в Пущино Васильеву эти препараты рибосом в комплексе с мРНК, модифицированной по одному из концов динитрофенильной группой. Он добавлял к этим препаратам антитела против динитрофенильной группы и делал снимки под электронным микроскопом.
А дальше все просто: Виктор Дмитриевич смотрел, где антитело контактирует с рибосомой, когда динитрофенильная группа находится на одном конце мРНК, и где — в том случае, когда такая же группа расположена на другом конце мРНК. Тем самым удалось увидеть на снимках как бы вход и выход мРНК на рибосоме.
Простая вроде бы затея, но она показала очень важные вещи. Она показала, что вход и выход мРНК на рибосоме находятся на самом деле недалеко друг от друга — другими словами, фрагмент мРНК, проходя через рибосому, делает петлю. Кроме того, мы сделали вывод, что мРНК лежит в специальном желобке. Эта работа была опубликована в 1983 году в журнале Европейского молекулярного биологического общества, очень престижного и тогда, и сегодня — EMBO Journal. У этого журнала до сих пор очень высокий рейтинг.
В какой момент я начал ощущать себя самостоятельным ученым? Наверное, тогда, когда была опубликована вот эта моя первая классная статья. Это до сих пор известная публикация. Она вошла в число достижений, за которые в 1986 году довольно большой группе ученых из Институтов АН СССР, включая, естественно, А.С. Спирина и В.Д. Васильева, а также А.А. Богданову и мне — из МГУ имени М.В. Ломоносова была присуждена Государственная премия. Вот тогда, как мне кажется, я уже окончательно и решил, что буду заниматься молекулярной биологией, то есть наукой о жизни с точки зрения функции биологических макромолекул. Именно молекулярной биологией, а не биохимией, которой, казалось бы, должен заниматься выпускник Химического факультета МГУ.
Напомню, что биохимия в основном изучает химические реакции, которые происходят внутри клетки, а молекулярная биология — это наука о биологических макромолекулах, биологических полимерах, то есть прежде всего о нуклеиновых кислотах и белках, о том, как они синтезируются в живых клетках, как функционируют и как соответствующие процессы регулируются. Я никогда не жалел, что выбрал эту профессию.
Вирусные РНК могут читаться не с начала
А новый рывок моей карьеры начался совершенно случайно, когда ко мне в лабораторию нагрянула Таня Пестова. Это случилось в 1993 году. Мне было уже 51, она была лет на 20 моложе. Она работала у Вадима Израилевича Агола, нашего выдающегося российского вирусолога. Он поручил Тане исследовать, каким образом рибосомы «узнают» и считывают РНК из полиовируса (вируса полиомиелита), как вирусная РНК конкурирует с мРНК инфицированной клетки и каким образом в этой клетке синтезируются преимущественно вирусные, а не клеточные белки. Нужно было выяснить сам молекулярный механизм этого процесса.
 Т.В. Пестова и И.Н. Шатский
Т.В. Пестова и И.Н. Шатский
Она занялась этим делом, но до ее прихода ко мне я ничего про это не знал, так как Татьяна работала в другом отделе Института, отделе взаимодействия вируса и клетки. Таня пришла и пожаловалась: «Иван Николаевич, что-то у нас ничего не получается!» Я Таню спрашиваю: «А что вы делаете?» Она рассказала, какие опыты они делали, используя бесклеточные системы. Я ее выслушал и сказал, что, на мой взгляд, они идут неправильным путем, и я бы делал все по-другому. Я сказал, что надо выделять отдельные компоненты, то есть участок вирусной РНК, предположительно взаимодействующий с рибосомой, и все клеточные белки, которые с ним ассоциированы, а потом собрать из них комплекс и показать, что он не только связывает 40S субчастицу рибосомы, но и помещает ее на стартовый кодон вирусной РНК. Она сказала: «О! Это хорошая идея!» Вскоре она вышла замуж за Кристофера Хеллена и уехала в Америку, где начала работать в Медицинском центре Университета штата Нью-Йорк в Бруклине по этой же тематике и по той же программе, которую мы с ней наметили.
К тому моменту было уже совершенно очевидно, что по сравнению с клеточными мРНК геномные РНК пикорнавирусов, к семейству которых относится полиовирус (он же вирус полиомиелита), используют совершенно особый механизм для привлечения рибосом (точнее, малых субчастиц рибосом, или 40S рибосом). У него даже уже имелось его собственное название — «механизм внутренней инициации». Только как этот механизм работает и чем он отличается от механизма, используемого клеточными мРНК, никто понятия не имел.
Здесь как раз следует рассказать или напомнить читателю про общий механизм первичной посадки рибосом на мРНК клеток эукариот, а значит и животных. У клеточных мРНК все начинается с первого нуклеотида цепочки мРНК, с так называемого 5'-конца. Этот 5'-концевой нуклеотид еще во время синтеза мРНК в ядре клетки модифицируется группой m7Gppp; эта группа называется кэпом (по-английски cap). Когда мРНК оказывается в цитоплазме, кэп специфически связывает небольшой белок eIF4E, а тот специфически взаимодействует с большим белком eIF4G1 (молекулярная масса 170 кДа), который, в свою очередь, привлекает и связывает малую субчастицу рибосомы (40S) по цепочке следующих основных взаимодействий: eIF4G1— фактор инициации eIF3 — 40S рибосома.
Белок eIF4G1 играет важную, если не сказать ключевую роль в инициации синтеза белка у эукариот, от одноклеточных до млекопитающих: он не только, как только что сказано, сажает 40S рибосомы на 5'-концы клеточных мРНК, но он же позволяет затем 40S рибосомам начинать двигаться по цепи мРНК в сторону другого конца мРНК (3’-конца) и искать по дороге стартовый кодон (обычно AUG) закодированного белка.
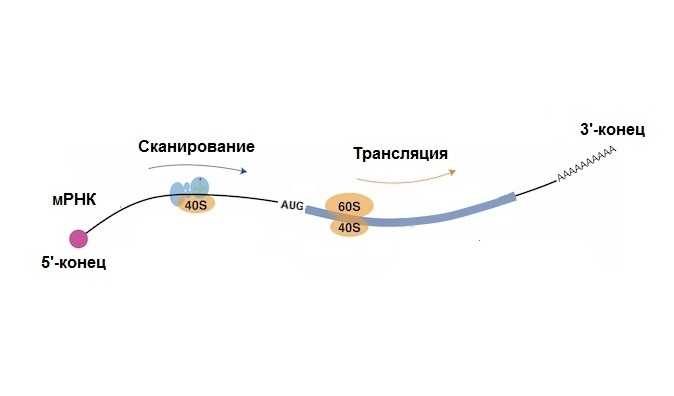 Упрощенная схема сканирования рибосомой мРНК. Желтым обозначены субчастицы рибосомы, малая (40S) и большая (60S). Светло-голубым — белковые факторы, необходимые для сканирования. По: EMBO J. (2023). DOI: 10.15252/embj.2022112869
Упрощенная схема сканирования рибосомой мРНК. Желтым обозначены субчастицы рибосомы, малая (40S) и большая (60S). Светло-голубым — белковые факторы, необходимые для сканирования. По: EMBO J. (2023). DOI: 10.15252/embj.2022112869
Другими словами, благодаря eIF4G1 рибосома едет по цепи мРНК и ищет стартовый кодон, откуда она должна начинать считывать информацию, заложенную в нуклеотидной последовательности мРНК, и синтезировать белок. Этот процесс называется сканированием. Причем у животных эта 5' конец-прилежащая некодирующая (и, следовательно, нетранслируемая область, 5' НТО) может покрывать очень длинные нуклеотидные последовательности, от несколько сот до тысячи и более нуклеотидных звеньев).
 Пластилиновая модель 40S субчастицы рибосомы. Конечно, это очень общий вид сложнейшего механизма белкового синтеза
Пластилиновая модель 40S субчастицы рибосомы. Конечно, это очень общий вид сложнейшего механизма белкового синтеза

И вот рибосома едет (сканирует) и ищет, где начало нуклеотидной последовательности, кодирующей белок. Находит — и начинает синтезировать белковую цепь. Только так работает подавляющее большинство клеточных мРНК у всех эукариот. Включая и РНК многих РНК-вирусов, например, РНК из коронавирусов, в том числе SARS-CoV-2, вызывающего ковид.
В научной литературе этот механизм называется «кэп-зависимый сканирующий механизм инициации трансляции». Некоторые клеточные мРНК при определенных условиях могут обходиться без первоначального связывания с кэпом, хотя все равно и в этом случае поиск стартового кодона начинается с самого 5’-концевого участка 5’-НТО. О таких нестандартных случаях будет рассказано поподробнее дальше.
Место посадки рибосомы. Возможны варианты
К началу нашей совместной работы с Татьяной Пестовой и Кристофером Хелленом, ее мужем и руководителем лаборатории в Бруклине, было уже точно известно, что в случае семейства пикорнавирусов, к которому относятся, в частности, вирусы полиомиелита и энцефаломиокардита, которые мы выбрали для исследования, способ связывания их геномных мРНК с рибосомами совершенно другой, чем только что описанный механизм для мРНК, инфицируемых этими вирусами клеток.
 Кристофер Хеллен, муж Т.В. Пестовой и руководитель лаборатории в Бруклине, где она работает, (крайний справа)
Кристофер Хеллен, муж Т.В. Пестовой и руководитель лаборатории в Бруклине, где она работает, (крайний справа)
И это понятно, ведь упомянутые вирусы должны иметь свой собственный механизм, чтобы не зависеть от клеточных механизмов, а наоборот, мешать клеточным мРНК работать. Это позволяет им расходовать клеточные ресурсы для синтеза своих вирусных белков, обрекая в конце концов инфицированные клетки на гибель. Было известно, что у этих вирусных РНК рибосомы не садятся на 5’-концы РНК. Они используют упомянутый выше механизм внутренней инициации: 40S рибосомы связываются со специальными «участками внутреннего связывания рибосом» (Internal Ribosome Entry Site, IRES), которые находятся существенно дальше от 5’-концов вирусных геномных мРНК.
Местоположение нуклеотидных последовательностей участков внутреннего связывания рибосом для РНК указанных выше вирусов было приблизительно известно. Но необходимо было уточнить их границы, их вторичную структуру и, главное, идентифицировать, какие клеточные белки они связывают и какие функции эти белки выполняют, будучи связанными с вирусными IRESами.
Нам удалось выделить и очистить эти белки и собрать активные IRESы из РНК и белков. Наконец, мы показали, как эти собранные нами РНК-белковые комплексы работают, то есть каким образом 40S рибосома связывается с IRESом и как она потом узнает находящийся по соседству стартовый AUG-кодон и инициирует синтез вирусных белков. Тем самым, мы расшифровали молекулярный механизм работы IRESов для РНК вирусов энцефаломиокардита и полиомиелита. Важно подчеркнуть, что финалом нашей работы были не просто умозаключения, какими часто грешат современные авторы многих опубликованных работ по молекулярным механизмам, а мы просто воссоздали из отдельных очищенных компонентов аппарат для инициации синтеза вирусных белков. Сегодня очень редко кто берется за такие проекты, слишком много работы, к тому же надо иметь опыт в очистке и выделении белков и РНК, а результат не гарантирован. Проще сделать какие-то наблюдения, получить какие-то эффекты, пофантазировать — и вот статья готова!
Потом мы взялись за аналогичные исследования участка внутреннего связывания рибосом у известного всем вируса гепатита С. Там устройство IRES-элемента совершенно не похоже на IRES-элементы пикорнавирусов. Фактически там IRES-элемент устроен таким образом, что рибосома сразу же садится на стартовый кодон вирусной РНК, то есть совсем как бы не ищет его по соседству с IRESом. Другими словами, стартовый кодон для синтеза вирусных белков является частью самого IRESа вируса гепатита С.
У меня была виза на несколько лет, я периодически летал в Нью-Йорк, мы отлично взаимодействовали. В результате мы опубликовали на эту тему пять статей.
Первая статья вышла в 1997 году, и в 2001-м — последняя, представлявшая собой обзор по проведенным исследованиям. Там можно найти ссылки на четыре предыдущие статьи. В ней были также описаны все известные к тому моменту механизмы связывания мРНК с рибосомами. В статье мы еще раз все объяснили: как расшифровали механизмы внутренней инициации и как воспроизвели их в очищенной системе.
На эти статьи у нас с Таней, Крисом Хелленом и нашими соавторами сейчас уже более двух тысяч ссылок. Важно отметить, что за прошедшие годы нас никто существенно не поправил: структура IRESов для разных вирусов, как 40S рибосома с ними связывается, как она инициирует и начинает синтезировать вирусные белки – все осталось так, как и было нами предложено. Сегодня эти результаты выглядят почти классикой, особенно если учесть, что прошло почти четверть века.
Загадки «фабрики белкового синтеза», разгаданные и неразгаданные
Имело ли это практическое значение? Я считаю, что истинные знания всегда практичны. Столкнется человечество с новым вирусом того же семейства — хорошо, что оно уже знакомо с внутренним механизмом посадки рибосомы на вирусную РНК. Уже будет, на что опереться. Вот у коронавируса механизм узнавания рибосомами вирусной РНК другой, он ближе к клеточному. Но и там надо разбираться. Там есть свои особенности. Но это нормально: любой вирус должен реплицироваться не совсем так, как делают мРНК инфицируемых им клеток.
Да, это чисто научные знания о том, как устроен вирус, но я совершенно уверен, что это никогда не лишнее. Вот энтеровирус-71 (EV71), вирус из того же семейства, что и полиовирус — о нем мало что было известно, он сейчас гуляет где-то в Азии и угрожает пандемией. А теперь хотя бы есть на что опереться. Для познания мира вирусов наши работы были существенным шагом вперед. За эти работы мне присудили в 1999 году Ломоносовскую премию.
 Ректор МГУ В.А. Садовничий вручает И.Н. Шатскому диплом лауреата Ломоносовской премии (1999)
Ректор МГУ В.А. Садовничий вручает И.Н. Шатскому диплом лауреата Ломоносовской премии (1999)
Так получилось, что мы разошлись с Татьяной Пестовой и Кристофером Хелленом где-то вскоре после того, как опубликовали в 2001 году упомянутую выше обзорную статью в журнале PNAS. О причинах окончания сотрудничества с этой лабораторией говорить здесь не хочется — у них нет научных обоснований. После этого Татьяна с Крисом и их сотрудниками опубликовали еще несколько интересных работ по другим вирусам. У Пестовой в настоящее время очень высокий персональный рейтинг: индекс Хирша 67, при всего 98 статьях, опубликованных за всю карьеру!
Частые приезды в Нью-Йорк во время сотрудничества с лабораторией Пестовой и Хеллена помогли мне наладить контакты и с другими лабораториями на востоке США. Уже после прекращения сотрудничества с Пестовой и Хелленом в начале 2000-х я подружился и начал сотрудничать с лабораторией известного молекулярного биолога США, специалиста по механизмам синтеза белка у животных, Уильяма Меррика. Он работал в Кливленде, штат Огайо, в Case Western Reserve University (CWRU). Помимо общих научных интересов, меня связывала с Биллом Мерриком и его женой Мартой просто человеческая дружба. Во время своих визитов в Кливленд я жил у них, в их собственном коттедже, и в моем распоряжении был весь второй этаж дома.
 И.Н. Шатский в гостях у своего коллаборатора, известного американского молекулярного биолога Уильяма Меррика, его жены Марты и их маленького сына Стивена. Кливленд, штат Огайо, США, 2000-е годы.
И.Н. Шатский в гостях у своего коллаборатора, известного американского молекулярного биолога Уильяма Меррика, его жены Марты и их маленького сына Стивена. Кливленд, штат Огайо, США, 2000-е годы.
Мы тогда изучали функцию в инициации трансляции малоизученного белкового фактора, который может доставлять транспортную РНК с прикрепленной к ней аминокислотой (аминоацил-тРНК) строго в Р-участок рибосомы, но не требует для этого связывания и расщепления ГТФ. Мы назвали этот фактор eIF2D. Его функция пока остается не совсем понятной, но он периодически «всплывает» в современных публикациях, и эта наша совместная работа хорошо цитируется.
Также мы продолжали какое-то время в моей лаборатории в Москве работы по IRES-элементу вируса полиомиелита, поскольку там оставались вопросы, на которые хотелось получить ответ. Наиболее интригующим из них было открытое нами участие в функционировании этого IRESa стандартного клеточного фермента, глицил-тРНК-синтетазы (GARS). Как хорошо известно, аминоацил-тРНК синтетазы, к которым относится GARS, — это ферменты, которые навешивают аминокислоты на соответствующие транспортные РНК. Для специфического связывания со своей тРНК синтетазы должны «узнать» ее антикодоновый стебель.
Как мы выяснили, IRES РНК полиовируса содержит в своем составе структурный элемент, похожий на антикодоновый стебель глициновой тРНК, и даже точечная мутация «антикодона» этого стебля, как показал сотрудник нашей лаборатории Дмитрий Андреев, приводит к резкому ухудшению работы IRESа полиовируса. К большому сожалению, мы так и не довели эту работу до конца, чтобы установить, что делает GARS, когда он связан с IRESом РНК полиовируса. Но планируем заняться этой работой в будущем, как только появится в нашем коллективе кто-нибудь с хорошими руками, кто заинтересуется этой проблемой.
С тех пор и по сей день я продолжаю интересоваться тем, как рибосомы находят место для связывания с мРНК и как они ищут, где именно надо начинать считывать информацию для синтеза белковой цепи. Я считаю, что это очень важно.
IRESы в клеточных мРНК: никто не видел, но многие верят
Хочу упомянуть поучительную историю о «псевдо IRESах» у клеточных мРНК в статьях по механизмам белкового синтеза, опубликованных за последние 20 лет, и нашей отчаянной борьбе с этими фантазиями. Дело в том, что в конце 1990-х и в первые два десятилетия этого столетия тема IRESов стала очень модной среди ученых, занимавшихся механизмами регуляции синтеза белка. Появилась идея, активно поддержанная многими исследователями, что некоторые клеточные мРНК также могут использовать IRES-элементы для первичной посадки рибосом на свои 5’-НТО.
Откуда взялась эта идея? Дело в том, что, как уже описано выше, все клеточные мРНК имеют кэп на своих 5’-концах, который связывает 40S рибосомы через цепочку взаимодействий специфических белковых факторов eIF4E — eIF4G1 — eIF3, после чего начинается сканирование 5’-НТО мРНК. В зависимости от условий роста клетки умеют регулировать этот процесс, используя специальный белковый репрессор фактора eIF4EBP, что приводит к резкому падению инициации трансляции.
Однако было обнаружено, что степень блокировки посадки 40S рибосомы на 5’-конец мРНК таким репрессором фактора eIF4E — очень разная для разных мРНК. Функция одних мРНК подавляется почти полностью, тогда как другие подавляются значительно слабее, а некоторые показывают довольно низкую кэп-зависимость (т.е. зависимость от наличия кэпа на 5’-конце мРНК). Тут же быстренько возникла гипотеза: это из-за того, что последние имеют что-то вроде IRESов в пределах своих 5'- НТО и вообще не используют первоначальную посадку 40S рибосом на кэпированный 5’-конец мРНК.
При этом многие авторы гипотезы даже не пытались проводить детальные исследования, чтобы выяснить, где этот IRES расположен в изучаемой РНК и как он устроен, то есть не пытались проводить опыты, которые ранее проводились нами для характеристики вирусных IRES-элементов.
Мы опубликовали две работы в ведущих журналах (1, 2), пытаясь образумить фантазеров, но эффект был довольно скромный. В этих критических статьях мы объясняли, какие тесты должны быть поставлены и какие результаты должны быть получены, чтобы можно было говорить о существовании IRESов в 5'- НТО исследуемых клеточных мРНК. Один из таких решающих тестов — это четкое свидетельство о полной автономии работы истинного IRES’а: он должен связывать рибосому и инициировать синтез белка независимо от того, в какое место нуклеотидной последовательности 5'- НТО вы его вставили.
Мы также пытались объяснить, что внутренняя инициация — не единственный механизм, который может приводить к независимости инициации трансляции от наличия кэпа. Другим механизмом кэп-независимости входа рибосом на мРНК может быть существование в 5’-проксимальном участке 5'- НТО структуры, которая называется кэп-независимым трансляционным усилителем (Cap-Independent Translational Enhancer, или CITE).
Мы постоянно подчеркиваем, что мы совершенно не против самой идеи существования истинных IRESов не только в вирусных, но и в клеточных мРНК, но мы за то, чтобы существование таких структур было строго экспериментально доказано. В настоящее время голоса сторонников клеточных IRESов в Европе и Америке поутихли, зато они возникли и размножаются в Китае, в котором молекулярная биология становится все более популярной.
eIF4G2 и «смена лошадей» в долгом пути по мРНК
Незадолго до массового распространения идеи о существовании клеточных IRESов у высших эукариот был открыт ген гомолога фактора eIF4G1, который сейчас носит официальное название eIF4G2. Оказалось, что eIF4G2 — это сильно укороченный с N-конца вариант фактора eIF4G1, в связи с чем он не способен принимать участие в узнавании и связывании кэпа, но сохраняет способность обеспечивать движение 40S рибосомы при сканировании в поисках стартового кодона.
Сторонники клеточных IRESов тут же решили, что поскольку eIF4G2 не узнает кэп, он-то и принимает участие в работе клеточных IRESов, во всяком случае в работе некоторых из них. Факт существования у высших эукариот фактора eIF4G2 (у одноклеточных эукариот, например, дрожжей, его нет) и голословное приписывание ему роли обслуживания клеточных IRESов показались нам настолько важными, что мы на время приостановили все другие работы и в 2019 году занялись функцией этого загадочного белкового фактора. Пять лет спустя результаты оправдали наши самые амбициозные ожидания.
К тому моменту, когда мы начали эксперименты по выяснению функции eIF4G2, существовал уже список мРНК, белоксинтезирующая активность которых сильно стимулировалась наличием в клетках этого белка. Однако через некоторое время было сделано еще одно важное открытие, неприятное для сторонников клеточных IRESов: практически все эти eIF4G2-зависимые мРНК использовали кеп-зависимый способ посадки 40S рибосом на 5'- конец мРНК, то есть требовали наряду с фактором eIF4G2 канонический фактор eIF4G1. Еще раз напомню, eIF4G2 связываться с кэпом не может. eIF4G1 используется для первоначальной посадки 40S рибосомы на 5'-конец мРНК. Зачем же тогда нужен еще и «укороченный» фактор eIF4G2?
А нужен он, как мы показали, для преодоления разного рода сбоев при сканировании очень длинных 5'- НТО у животных. Один из сбоев может происходить из-за наличия в этих 5'- НТО так называемых коротких рамок считывания (uORFs), на которых идет синтез каких-то коротких пептидов. Столкновение сканирующих 40S рибосом с 80S рибосомами, считывающих эти uORFs, приводит, по-видимому, к разрушению сканирующих 40S рибосом и диссоциации из них фактора eIF4G1.
Вот в этот момент, как мы показали, и приходит на помощь eIF4G2 — заменяет отвалившийся eIF4G1 и позволяет сканирующим 40S рибосомам продолжить свое движение к главному стартовому кодону для кодируемого данной мРНК белка. Этот механизм мы назвали «механизмом смены лошадей» (change of horses mechanism).
Но это оказалось только началом интригующей истории. Мы нашли также мРНК, которые сильно зависят от наличия в клетках фактора eIF4G2, но в которых вообще нет коротких рамок считывания (uORFs). Зато их GC-богатые 5'- НТО содержат очень стабильные вторичные структуры, которые должны быть помехой на пути сканирующих 40S рибосом. Это последнее предположение будет экспериментально проверено нами в ближайшее время, и мы почти уверены, что оно подтвердится.
Кстати, пока мы не нашли ни одного свидетельства участия eIF4G2 в работе предполагаемых клеточных IRESов. Впрочем, мы не знаем и ни одной доказанной структуры клеточного IRESа, хотя клеточным IRESам за последние два десятилетия посвящены десятки работ в весьма солидных журналах.
И на этом сюрпризы со стороны фактора eIF4G2 не закончились. В 2020 году в журнале PNAS была опубликована наша совместная статья с дружественной нам лабораторией Павла Баранова (Корк, Ирландия) об удивительных свойствах мРНК PolG, кодирующей каталитическую субъединицу ДНК-полимеразы митохондрий. Оказалось, что эта мРНК обладает поразительным свойством двойного кодирования, то есть способностью считывать с одних и тех же нуклеотидных последовательностей, но в разных рамках считывания, части двух разных белков — собственно белка PolG и белка с пока неизвестной функцией размером около 30 kDa, названный нами POLGARF (PolG Alternative Reading Frame). Способность к двойному кодированию обеспечивают как раз особые свойства фактора eIF4G2.
Фактору eIF4G2 посвящены наши самые последние публикации, 2022–2023 гг. (1, 2, 3).
Не только укороченный eIF4G1
Работа над функцией eIF4G2 открыла нам глаза на наши довольно скудные сегодняшние знания о процессе сканирования 5'- НТО у мРНК животных. Не понимаю, почему этот факт так мало беспокоит современных молекулярных биологов. Пока нам точно известно только то, что рибосома садится на 5'-конец клеточных мРНК с помощью специальных белковых факторов и потом начинает ехать, как паровозик, с помощью белка eIF4G1. Но надо еще раз напомнить, что 5'-НТО, особенно у животных — это, скорее всего, не гладкая дорога. Здесь должны попадаться какие-то структурные препятствия, потому что РНК — это все-таки полинуклеотид, состоящий из A, U, G, и C нуклеотидов, а следовательно, там могут формироваться «шпильки» вторичной структуры, и это может быть тормозом для сканирующей 40S рибосомы. Кроме того, как сказано выше, там попадаются короткие рамки считывания (uORFs), которые являются помехой для сканирующих рибосом. Тем более если учесть, что длина 5'- НТО у мРНК животных может достигать нескольких сотен, а иногда и тысяч нуклеотидов.
И хотя, как фактор eIF4G1, так и фактор eIF4G2 несут на себе фермент хеликазу, расплетающую такие шпильки, некоторые РНК-белковые структуры могут оказаться хеликазам не по зубам. Существование в клетках животных белкового фактора eIF4G2 наряду с eIF4G1 как раз четко показывает, что такие помехи действительно существуют и некоторые из них преодолеваются с помощью eIF4G2.
А кто сказал, что на 5'- НТО не сидят какие-то высокоаффинные регуляторные белки? Тогда клетке нужно обеспечивать их диссоциацию, чтобы 40S сканирующая рибосома могла достичь стартового кодона? В животной клетке множество разных РНК-связывающих белков, и представить себе, что где-нибудь кто-нибудь из них не липнет, причем специфически, тем самым регулируя это путешествие, тормозя рибосому или, наоборот, давая ей возможность пройти дальше, довольно трудно.
Другими словами, при планировании соответствующих экспериментов надо возвращаться к составным бесклеточным системам, с которыми мастерски работали молекулярные биологи вплоть до последних десятилетий прошлого века и начала нынешнего столетия. В частности, выдающийся американский молекулярный биолог Мэрилин Козак, одна из главных открывателей сканирующего механизма инициации трансляции эукариот, сделала свои открытия в основном с помощью пробирочных опытов. По моему мнению, придется возвращаться к подобным рода экспериментам.
Надо приготавливать в необходимых количествах индивидуальные репортерные мРНК с различными 5'- НТО, разные частично обогащенные белковые фракции из полирибосом, очищенные 40S субчастицы рибосом, из этих препаратов приготавливать модельные системы сканирования. А дальше пытаться изолировать из таких систем индивидуальные мРНК, нагруженные РНК-связывающими белками, пытаться эти РНК-белковые комплексы частично очищать от случайно налипших белков и, наконец, идентифицировать с помощью протеомики белки, специфично взаимодействующие с каждым из исследуемых 5'- НТО. Только так можно выяснить, как эти белковые факторы влияют на процесс сканирования.
Сейчас в мире, я полагаю, мало кто захочет делать такие пробирочные эксперименты. Рассуждения здесь простые: «Зачем так убиваться? Слишком много возни!»
В основном в публикациях нашего времени описываются всякие эффекты и влияния, и этого оказывается достаточно для их появления в самых авторитетных журналах. Охотников расшифровывать молекулярные механизмы только что описанным путем стало очень мало, если они вообще есть. В основном в нынешних публикациях описывается, что происходит в клетках после определенного на них воздействия, а ответа на вопрос, КАК это происходит, нет! С пробирками возиться никто не хочет, если и так можно хорошо опубликоваться.
«Безумно интересно — добывать новые сведения о том, как устроена жизнь»
Мы попытаемся внести диссонанс в эту ошибочную тенденцию. Почему мне кажется важно вернуться к старым добрым пробирочным экспериментам? Почему я лично зацепился именно за это направление в дальнейших исследованиях механизмов белкового синтеза у животных, то есть выяснение механизмов сканирования 5'- НТО? Потому что только этим путем можно ответить на вопрос, существуют ли специфические особенности сканирования у индивидуальных 5'- НТО или небольших групп 5'- НТО. Это может иметь очень важное значение для медицины.
А какое? Прежде всего, это может быть полезным для поиска новых путей лечения онкологических болезней. Из того, что я знаю, для разных раков набор мРНК, которые активируются, разный! И не только по сравнению с нормой, но даже один рак от другого отличается. Что значит «активируются»? Это значит, что такие мРНК начинают более производительно работать. И вполне вероятно, что у них каким-то образом облегчается стадия сканирования, то есть у них включаются или усиливаются механизмы преодоления препятствий при сканировании.
Другая медицинская проблема — нейродегенеративные болезни, в частности, амиотрофный боковой склероз и лобно-височная деменция, при которых синтезируются мусорные белки, нарушающие нормальное функционирование аппарата биосинтеза белка в определенных группах нейронов. Здесь можно поискать способы, препятствующие их синтезу еще на стадии сканирования 5'- НТО соответствующих матриц.
В последние десятилетия появились очень эффективные технологии нового поколения для транскриптомики и протеомики. Эти технологии безумно полезны. Они оказываются незаменимыми, когда исследователь только начинает свои поиски и пытается сфокусировать свои исследования на конкретной проблеме. Но когда фокус исследований уже определен, например, определен набор мРНК, регуляция экспрессии которых на стадии сканирования должна быть прояснена, вот тогда, как мне кажется, необходимо переходить к старым добрым методикам молекулярной биологии, то есть создавать из очищенных компонентов модельные системы с индивидуальными мРНК, в которых бы воспроизводился процесс сканирования конкретных 5'- НТО, и затем выделять обратно из таких систем комплексы индивидуальных мРНК с белками. И идентифицировать эти белки и места их связывания в пределах конкретной 5'- НТО. Только так можно расшифровать молекулярные механизмы синтеза белка, в нашем случае на стадии сканирования. Иначе невозможно вскрыть молекулярные механизмы этого процесса. Так что, похоже, придется этим заняться мне самому, и я буду искать единомышленников.
Здесь вполне может возникнуть вопрос, а где же мои ученики и есть ли они? О том, кто из более молодых сотрудников, работавших со мной в разные времена, считает себя моим учеником или ученицей, как мне кажется, лучше спросить у них. Почти все молодые исследователи, которые работали со мной в 1990-е годы и в начале 2000-х, давно работают в зарубежных лабораториях, в основном в США, и кроме того, большинство из них сменили фокус исследований. Позже со мной работали очень талантливые и опытные исследователи И.М. Теренин, Д.Е. Андреев и С.Е. Дмитриев. Из них только И.М. Теренин, ведущий научный сотрудник нашего института, еще работает в моей научной группе, и как раз в основном с ним и моей аспиранткой Катей Шестаковой мы сделали последние работы по функциональной роли фактора eIF4G2 в клетках млекопитающих, о которых рассказывалось выше. С.Е. Дмитриев ныне возглавляет отдел взаимодействия вируса и клетки в нашем Институте и с нами по науке он больше не взаимодействует.
 Илья Михайлович Теренин
Илья Михайлович Теренин
По-прежнему очень близкие научные интересы у меня с Дмитрием Андреевым, и мы с ним активно сотрудничаем. Но он возглавляет лабораторию в Институте биоорганической химии имени М.М. Шемякина и Ю.А. Овчинникова РАН, следовательно, у него есть и другие обязательства. Студентки, работавшие с нами в последние годы, уехали делать карьеру в зарубежные лаборатории. Исключительно талантливая аспирантка Екатерина Шестакова после блестящей защиты кандидатской диссертации в феврале 2024 ушла работать в фармацевтическую компанию. Так что, увы, наблюдается серьезный дефицит обученных молодых исследователей, и надо растить новых.
Тем не менее не хочется заканчивать свое научное жизнеописание на минорной ноте. Подытоживая личные научные воспоминания — у меня не возникает ни малейших сомнений, что я правильно выбрал профессию ученого-исследователя в области «молекулярная биология».
Во-первых, это безумно интересно — добывать новые сведения о том, как устроена жизнь на молекулярном уровне, узнавать впервые новые детали молекулярных механизмов, на которых основана в том числе и твоя собственная жизнь. Кроме того, для будущего медицины молекулярная биология и биохимия играют первостепенную роль.
Во-вторых, профессия ученого-исследователя — это профессия свободных людей. Здесь ваша точка зрения на конкретную научную проблему, которой вы занимаетесь, не обязательно должна совпадать с точкой зрения вашего начальника. Более того, у вас всегда есть возможность поставить грамотный эксперимент и доказать не только своему шефу, но и другим коллегам, работающим в той же области, что ваше объяснение конкретного научного факта верно, а то, что ранее считалось бесспорным, должно быть отвергнуто.
Наконец, занятие фундаментальной наукой как никакое другое поддерживает на должном уровне мыслительные способности мозга до глубокой старости. В особенности его способность к всестороннему анализу разного рода явлений и фактов. Это важно не только в науке, но и в общественной жизни.
На моем веку мне, к сожалению, приходилось очень часто сталкиваться с людьми, совершенно не способными к элементарному логическому анализу. Кстати, если они оказывались по недоразумению научными работниками, то учеными они были очень посредственными.
А молодым людям, решившим посвятить свою жизнь молекулярной биологии, хочу сказать: правильный выбор! Богатыми, может быть, вы и не будете, но жить вам всегда будет интересно!
Подготовила Наталия Лескова


 Меню
Меню





 Все темы
Все темы




 0
0







