Полина Вишнякова: «Моноцит — аксолотль в мире клеток»
Как ученые «дрессируют» макрофаги для лечения болезней, рассказала к.б.н. Полина Вишнякова на лекции научно-просветительского проекта «Метафаза» от PCR.NEWS и парка «Зарядье». Это первая лекция в блоке, посвященном иммунной системе.

Лекция началась с цитаты Ильи Ильича Мечникова: «Я сорвал несколько шипов с розового куста и тотчас же вставил их под кожу великолепных, прозрачных, как вода, личинок морской звезды. Я всю ночь волновался в ожидании результата и на другой день, рано утром, с радостью констатировал удачу опыта. Этот последний и составил основу теории фагоцитов, разработке которой были посвящены последующие двадцать пять лет моей жизни».
Хотя мы считаем, что именно Илья Мечников в 1892 году открыл явление фагоцитоза, фагоцитоз наблюдали и другие исследователи. Например, в 1777 году немецкий зоолог Иоганн Гёце писал о том, что большие простейшие могут поглощать простейших поменьше.
С развитием технологий стало понятно, что фагоцитоз — лишь одна из функций макрофагов. Моноциты и макрофаги выполняют антигенпрезентацию, резорбируют кости, распознают и фагоцитируют опсонизированные антителами клетки с помощью Fc-рецепторов, оказывают антимикробное воздействие за счет активных форм кислорода и оксида азота, помогают ремоделировать внеклеточный матрикс для восстановления после острой фазы воспаления.
Когда говорят о происхождении моноцитов, часто упоминают только красный костный мозг. Однако это не все. Моноциты формируются в желточном мешке и фетальной печени. Считается, что клетки из желточного мешка (примитивные прогениторы) сначала заселяют микроглию ЦНС, а затем печень плода. Стволовые клетки крови из аорто-гонадо-мезонефральной области переходят в красный костный мозг, становясь известными нам костно-мозговыми моноцитами, а какая-то часть стволовых клеток переходит в печень к примитивным прогениторам. Моноциты фетальной печени мигрируют и заселяют различные органы, превращаясь затем в резидентные макрофаги. Моноциты из красного костного мозга под воздействием факторов, чаще всего воспалительных, тоже могут превращаться в тканевые макрофаги. Таким образом, наши ткани содержат макрофаги разного происхождения.
Сейчас больше всего внимания сконцентрировано на переходе костно-мозговых моноцитов в макрофаги. Некоторые ученые занимаются переходом фетальных моноцитов в резидентные макрофаги. Однако большая часть исследований производится на мышах, и данные для человека только начинают появляться.
Моноциты — самые крупные клетки крови. Если их покрасить по Романовскому, то можно увидеть бобовидное ядро и чуть прозрачную цитоплазму. Моноцит — отдельная стадия жизни макрофага. Если моноцит не попадает в ткань, то он разрушается. Моноцит — это своего рода аксолотль в мире клеток, сказала Полина Вишнякова; «личиночная стадия» макрофага, которая может и не становиться «взрослой».
С развитием цитометрии ученые пришли к выводу, что моноциты не такая однородная популяция, как казалось. Были обнаружены специфические маркеры, позволяющие выделить три субпопуляции моноцитов у человека: классические, которые в большом количестве экспрессируют мембранный белок CD14, неклассические, несущие на поверхности CD16, и промежуточные, которые экспрессируют и CD14, и CD16. Предполагают, что промежуточные и неклассические моноциты происходят из классических. Классических моноцитов больше, чем остальных, и они чаще становятся тканевыми макрофагами. Промежуточным моноцитам отводят провоспалительную роль, но точных данных об этом все еще нет. Неклассические моноциты удаляют дебрис из сосудистого русла, а также они основной источник фактора некроза опухоли α (TNF-α) — мощного провоспалительного цитокина.
В лабораторных исследованиях моноциты можно выделить культуральными методами, используя способности моноцитов к адгезии, или магнитным сортингом, когда магнитная частица прикрепляется на нужный маркер, и при воздействии магнитного поля клетка с частицей остается на колонке. Есть и третий способ — лазерный сортинг, когда с помощью флуоресцентного сигнала клетки отсеиваются в отдельную пробирку. Воздействие специальных факторов может примерно за неделю перевести моноцитарную культуру в макрофагальную.
После того, как с организмом что-то происходит, на эндотелии сосудов экспрессируются специальные молекулы, заставляющие моноциты перейти в ткань. При этом они приобретают тот или иной фенотип. В 2000 году американский ученый Чарльз Миллз сформулировал М1/М2 парадигму. Макрофаги М1 — провоспалительные — активны в начале воспаления, а макрофаги М2 — противовоспалительные — ремоделируют ткань после воспаления. Макрофаги различаются набором поверхностных маркеров, сигнальных молекул, цитокинов и хемокинов. Позже М2-макрофаги разделили еще на четыре подгруппы в зависимости от активирующего фактора.
М1/М2 парадигма основана на аргининовой вилке. У аргинина, поступающего в макрофаг, есть два пути метаболизма. Первый — расщепление NO-синтазой с образованием цитруллина и NO. Такой макрофаг будет М1-макрофагом, так как за счет оксида азота будет происходить ингибирование клеточной пролиферации. Второй путь — аргиназа расщепит аргинин с образованием орнитина. Часть орнитина станет пролином, затем гидроксипролином, а потом включится в коллаген. Другая часть орнитина превратится в полиамины и будет нужна для пролиферации клеток. Такой макрофаг — М2, так как за счет орнитина происходит заживление ткани.
Оксид азота является важной молекулой М1-макрофагов. Он оказывает сильное антибактериальное и антипаразитарное действие, ингибирует рост опухолей, активирует иммунный ответ, а также регулирует степень релаксации кровеносных сосудов.
Синтез коллагена М2-макрофагами мало освещен в науке, но существует несколько микрофотографий, на которых макрофаги расположены рядом с волокнами коллагена. Основную часть коллагена синтезируют фибробласты, но, вероятно, им в этом помогают М2-макрофаги.
С развитием гигиены, появлением антибиотиков и вакцин человек взял под контроль М1-реакции на инфекционные агенты, заглушая нормальный воспалительный ответ. Некоторые ученые полагают, что это привело к усилению активности М2-макрофагов и росту аллергических реакций. Ожирение часто связывают с вялотекущим воспалением, при этом растет число провоспалительных М1 макрофагов, пытающихся поглотить гипертрофированные жировые клетки.
После публикации Чарльза Миллса изменился взгляд на некоторые заболевания. Увеличение числа М2-макрофагов характерно для онкозаболеваний, эндометриоза и нейродегенеративных заболеваний. Избыточные клетки не поглощаются макрофагами, и болезнь избегает атаки иммунной системы. При доминировании М1-макрофагов воспаление уже началось и сильно усиливается за счет макрофагов (цирроз печени, атеросклероз, преэклампсия, преждевременные роды).
Со временем М1/М2 парадигма подверглась критике. Например, французский иммунолог Флоран Жину (Florent Ginhoux) с коллегами в 2020 году опубликовал статью о том, что М1/М2 теория сильно упрощена, а макрофаги постоянно меняют свой фенотип и соотношение М1/М2 в зависимости от ситуации. Несмотря на критику, разделением макрофагов на М1 и М2 до сих пор пользуются, потому что это удобно.
Чтобы определить фенотип моноцитов и макрофагов, можно исследовать транскрипционные факторы и промежуточные эффекторы, поверхностные рецепторы, секретируемые молекулы и метаболизм. Для этого используют анализ транскриптома (NGS, микрочипы), секретома, протеома (масс-спектрометрия) или продукцию белка (вестерн-блоттинг), биоинформатический анализ и функциональные тесты (продукция АФК, фагоцитарная активность).
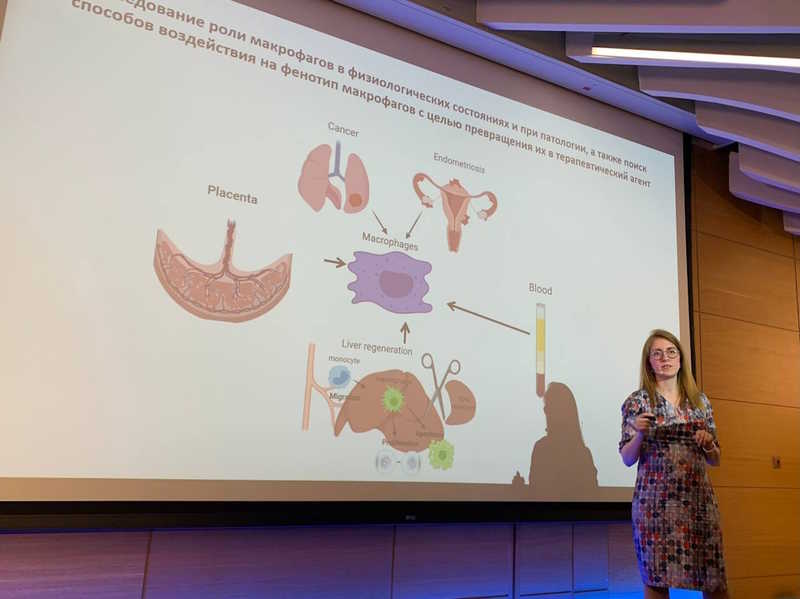
В лаборатории регенеративной медицины ФГБУ НМИЦ АГП им. В.И. Кулакова Полина с коллегами занимается не только тем, что происходит с моноцитами и макрофагами в разных условиях, но и тем, как можно изменить фенотип макрофага, чтобы он превратился в терапевтический агент.
Предполагается, что из крови пациента можно выделить моноциты, объединить их с фибробластами, получить индуцированные плюрипотентные стволовые клетки, дифференцировать их в макрофаги и выбрать нужный фенотип М1 или М2. Затем перенести активированные клетки обратно пациенту, например, для лечения операционной раны или лечения несолидных онкозаболеваний. Фенотип макрофага можно изменить с помощью доставки нужных генов в липосомах, лентивирусах, аденоассоциированных вирусах. In vivo можно индуцировать экспрессию нужных маркеров на трансгенных животных.
У лаборатории получилось «дрессировать» макрофаги. Ученые использовали лентивирусную трансдукцию, чтобы поляризовать макрофаги в провоспалительную сторону для противоопухолевой активации. Такие макрофаги уменьшали рост ксенографтной модели рака молочной железы у мышей. CAR-M-терапия (CAR-макрофаги) развивается. Сейчас в мире зарегистрировано всего 11 клинических испытаний М1 и М2 макрофагов, одно из которых проходит в Новосибирске.
Другие лекции «Метафазы»
Павел Макаревич: регенерация — свойство организма, а не культуры клеток
Эволюция регенерации на «Метафазе»
«Метафаза» рассказала об индуцированных плюрипотентных стволовых клетках
В «Зарядье» состоялась первая лекция просветительского проекта «Метафаза»


 Меню
Меню





 Все темы
Все темы



 0
0







