Матвей Колесник о гонке вооружений между бактериями и фагами
Новый цикл научно-просветительского проекта «Метафаза», посвященный бактериям и археям, открыл Матвей Колесник лекцией об иммунитете бактерий. Он рассказал о том, как ищут новые защитные системы бактерий против бактериофагов, как они могут быть нам полезны (не только для редактирования геномов) и что позволяют нам узнать о собственном иммунитете, а также об успехах своей научной группы в области исследования систем CRISPR-Cas.

Матвей Колесник, кандидат биологических наук, научный сотрудник лаборатории молекулярной генетики микроорганизмов ИБГ РАН, выступил с лекцией «Бактериофаги и защитные системы прокариот: гонка вооружений между бактериями и их вирусами».
Как проходят вирусные инфекции у бактерий
Бактериофаги — это вирусы, которые заражают только бактерий. Они считаются одним из важнейших факторов, которые контролируют численность бактерий в природе. Обнаруживая бактериальную клетку и связываясь с ее поверхностью, бактериофаг впрыскивает в нее свою нуклеиновую кислоту, с которой начинают экспрессироваться вирусные гены. В бактериальной клетке накапливаются вирусные компоненты, собирающиеся в полноценных фагов; как правило, в конце цикла инфекции клетка разрушается, из нее выходит множество новых вирусных частиц.
Однако в ряде случаев инфекция протекает иначе. Например, фаг может внедрить свою ДНК в клетку бактерии, и эта последовательность может интегрироваться в клеточный геном. В этом случае для фага уже нет выгоды в том, чтобы убивать клетку; более того, некоторые фаги кодируют компоненты, дающие лизогенизированным бактериям адаптивные преимущества — к примеру, защиту от инфекции другими вирусами. В некоторых случаях такая «помощь» бактериям со стороны бактериофагов может принимать не самые приятные для людей формы — к примеру, некоторые сильнейшие токсины, выделяемые патогенными бактериями, на деле кодируются бактериофагами, встроенными в геномы бактерий (холерный токсин, дифтерийный токсин).
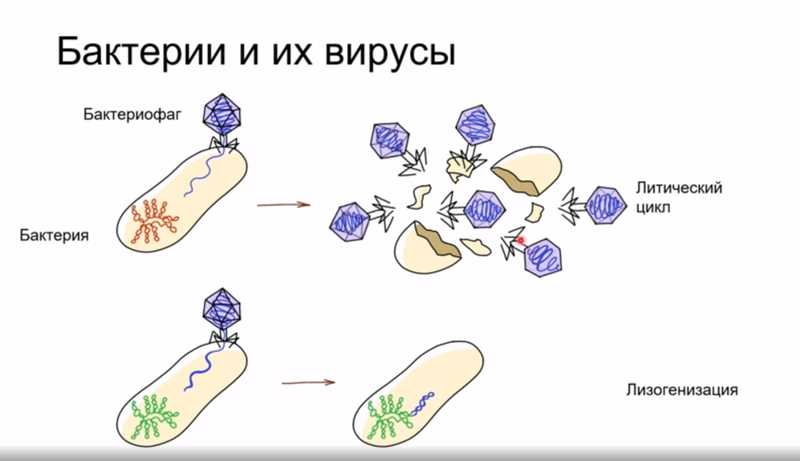
Имея таких природных врагов, бактерии выработали целый арсенал защитных механизмов, позволяющих предотвратить фаговую инфекцию на любой из ее стадий. Например, на ранних стадиях инфекции фаговая частица распознает определенные молекулы на поверхности клетки, и бактерии могут мутировать таким образом, что эти молекулы либо меняются, либо исчезают с поверхности клетки, и такие клетки становятся устойчивыми к этому фагому. Если же вирус все-таки попал внутрь клетки, срабатывают другие механизмы.
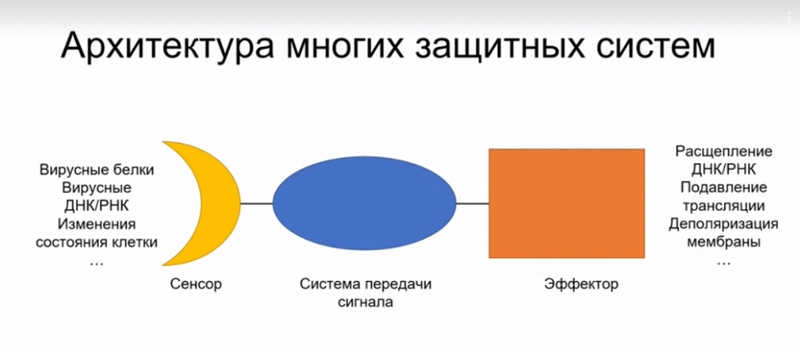
Разнообразие защитных систем бактерий чрезвычайно велико, однако в них можно выделить общие элементы: в их состав входит сенсор, детектирующий присутствие вируса внутри клетки, который передает сигнал на эффекторные компоненты, осуществляющие иммунный ответ. Например, многие бактериальные защитные системы при инфекции клеток фагом активируют очень токсичные компоненты, что может привести к гибели клетки (по крайней мере, в лабораторных условиях). Зараженная фагом клетка при этом погибает вместе с фагом, защищая остальную популяцию от инфекции.
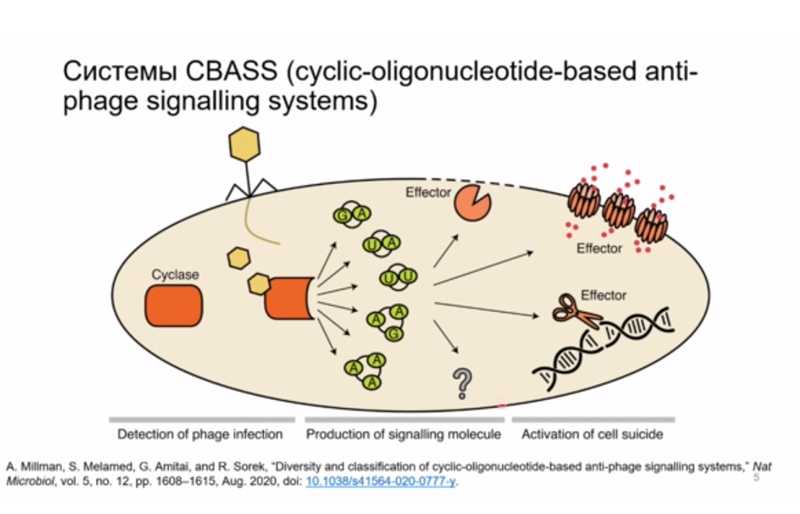
В качестве одного из примеров такой защитной системы бактерий Матвей Колесник привел широко распространенные системы CBASS (cyclic-oligonucleotide-based anti-phage signaling system). В состав такой системы входит сенсорный фермент; он распознает вирусные белки и начинает при их появлении синтезировать циклические ди- и тринуклеотиды, которые служат мессенджерами, активирующими эффекторные компоненты; эти компоненты, в зависимости от системы, могут расщеплять ДНК, разрушать либо деполяризовывать клеточную мембрану.
CRISPR-Cas: от иммунитета бактерий к редактированию генома
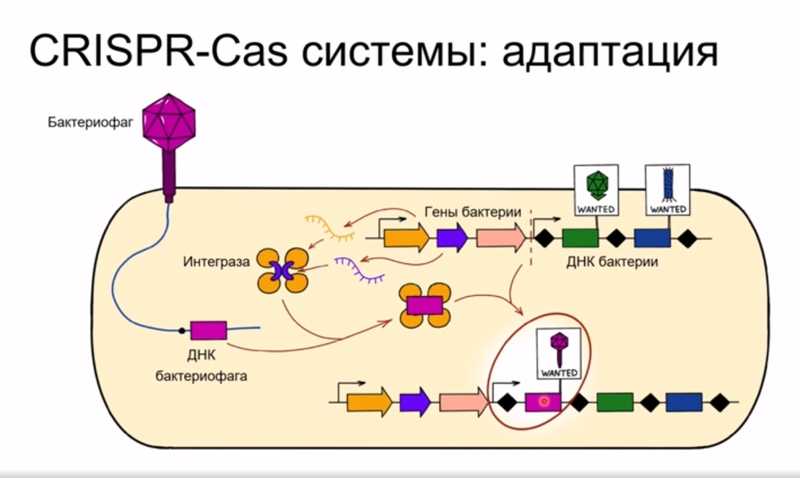
В последнее время особенно на слуху системы CRISPR-Cas, так как на их основе создано множество инструментов для геномного редактирования. CRISPR-сas-локусы содержат CRISPR-кассеты, состоящие из идентичных повторов, разделенных уникальными спейсерами; неподалеку от CRISPR-кассет обычно закодированы определенные CRISPR-ассоциированные cas-гены. В CRISPR-Cas-системах есть особый механизм, который позволяет клетке захватывать небольшие фрагменты чужеродной ДНК и встраивать их в CRISPR-кассету — при этом появляется новая пара из повтора и спейсера, а бактерия приобретает устойчивость к бактериофагу.
В клетке CRISPR кассеты транскрибируются, и короткие молекулы РНК, содержащие последовательности спейсеров, встраиваются в особые белковые комплексы, которые сканируют все попадающиеся на его пути нуклеиновые кислоты, «сверяя» их с последовательностью спейсерной части малой РНК. Когда он обнаруживает совпадение, запускается иммунный ответ: Cas9, например, расщепляет распознанную ДНК.
Поиск новых защитных систем
Характерное свойство генома бактерий — гены, продукты которых выполняют схожие функции, часто располагаются рядом друг с другом. Поэтому, если в геноме бактерии рядом с совокупностью генов, выполняющих одну и ту же функцию, есть ген с неизвестной функцией, то можно предположить, что он имеет ту же самую функцию. В литературе такой подход называют guilt by association.
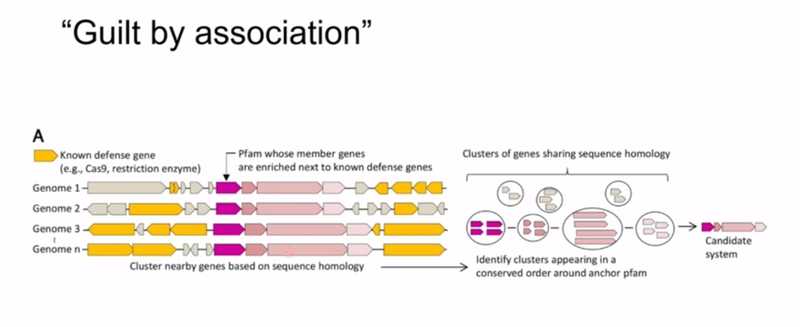
В 2018 году в Science вышла работа, в которой с помощью такого подхода были выявлены ранее не описанные защитные системы, расположенные вблизи уже известных «защитных островков» в геноме бактерий. Гены кандидатных систем клонировали и экспрессировали в бактериях и оценивали устойчивость клеток к инфекции фагами. В другой работе предложили высокоэффективный алгоритм CRISPRicity, позволяющий оценить степень ассоциации белоккодирующих генов в бактериальном геноме с кассетами CRISPR. Простой по своей сути метод CRISPRicity позволил найти сразу несколько новых CRISPR-Cas-систем, например, системы типа VI. Они ведут себя достаточно необычно: распознав вирусную ДНК, начинают расщеплять всю РНК вокруг. Подход CRISPRicity разработал Сергей Шмаков, будучи еще аспирантом в лаборатории Константина Северинова.
Новые защитные системы можно искать в метагеномных данных — они содержат наборы геномных последовательностей всех микроорганизмов, которые содержались в образце. Поскольку количество метагеномных данных чрезвычайно велико, и при этом многие последовательности в них повторяются, такие данные перед анализом нужно «сжать», кластеризовав все похожие белоккодирующие последовательности. Если несколько кластеров похожих белков кодируются генами, которые расположены рядом, то можно предположить их функциональную связь. Алгоритм такой кластеризации, позволивший найти больше 200 новых редких CRISPR-Cas-систем, также был разработан при участии команды Евгения Кунина и Фэна Чжана — американского исследователя, одного из пионеров в изучении CRISPR-Cas систем.
Матвей Колесник поделился и своим вкладом в развитие области. Так, он более подробно охарактеризовал механизм работы системы CRISPR-Cas13a, которая относится к системам VI типа. Оказалось, что белок Cas13a нарезает РНК в клетке не случайным образом, а преимущественно разрезает тРНК в области антикодоновой петли. Это подавляет трансляцию матричных РНК в клетке, за счет чего, в свою очередь, подавляется развитие бактериофагов.
Интересно, что фаги, которые встроены в бактериальный геном, сами могут кодировать системы защиты от других фагов. Если сопоставить геномы нескольких родственных фагов, то у них гены защитных систем часто будут располагаться приблизительно одинаково, но могут содержать вариабельные фрагменты, также несущие защитные системы. Такой подход можно назвать guilt by location — «вина по расположению». Руководствуясь этим подходом, французские ученые смогли обнаружить систему PARIS: ее активация также приводит к абортивной инфекции из-за гибели клеток. Ученые выяснили, что эта система защищает бактерии от многих фагов, но не от фага Т5 — однако при исследовании тех же конструкций команда Северинова наблюдала защиту и от этого фага. Дело оказалось в том, что французская и московская команды использовали разные варианты фага Т5: в последнем случае у него отсутствовал фрагмент генома, кодирующий кластер тРНК. Такая случайность позволила более подробно описать механизм работы PARIS (об этой работе писал PCR.news).
Параллели между бактериальным и человеческим иммунитетом
Отрасль науки, посвященная бактериальному иммунитету, сейчас переживает расцвет: ученые находят всё новые защитные системы, а современные методы позволяют относительно быстро определять механизм их работы и структуры белков, входящих в их состав. Из всего разнообразия известных защитных систем Матвей Колесников отобрал наиболее интересные примеры.
Изучение бактериального иммунитета показало, что защитные системы бактерий поразительно похожи на системы, составляющие врожденный иммунитет человека. Вероятнее всего, когда-то они произошли от общего предка.
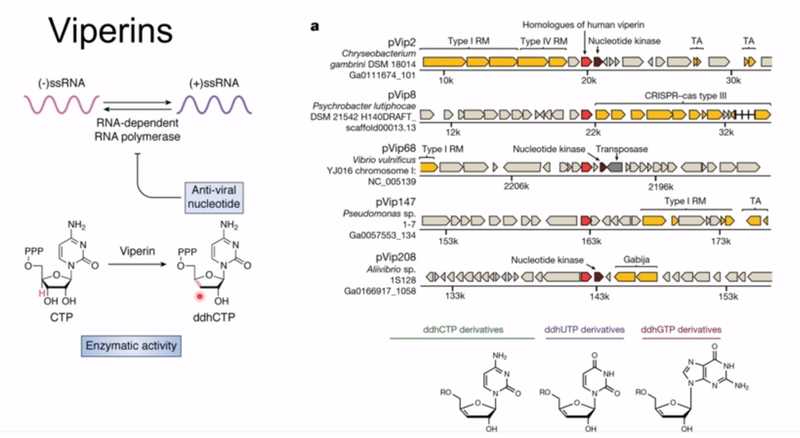
В 1990-х годах ученые обнаружили виперины — класс белков, которые начинают вырабатываться в ответ на интерферон; тот, в свою очередь, вырабатывается в ответ на вирусную инфекцию. Виперины — это ферменты, которые могут превращать нуклеозидтрифосфаты в дидегидронуклеозидтрифосфаты. Такие молекулы работают по тому же механизму, что и некоторые противовирусные препараты (ацикловир, например): вирус, пытаясь реплицировать свой геном, принимает эту молекулу за обычный нуклеозидтрифосфат и встраивает в растущую цепь, но после этого не может синтезировать цепочку дальше. Позднее оказалось, что виперины есть и у бактерий, где они тоже выполняют противовирусную функцию.
Еще одна параллель нашлась в гасдерминах — белках, принимающих участие в пироптозе. При пироптозе происходит активация специальных протеаз — каспаз, которые расщепляют ряд белков, включая гасдермины — последние после протеолиза олигомеризуются и образуют пору в мембране. Через эту пору выбрасывается содержимое клетки, в том числе цитокины, передающие воспалительный сигнал другим клеткам, а сама клетка погибает. Не так давно ученые выяснили, что и у бактерий есть белки, очень похожие на гасдермины, причем рядом с их генами находятся гены, кодирующие протеазы, способные активировать гасдермины.
Упомянутая выше система CBASS тоже имеет аналог у человека — сигнальный путь cGAS/STING. Она включает в себя фермент-сенсор cGAS, который, если обнаруживает в цитоплазме клетки двуцепочечную ДНК, начинает синтезировать циклические динуклеотиды. Они впоследствии связываются с белком STING, что в конце концов индуцирует экспрессию провоспалительных генов.
CRISPR-Cas для диагностики
Биологи нередко начинают по-своему эксплуатировать системы, изначально найденные у бактерий. Так что и защитные механизмы бактерий быстро нашли применение в биотехнологии — не только в геномном редактировании.
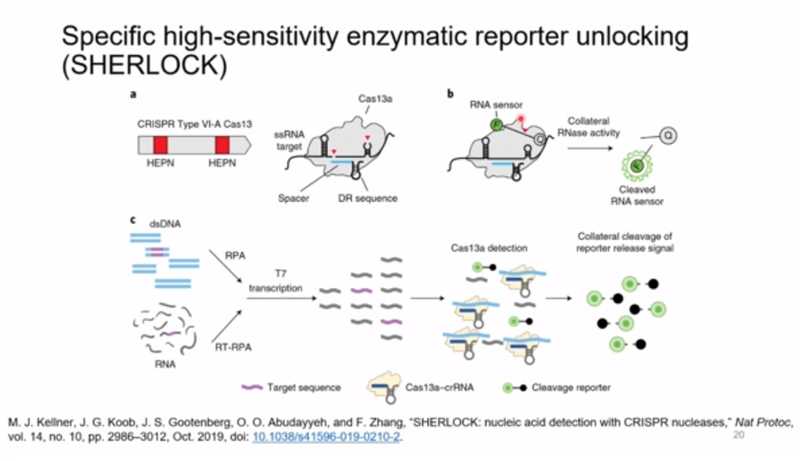
CRISPR-Cas-системы VI типа, о которых шла речь ранее, нашли применение в методе детекции нуклеиновых кислот — SHERLOCK (Specific High-Sensitivity Enzymatic Reporter unlocking). Эта система может применяться, например, для диагностики вирусных инфекций. Она основана на белке Cas13a, том самом, который при обнаружении последовательности, соответствующей фрагменту в его гидовой РНК, начинает расщеплять всю РНК вокруг. Cas13a можно поместить в пробирку с образцом вместе с гидовой РНК и РНК-сенсором, несущим на одном конце флуорофор, а на другом — гаситель. В присутствии нуклеиновых кислот вируса белок активируется и начинает разрезать РНК, а разрезание сенсора приводит к появлению свечения от флуорофора, которое и служит положительным сигналом о наличии вируса в образце. У этой системы есть преимущество перед ПЦР в реальном времени: она более чувствительна, и для ее применения не требуется термоциклер, так как реакция проходит при постоянной температуре.
Находки в фагах из горячих источников
Пару лет назад коллектив лаборатории, в которой работает Матвей Колесник, отправлялся в экспедицию на горячие источники на остров Кунашир. В образцах исследователи нашли несколько новых фагов, заражающих Thermus thermophilus, — Lalka8 и Lalka27. В их геноме обнаружили несколько CRISPR-кассет, что довольно необычно для вирусов. Эти фаговые CRISPR-кассеты сильно отличаются от клеточных, и клеточные Cas белки их использовать не могут. Однако рядом с вирусными CRISPR-кассетами кодируется белок, похожий на транспозонный белок tnpB.
Оказалось, что, если внести в клетки плазмидную конструкцию, кодирующую TnpB-подобный белок и фаговую CRISPR-кассету, то клетка получает защиту от фагов, которые содержат в геноме последовательность, совпадающую со спейсером. Эти результаты показывают, что фаги кодируют новую, ранее неизвестную CRISPR-Cas систему, которая тоже может найти практическое применение. Биологическая роль фаговой CRISPR-Cas системы пока неясна — анализ показывает, что спейсеры из CRISPR-кассет таргетируют необычную группу мобильных элементов из T. thermophilus. Вероятно, между этими элементами и фагами идет своего рода борьба, и исследователи надеются, что смогут вскоре понять ее суть.


 Меню
Меню





 Все темы
Все темы




 0
0






