Фаг нейтрализует защитную систему бактерии-хозяина с помощью гена тРНК
Международная группа, в которую вошли российские исследователи, описала механизм, уничтожающий клетку кишечной палочки, инфицированную фагом. Система PARIS (Phage Anti-Restriction Induced System) реагирует на белок Ocr фага Т7, подавляющий другие системы иммунитета бактерий. При этом в клетке появляется нуклеаза, которая расщепляет лизиновую тРНК бактерии, что приводит к прекращению трансляции. Однако фаги, доставляющие в клетку ген лизиновой тРНК, нечувствительной к нуклеазе, могут, в свою очередь, обойти эту систему защиты.
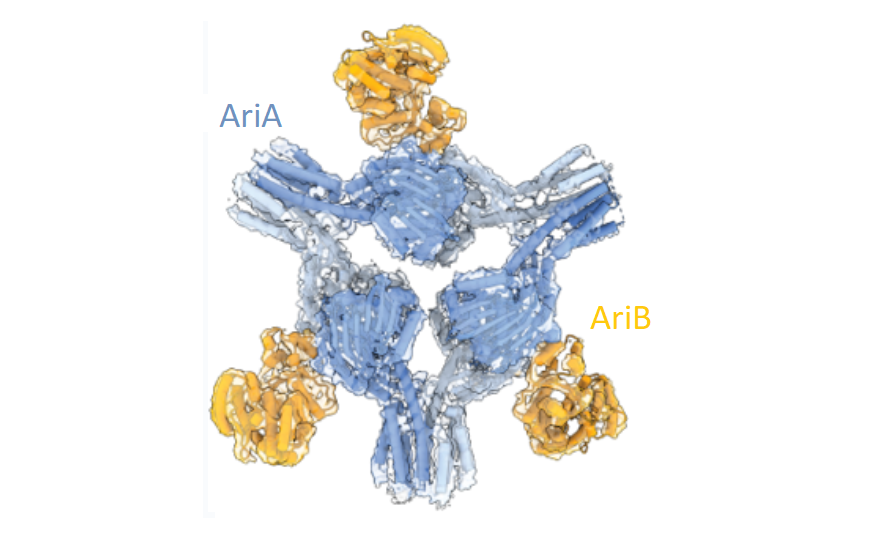
Бактериофаги конкурируют друг с другом за ресурсы клетки-хозяина. Поэтому некоторые умеренные вирусы, которые могут встраиваться в геном бактерий или архей, также приносят с собой молекулярные механизмы, которые защищают хозяина от конкурирующих генетических паразитов или убивают клетку, зараженную другим фагом. PARIS (Phage Anti-Restriction Induced System) — защитная система, которая часто присутствует в вирусных геномах и состоит из ABC-АТФазы (AriA) и TOPRIM-нуклеазы (AriB). Система PARIS Escherichia coli B185 защищает ее от инфекции фагом T7, причем реагирует на фаговый белок Ocr (Overcoming classical restriction), который ингибирует бактериальные системы защиты, обеспечивающие рестрикцию фаговых геномов. Таким образом, PARIS можно назвать «системой анти-антирестрикции».
Однако механизм, с помощью которого AriA и AriB функционируют в защите от фагов, не был известен. Этот механизм расшифровал международный коллектив ученых, включающий группу Артема Исаева из Сколтеха.
С помощью крио-ЭМ авторы определили структуру комплекса, который образуют белки AriA и AriB Escherichia coli B185. Шесть молекул AriA формируют трехлучевую звезду или «пропеллер» с тремя лопастями, между которыми находятся три молекулы AriB. Мутации, нарушающие это взаимодействие, ограничивают способность бактерии реагировать на фаговую инфекцию, следовательно, формирование комплекса играет важную роль в этом процессе.
Затем авторы показали, что фаговый белок Ocr взаимодействует с сенсором системы — ABC АТФазой AriA. Ocr — ДНК-миметик, он несет отрицательный заряд и связывается с положительно заряженными участками в центре комплекса, возле «оси» пропеллера. В результате из комплекса высвобождается AriB. Для этого процесса необходима АТФазная активность AriA. В свою очередь, AriB образует димеры, токсичные для клетки; инфицированная фагом бактерия гибнет. Этот принцип действия напоминает токсин-антитоксиновые (TA) модули бактерий. Но, в отличие от классических TA систем, токсин AriB требует активации: токсичность AriB, который высвободился из комплекса, а не просто был экспрессирован в клетке, значительно выше.
Также авторы установили, что активация системы PARIS подавляет трансляцию (синтез белков) в бактериальной клетке. Логично было предположить, что мишень нуклеазы AriB необходима для трансляции.
Когда исследователи проверяли, как PARIS реагирует на инфекции различными фагами, они установили, что она не реагирует на фаг Т5 дикого типа, но блокирует инфекцию определенным вариантом Т5 из Московской коллекции фагов, в геноме которого есть протяженная делеция. В итоге выяснилось, что Т5 дикого типа кодирует лизиновую тРНК; именно она защищает его от PARIS. Нуклеаза AriB расщепляет лизиновую тРНК хозяина, но если фаг может заменить ее своей тРНК, устойчивой к расщеплению, гибели клетки не происходит. Иначе говоря, импортированная фагом тРНК обеспечивает «анти-анти-антирестрикцию». Как отмечают авторы, пока нельзя исключить, что димерный AriB расщепляет и другие бактериальные тРНК, дефицит которых восполняют фаги, — это нужно проверить в дальнейших исследованиях.
Итак, звездообразный комплекс из шести AriA и трех AriB взаимодействует с чужеродным белком — например, Ocr фага Т7. При этом высвобождается белок AriB, образует димеры с нуклеазной активностью и расщепляет лизиновую тРНК хозяина. В результате блокируется трансляция, и клетка погибает. AriA функционирует как АТФ-зависимый сенсор фаговых ДНК-мимикрирующих белков — когда они появляются в клетке, из комплекса высвобождается активный токсин AriB.
 Графический абстракт подготовлен авторами статьи
Графический абстракт подготовлен авторами статьи
Что касается фага T5, он избегает системы PARIS, так как доставляет в клетку и экспрессирует свой вариант лизиновой тРНК, которую не может расщепить димер AriB. Однако варианты T5, не имеющие гена этой тРНК, уязвимы для PARIS. Интересно, что в этом случае она активируется белками Ptr1 и Ptr2 фага Т5, которые имеют мало сходства с Ocr, хотя тоже невелики по размеру и отрицательно заряжены. Авторы предполагают, что новые триггеры систем PARIS, такие как Ptr1 и Ptr2, также окажутся антирестрикционными белками, подавляющими другие системы бактериального иммунитета.
Авторы получили филогенетические деревья для белков AriA и AriB и подтвердили, что они коэволюционируют. Более того, оказалось, что доменная архитектура, включающая ABC АТФазный сенсор и эффектор на основе TOPRIM или других доменов, широко распространена в бактериях и представлена в различных иммунных системах, таких как Gabija, Old, Septu, Lamassu, Retron IB и другие.
В последнее время обнаруживается все больше иммунных систем бактерий, которые формируют макромолекулярные комплексы и распознают чужеродные белки, а не чужеродные нуклеиновые кислоты.
— Этот принцип в чем-то напоминает систему антиген-антитело, когда сенсоры иммунных систем по сути выступают антителами, специализирующимися на распознавании конкретной группы антигенов/триггеров, таких как ДНК-мимикрирующие белки в случае PARIS или структурные белки фага в случае AVAST и CapRel систем, — комментирует Артем Исаев. — Подобный принцип характерен для абортивных систем: они активируются в тот момент, когда в клетке начинают появляться вирусные белки, а это означает, что вирус уже смог избегнуть действия систем, основанных на разрушении вирусной ДНК (CRISPR-Cas или системы рестрикции-модификации), и значит, защита требует более «радикальных» мер в виде запрограмирвоанного убийства клетки.
Существуют и другие защитные системы, которые останавливают трансляцию в зараженной фагом бактериальной клетке, расщепляя тРНК. В апреле 2024 года Science Advances опубликовал работу, в которой участвовали многие соавторы статьи о PARIS (а также Евгений Кунин и Кира Макарова). Системы CRISPR-Cas типа VI хорошо известны читателям PCR.NEWS благодаря практическому применению в молекулярной диагностике. Их эффекторная нуклеаза Cas13 распознает РНК-мишень (а не ДНК-мишень, как другие CRISPR-системы) и расщепляет не только ее, но и другие находящиеся рядом молекулы РНК. И если к образцу in vitro добавить РНК-зонды, возникнет сигнал, по которому можно детектировать присутствие мишени в образце; на этом принципе основан метод SHERLOCK.
Сходным образом CRISPR-Cas13 работает в бактериальной клетке «детектором» чужеродной РНК: при ее появлении разрезает другие РНК. Авторы статьи в Science Advances показали, что Cas13a Leptotrichia shahii (LshCas13a) расщепляет тРНК с богатыми уридином антикодонами (тРНК лизина, глутамина, глутаминовой кислоты и треонина), в том числе расщеплению в антикодоновой петле подвергаются более 20% лизиновой тРНК. Позднее расщепляются и мРНК. В результате ингибируется трансляция, и зараженная клетка переходит в состояние покоя, что предотвращает распространение фаговой инфекции.
Прокомментировать эти результаты мы попросили Константина Северинова (Институт биологии гена РАН, Ратгерский университет в Нью-Джерси, США), который участвовал в обеих работах.
В этих двух статьях представлены два абсолютно разных механизма — детекция нуклеиновой кислоты и детекция белка фага, и оба приводят к ингибированию трансляции через расщепление тРНК. О чем говорит такая конвергенция? Есть ли другие подобные механизмы, нацеленные именно на трансляцию, через тРНК или что-то другое?
Гены тРНК очень консервативны и жизненно необходимы для клетки. Именно поэтому они часто оказываются мишенью мобильных генетических элементов. Многие бактериофаги встраиваются в геном бактерии-хозяина рядом с генами тРНК, и клетка не может от них избавиться. Нарушение функции тРНК бактерии-хозяина гарантированно останавливает трансляцию и поэтому позволяет бактериям бороться — ценой собственной смерти — с вирусной инфекцией, предотвращая образование вирусного потомства, которое, начав заражать другие клетки, приведет к гибели всей популяции. Именно так работает Cas13 и многие другие системы защиты от фаговой инфекции, которые изучались в 80-х и 90-х годах прошлого века. Впрочем, тогда такие исследования не обращали на себя особого внимания, и сейчас эти защитные системы переоткрывают.
Очевидно, что вирусам необходима стратегия борьбы с клетками, которые решают совершить харакири и расщепить свою тРНК. Наличие собственных вирусных тРНК — довольно обычное явление. Раньше считалось, что эти тРНК нужны только для более эффективной трансляции вирусных белков в зараженной клетке. Сейчас становится понятно, что вирусные тРНК нужны также для предотвращения гибели зараженных клеток, если они попытаются расщепить свою собственную тРНК. PARIS — одна из таких «антизащитных систем». Я думаю, что в ближайшем будущем их будет открыто великое множество. Интересно, что у эукариот тоже описаны системы, расщепляющие тРНК по антикодонам. Образованные в результате такого расщепления «половинки» тРНК играют регуляторную функцию. Наверняка что-то подобное будет скоро обнаружено и у бактерий.
Противофаговые иммунные системы прокариот выглядят опасными для хозяев, эти истории часто заканчиваются смертью зараженной клетки во имя популяции. «Выбор» между уничтожением фаговых геномов, например, с помощью Cas9, и «самоубийством» с помощью Cas13, PARIS или другой системы чем-то регулируется?
Любая иммунная система потенциальна опасна и может принести вред хозяину. Популяции прокариот клональны, то есть клетки генетически идентичны друг другу, и поэтому смерть конкретной клетки, например, после заражения фагом, совершенно оправданна. Я думаю, что все, или почти все защитные системы прокариот, включая Cas9, суицидальны, по крайней мере в некоторых контекстах.
Гигантские бактериофаги формируют ядерную оболочку, чтобы защитить свой геном
Источники
Nathaniel Burman, et al. Viral proteins activate PARIS-mediated tRNA degradation and viral tRNAs rescue infection // Nature. 2024. DOI: 10.1038/s41586-024-07874-3
Ishita Jain, et al. tRNA anticodon cleavage by target-activated CRISPR-Cas13a effector // Science Advances. 24 Apr 2024. Vol 10, Issue 17. DOI: 10.1126/sciadv.adl016


 Меню
Меню





 Все темы
Все темы




 0
0








