Филоподии опухолевых клеток предупреждают инвазию и прогрессирование рака молочной железы
Миозин X — белок, индуцирующий сборку филоподий, — обычно ассоциируется с метастазированием и плохим исходом при раке молочной железы. Однако исследователи из Финляндии и Голландии обнаружили, что на ранних этапах рака этот белок способствует поддержанию целостности базальной мембраны и противостоит инвазии опухоли. Это важно для терапии, потому что слишком ранее воздействие на миозин X может усугубить течение заболевания, а не облегчить его, как считалось ранее.
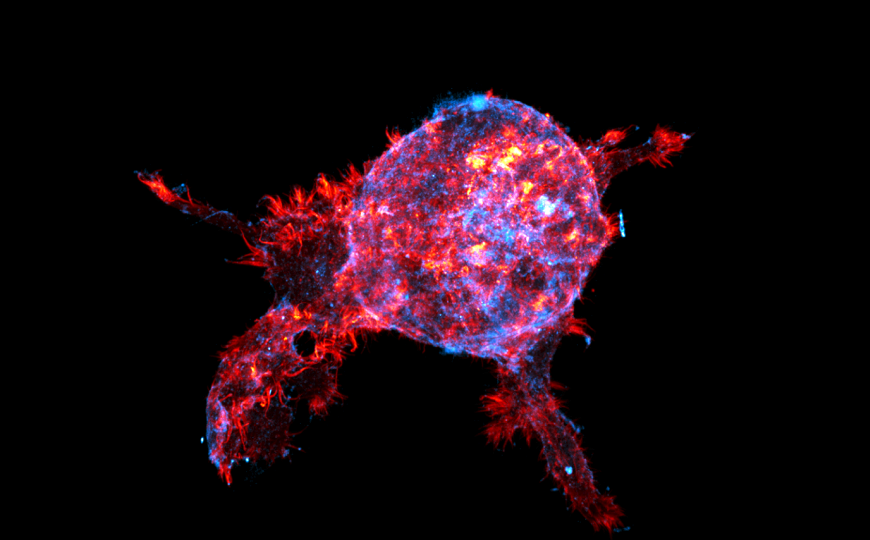
Credit:
Aleksi Isomursu, Turku Bioscience | Пресс-релиз
Несмотря на все разнообразие и преимущества современных методов лечения, рак молочной железы (РМЖ) остается серьезным заболеванием. Особенно он опасен на поздних стадиях, когда опухоль проникает в окружающие ткани и метастазирует по всему организму. Критической является трансформация протоковой карциномы in situ (ductal carcinoma in situ, DCIS) в инвазивный рак молочной железы (invasive breast cancer, IBC). DCIS окружена базальной мембраной (БМ), играющей роль барьера между эпителиальными клетками и окружающей их стромой. Трансформация в инвазивную опухоль обычно сопровождается нарушением целостности этой мембраны. Механизмы регуляции БМ in vivo до конца не ясны.
Филоподии — структуры клеток РМЖ, которые обычно ассоциируются с повышенной инвазией и метастазированием, а также стимулированием выживания метастазов. Белок миозин X (MYO10), индуцирующий сборку филоподий, в этом случае был бы активатором миграции и инвазии мигрирующих опухолевых клеток. Однако исследователи из Финляндии и Голландии показали, что это не всегда так.
Авторы изучили роль MYO10 в трансформации DCIS в IBC. Для этого они проанализировали экспрессию MYO10 в образцах тканей пациентов. Результаты гибридизации РНК in situ, а также иммуногистохимии (ИГХ) срезов замороженных тканей показали, что уровень этого белка был повышен как при неинвазивном, так и при инвазивном РМЖ.
Далее исследователи провели сайленсинг гена, кодирующего MYO10, у мышей с ксенографтами, которые модулируют прогрессирование РМЖ. Обнаружилось, что нехватка MYO10 ускоряла потерю DCIS-подобной морфологии. Также ИГХ-анализ ксенографтов на маркеры эпителиальных и мезенхимальных клеток показал, что потеря MYO10 индуцирует в раковых клетках эпителиально-мезенхимальный переход, особенно на границе опухоли.
Кроме того, при окрашивании ксенографтов на компоненты БМ было обнаружено, что недостаток MYO10 нарушает синтез БМ и ее целостность. При этом уровень выработки молекул внеклеточного матрикса в ксенографтах, лишенных MYO10, был повышен.
3D-анализ раковых сфероидов (культуральных трехмерных моделей опухоли) показал, что MYO10 необходим для сборки фибронектина и для синтеза непрерывной границы внеклеточного матрикса.
Таким образом, филоподии на ранних этапах болезни отвечают за поддержание целостности базальной мембраны и отграничивают опухоль и окружающие ткани, препятствуют метастазированию. На поздних стадиях они, наоборот, способствуют диссеминации раковых клеток и инвазии опухоли.
Эти результаты вносят вклад в развитие терапевтических подходов к лечению РМЖ. «Мы планировали разрабатывать стратегии по лечению рака, основанные на подавлении синтеза филоподий, но наши новые результаты четко дают понять, что слишком раннее воздействие на филоподии или миозин 10 могут на самом деле усугубить ситуацию», ─ говорит Гийом Жакме, доцент Академии Або университета в Турку и один из авторов работы.
Источники:
Peuhu E., et al. MYO10-filopodia support basement membranes at pre-invasive tumor boundaries. // Developmental Cell, Vol 57, Issue 20, 2350-2364.E7, published on October 24 2022. DOI: 10.1016/j.devcel.2022.09.016
Цитата по пресс-релизу








 Меню
Меню





 Все темы
Все темы






 0
0