Раскрыт механизм развития кахексии у больных раком поджелудочной железы
Прогрессирование рака поджелудочной железы часто сопровождается кахексией (сильным истощением). Авторы статьи в Cancer Cell описывают механизм развития этого состояния. Опухолевые клетки рекрутируют и перепрограммируют макрофаги через ось CCL2/CCR2, а макрофаги, в свою очередь, стимулируют выработку лиганда TWEAK, провоцирующего мышечную атрофию. Исследователи надеются, что эти результаты помогут найти мишень для лекарства, способного предотвратить кахексию у онкобольных.
Cancer Cell, 2024, DOI: 10.1016/j.ccell.2024.03.009 | CC BY-NC-ND 4.0 DEED
Рак поджелудочной железы (РПЖ) занимает 14-е место в мире по количеству впервые выявленных случаев злокачественных заболеваний, у мужчин он встречается несколько чаще. При этом смертность от него очень высока, РПЖ — седьмая по частоте причина смертей от онкозаболеваний. Его частота выше в странах с высоким уровнем дохода и высоким уровнем потребления переработанного мяса; так, уже в этом десятилетии он может стать второй причиной смертности от онкозаболеваний в США. Около 80% пациентов с этой формой рака узнают свой диагноз на поздних стадиях. У большинства из них развивается кахексия — сильное истощение, мышечная атрофия и отсутствие аппетита, что осложняет дальнейшее лечение. Одобренных методов лечения раковой кахексии пока не существует.
В развитии рака и кахексии важную роль играют воспалительные процессы и иммунное микроокружение опухоли, в частности, макрофаги. Они участвуют как в потере мышечной массы, так и в регенерации мышц, а их регуляция происходит посредством цитокина CCL2/MCP1. У пациентов с РПЖ повышается уровень CCL2 в крови, и это подтолкнуло исследователей из Медицинской школы Джонса Хопкинса и Йельской медицинской школы изучить роль макрофагов в развитии кахексии у больных. Статья опубликована в журнале Cancer Cell.
Секвенирование клеток ткани опухоли поджелудочной железы говорит о том, что на более поздней стадии в ткани больше макрофагов, чем на ранних. При этом у пациентов с более сильной инфильтрацией общая выживаемость ниже; инфильтрация повышена у более опасных подтипов РПЖ. Сигнатура ассоциированных с опухолью макрофагов (tumor-associated macrophages, ТАМ) чаще встречается при прогрессирующем раке и ассоциирована с плохим прогнозом. Кроме того, сигнатура ТАМ более характерна для кахектических типах рака (рак поджелудочной железы, рак пищевода, рак головы и шеи и рак легких), чем для некахектических. Наконец, у пациентов с РПЖ и кахексией число клеток с маркером макрофагов CD68 повышено по сравнению с пациентами, у которых кахексия не развилась.
Авторы создали мышиные модели заболевания: клетки линии KPC вводили в поджелудочную железу мышам дикого типа (WT) и мышам Ccr2−/−. Рост опухоли был одинаковым в обеих группах животных, однако у мышей Ccr2−/− было значительно меньше CCR2+ макрофагов в тканях опухоли и селезенки, меньше потеря мышечной массы, ниже экспрессия маркеров мышечной атрофии MuRF1 и атрогина-1 в большеберцовой мышце. Это подтверждает, что дефицит макрофагов, возникающий при нокауте гена CCL2, ослабляет проявления кахексии.
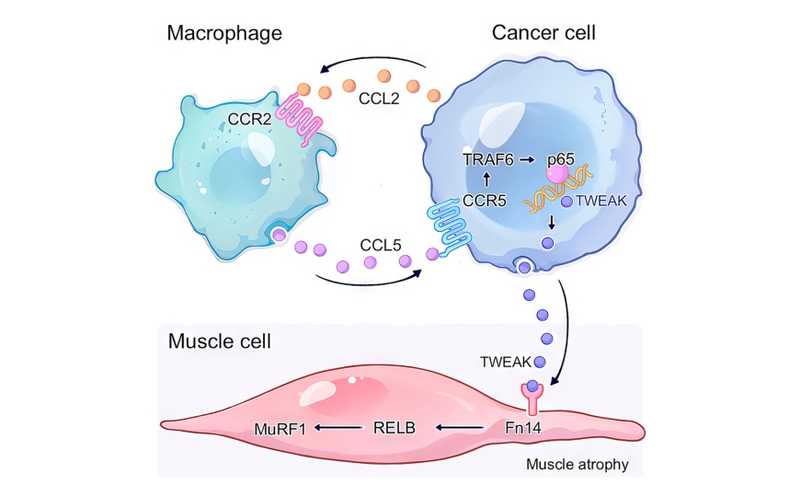
Чтобы определить, за счет чего макрофаги вызывают мышечное истощение, авторы проанализировали роль лиганда TWEAK (TNF-подобный слабый индуктор апоптоза) из суперсемейства факторов некроза опухоли (tumor necrosis factor, TNF). TWEAK заинтересовал исследователей, так как родственный ему лиганд TRAIL способствует истощению мышц при раке поджелудочной железы. Экспрессия TWEAK способствует инфильтрации опухоли макрофагами типа M2, а продукция TWEAK увеличивается по мере роста опухоли. При совместном культивировании клеток РПЖ с макрофагами уровень секреции TWEAK в раковых клетках был значительно повышен. Подавление TWEAK аннулировало эффекты прокахексии, вызванные макрофагами. У мышей Ccr2−/− с опухолью экспрессия TWEAK оказалось снижена по сравнению с диким типом. Это подтверждает, что макрофаги способствуют секреции TWEAK в опухоли, а она, в свою очередь, усиливает экспрессию маркеров мышечной атрофии.
Авторы обратили внимание на то, что в макрофагах при совместном культивировании с опухолевыми клетками активировалась продукция хемокина CCL5. Подавив его активацию, они обнаружили, что ингибирование пути CCL5/CCR5 блокирует экспрессию TWEAK, индуцируемую макрофагами, и приводит к снижению маркеров мышечной атрофии. Известно, что путь NF-κB (p65) является мишенью CCL5 и играет роль в развитии кахексии.
Механизм экспрессии TWEAK, индуцированной CCL5, изучали на культурах клеток «кахексиновых» (CAC), вызывающих тяжелую мышечную атрофию и «некахексиновых» опухолей (non-CAC). В non-CAC было меньше цитокина CCL5, чем в CAC. При трансплантации опухолевых клеток мышам дикого типа это различие сохранялось, но при трансплантации мышам Ccr2−/− уровни CCL5 в опухолях обоих типов были сопоставимы. CCL5 индуцировал экспрессию TWEAK в клеточных линиях CAC, но не в non-CAC. Эти данные свидетельствуют о том, что в опухолях CAC облегчено рекрутирование макрофагов; макрофаги секретируют CCL5, и это способствует секреции TWEAK в раковых клетках (петля прямой связи, см. рисунок).
Сильнее всего в клетках non-CAC было снижено содержание цитокина CCL2. При этом, когда к non-CAC добавили рекомбинатный CCL2, восстановилась способность кокультивированных макрофагов к хемотаксической миграции. Более того, кондиционированная среда, полученная из CCL2-активированных макрофагов, увеличила экспрессию TWEAK в раковых клетках поджелудочной железы.
Наконец, ученые проанализировали экспрессию TWEAK и маркера макрофагов CD68 в опухолевой ткани поджелудочной железы нескольких пациентов и маркера атрофии MuRF1 в мышечных тканях тех же индивидов. У пациентов с тяжелой кахексией (потеря массы тела более чем на 10%) была повышена экспрессия TWEAK и CD68 в опухолевой ткани и снижена экспрессия MuRF1.
Таким образом, авторы не только определили роль макрофагов в развитии кахексии при раке поджелудочной железы, но и расшифровали механизм патологии. Это поможет определить пациентов с повышенным риском кахексии, а также найти подходы к терапии этого состояния.
Мутации, активирующие суперэнхансеры, провоцируют рост рака поджелудочной железы
Источник
Mingyang Liu, et al. The crosstalk between macrophages and cancer cells potentiates pancreatic cancer cachexia // Cancer Cell, published 11 April 2024, DOI: 10.1016/j.ccell.2024.03.009


 Меню
Меню





 Все темы
Все темы




 0
0








