Раскрыт механизм восстановления ДНК после воздействия альдегидов
Японские ученые установили, что ковалентные сшивки между белками и ДНК, образовавшиеся под действием альдегидов, устраняются благодаря репарации, сопряженной с транскрипцией. Неспособность устранять кросс-сшивки между белками и ДНК лежит в основе заболеваний, при которых сопряженная с транскрипцией репарация неактивна, например, атипичного прогероидного синдрома. Результаты, первоначально полученные на клетках, подтвердили на мышах.
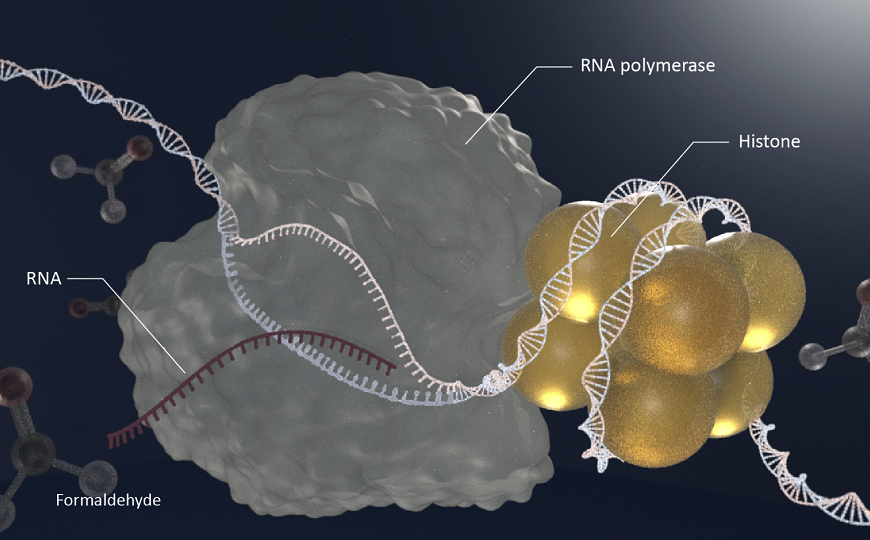
Многие процессы, протекающие в клетке, сопровождаются образованием альдегидов, в частности, формальдегида. Эндогенные альдегиды вызывают образование ковалентных кросс-сшивок между белками и ДНК (DNA-protein crosslinks, DPC), а также сшивок в пределах одной цепи ДНК. Эти повреждения представляют собой серьезное препятствие для репликации и транскрипции. Детоксикацию формальдегида осуществляют алкогольдегидрогеназа 5, которая представляет собой глутатион-зависимую формальдегиддегидрогеназу, и альдегиддегидрогеназа 2. Мутации в соответствующих генах лежат в основе синдрома AMeD, который характеризуется нарушениями в работе многих систем органов из-за накопления формальдегида в тканях. Устранение DPC происходит во время репликации при участии металлопротеиназы SPRTN, в отсутствие которой развивается прогероидный синдром RJALS, характеризующийся предрасположенностью к раку.
Авторы нового исследования, опубликованного в Nature Cell Biology, показали, что вызванные альдегидами повреждения ДНК, препятствующие транскрипции, устраняются путем сопряженной с транскрипцией репарации (TCR). Этот процесс инициируется затормозившей у повреждения РНК-полимеразой II, которая далее убиквитинируется и привлекает транскрипционный фактор TFIIH. TFIIH расплетает ДНК, непосредственно прилегающую к повреждению, и привлекает эндонуклеазы, вырезающие поврежденные нуклеотиды, после чего брешь застраивается.
Используя клетки HeLa, обработанные формальдегидом в течение часа, а также 5’-бромоуридином, который встраивается в новосинтезированные транскрипты, ученые показали, что DPC, образовавшиеся под действием формальдегида, устраняются в транскрипционно активных генах. Чтобы отслеживать кинетику репарации DPC в транскрибируемых участках, авторы разработали специальный метод, получивший название DPC-seq. DPC-seq позволяет картировать DPC по всему геному благодаря преципитации комплексов ДНК с белками и последующему NGS-секвенированию осажденных последовательностей.
Дальнейшие исследования показали, что при ингибировании РНК-полимеразы II DPC не устраняются из транскрипционно активных генов. Не удаляются они и из рибосомной ДНК, транскрипцию которой осуществляет РНК-полимераза I. Таким образом, удаление DPC происходит только в транскрипционно активных генах, за транскрипцию которых отвечает РНК-полимераза II. Далее протеомный анализ показал, что РНК-полимераза II, остановившаяся у DPC, взаимодействует с белками, инициирующими TCR.
Авторы также описали, как после обработки формальдегидом восстанавливается синтез РНК. Нарушения в восстановлении транскрипции наблюдались при делеции ряда генов, необходимых для DPC, в частности, ΔCSA, ΔCSB, ΔUVSSA и POLR2AKR, причем наибольший вклад оказывала делеция CSB — одной из самых крупных субъединиц РНК-полимеразы II. Таким образом, белки, задействованные в TCR, играют важнейшую роль в репарации DPC. Чтобы установить, какие именно белки необходимы для репарации DPC, ученые преципитировали «застрявшую» РНК-полимеразу II и проанализировали связанные с ней белки с помощью масс-спектрометрии. Так было показано, что с ней взаимодействует шаперон VCP/p97 с АТФазной активностью. Анализ участков связывания VPC/p97 с помощью DPC-seq после обработки клеток его ингибиторами, позволил установить, что в отсутствие VCP/p97 репарация DPC не происходит.
Как было показано далее, нуклеосомы, для удаления которых необходим CSB, действительно ковалентно связаны с ДНК. Было также продемонстрировано, что в устранении транскрипционного стресса, вызванного действием альдегидов, задействован транскрипционный фактор TFIIS. Этот белок расщепляет РНК, синтезированную «проскочившей» назад РНК-полимеразой II, и тем самым делает возможным продолжение транскрипции. Как было показано, TFIIS взаимодействует с РНК-полимеразой II, причем CSB на это не влияет. Более того, TFIIS также задействован в удалении DPC, расщепляя транскрипты, оставшиеся после репарации DPC.
Наконец, ученые подтвердили на мышах, что TCR задействован в репарации DPC, поскольку делеции в генах, кодирующих белки, нейтрализующие формальдегид, а также факторы, задействованные в TCR, вызывают у мышей фенотипы, соответствующие AMeDS у человека.
Контроль качества белков в ядре и цитоплазме скоординированы между собой
Источник:
Oka Y., et al. Endogenous aldehyde-induced DNA–protein crosslinks are resolved by transcription-coupled repair. // Nature Cell Biology, 2024, DOI: 10.1038/s41556-024-01401-2


 Меню
Меню





 Все темы
Все темы




 0
0








