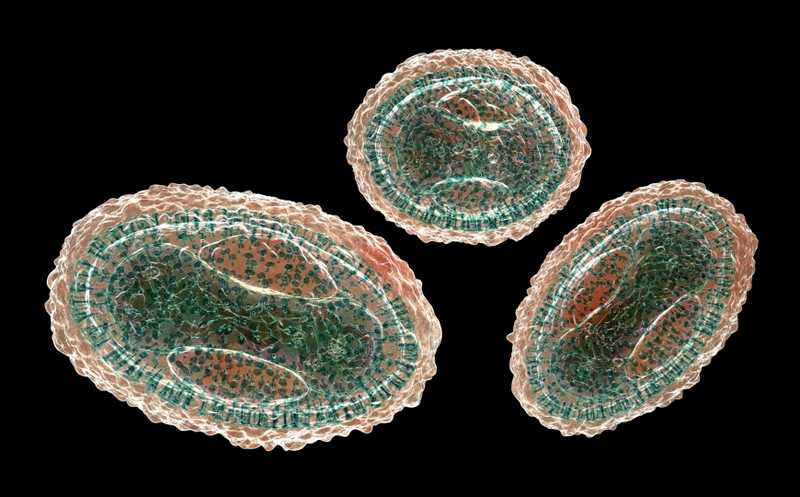
Функциональную яйцеклетку можно создать из гранулезной клетки
Китайские ученые трансформировали гранулезные клетки мышей в ооциты с помощью одного химического воздействия, без трансфекции векторами с генами транскрипционных факторов. После оплодотворения из этих ооцитов развились здоровые животные. Метод химического перепрограммирования гранулезных клеток описан в Cell Reports.

Мышь, полученная из яйцеклетки, в которую превратили гранулезную клетку. Теперь ей около года, и она произвела на свет два помета, 13 и 7 детенышей.
Credit: Lin Liu | Пресс-релиз
Незрелый ооцит в фолликуле яичника окружен слоем гликопротеинов (zona pellucida, блестящая оболочка), который, в свою очередь, окружают гранулезные клетки. «Дело в том, что для экстракорпорального оплодотворения используют только ооцит, — говорит ведущий автор работы Линь Лю из Колледжа естественных наук Нанкайского университета. — После извлечения яйцеклетки гранулезные клетки в фолликуле отбрасывают. Это заставило нас задуматься: а что если мы сможем использовать эти гранулезные клетки? Поскольку каждая яйцеклетка окружена тысячами гранулезных клеток, если мы сможем индуцировать их в плюрипотентные клетки и превращать эти клетки в ооциты, не убьем ли мы двух зайцев сразу?»
Удаленные из фолликулов гранулезные клетки обычно направляются по пути клеточной смерти и дифференцировки. Лю и его сотрудники, в том числе аспиранты Чэнлэй Тянь и Хайфэн Фу, разработали химический «коктейль» с ингибитором важного клеточного регулятора Rho-киназы (ROCK) и кротоновой кислотой, чтобы культивировать гранулезные клетки и превратить их в химически индуцированные плюрипотентные стволовые клетки (CiPSCs). Ингибитор ROCK предотвращает гибель клеток и способствует пролиферации. Кротоновая кислота, как обнаружили авторы ранее, активирует гены эмбриона, экспрессирующиеся на стадии двух клеток, в частности, ген Zscan4. В сочетании с другими веществами она облегчает гранулезным клеткам приобретение плюрипотентности, такой же, как у эмбриональных стволовых клеток. Это было проверено по экспрессии маркеров плюрипотентности Oct4-GFP, Sox2 и Nanog, в частности, по уровням метилирования промоторов их генов. Также одним из важных показателей была реактивация второй Х-хромосомы. Клетки успешно дифференцировались в эктодерму, мезодерму и энтодерму.
«Это удивительный результат, — объясняет Лю. — Компетенция индуцированной плюрипотентной клетки зародышевой линии обычно ниже, чем у эмбриональных стволовых клеток».
Чтобы улучшить развитие нового фолликула и вызвать мейоз, к клеткам, культивируемым в особых условиях, добавляли еще один «коктейль», включающий ингибитор ROCK и аскорбиновую кислоту. Полученные ооциты обладали высокой геномной стабильностью. В результате созревания яйцеклеток и оплодотворения in vitro родились здоровые мыши, которые сами дали потомство.
По сравнению с традиционными методами индукции стволовых клеток, такими как трансфекция, перепрограммирующая соматические клетки путем введения генов транскрипционных факторов, химическая обработка обеспечивает лучший контроль. «Метод трансфекции может быть сопряжен с более высоким риском генетической нестабильности», — сказал Лю.
Очевидно, что до испытаний на людях еще очень далеко, тем не менее, эта работа открывает новые перспективы в репродуктивной биологии и медицине.
Источники
Chenglei Tian, et al. // Functional Oocytes Derived from Granulosa Cells. // Cell Reports, 2019, 29, 13, P4256-4267.E9, DOI: 10.1016/j.celrep.2019.11.080
Цитаты по пресс-релизу








 Меню
Меню





 Все темы
Все темы





 0
0