Избыточная экспрессия рецепторов липопротеинов низкой плотности подавляет таупатию у мышей
Если у мышей с предрасположенностью к тау-ассоциированной нейродегенерации повысить экспрессию рецепторов липопротеинов низкой плотности (ЛПНП), у них снижается уровень белка АпоЕ и активация микроглии. В результате накопление клубков тау-белка и повреждение головного мозга идет менее интенсивно.
Credit: Juan Gaertner | 123rf.com
Аполипопротеин E (АпоЕ) — белок, вовлеченный в развитие болезни Альцгеймера, — регулирует отложение амилоидных бляшек в мозгу. Недавние исследования на мышах показали, что он также участвует в нейродегенерации, обусловленной таупатией. Повышенный уровень АпоЕ в спинномозговой жидкости приводит к стимуляции некоторых компонентов микроглии, которые зачищают участки с тау-клубками. В результате чрезмерной активности клеток микроглии повреждается нервная ткань. В дальнейшем объем повреждений вырастает и приводит к дегенерации тканей головного мозга, сопровождающейся проблемами с памятью и мышлением.
АпоE распознается и связывается рецепторами липопротеинов низкой плотности (рЛПНП), а затем направляется в лизосомы для дальнейшей деградации. Ученые из США, Германии и Японии предположили, что уменьшение уровня АпоЕ за счет увеличения экспрессии рЛПНП снизит активность клеток микроглии и объемы повреждения головного мозга.
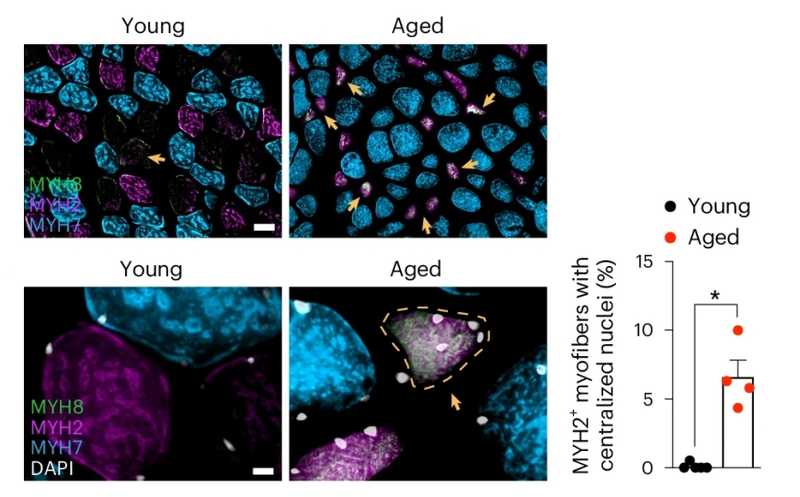
Для проверки этой гипотезы ученые получили две линии мышей: с предрасположенностью к тау-ассоциированной дегенерации (P301S) и с оверэкспрессией рЛПНП (LDLR), скрестили эти линии и исследовали у потомства корреляции уровня АпоЕ с различными формами тау-белка, а также объемы повреждения головного мозга. В качестве контроля использовали мышей дикого типа, P301S и LDLR в возрасте девяти месяцев (этот возраст соответствует среднему возрасту человека). Дополнительно авторы получили мышей с предрасположенностью к таупатии и дефицитом АпоЕ, скрестив линии P301S и EKO, нокаутную по APOE.
Оказалось, что особи с предрасположенностью к тау-ассоциированной нейродегенерации и оверэкспрессией рЛПНП (P301S/LDLR) имеют более низкие уровни патогенного фосфорилированного тау-белка и гораздо меньшие очаги повреждения головного мозга по сравнению с мышами без оверэкспрессии рЛПНП. Более детальное исследование показало, что оверэкспрессия рЛПНП в клетках микроглии подавляет экспрессию АпоЕ в них же, а при дефиците АпоЕ активация микроглии снижается. Оверэкспрессия рЛПНП и дефицит АпоЕ смещают метаболизм микроглии в сторону катаболизма. Кроме того, при активации микроглии с избыточной экспрессией рЛПНП происходит апрегуляция специфических ионных каналов и рецепторов нейротрансмиттеров. Мыши P301S/LDLR и P301S/EKO обладают увеличенными пулами клеток-предшественников олигодендроцитов и демонстрируют большую сохранность миелина на фоне предрасположенности к нейродегенерации.
По словам главного автора работы профессора Дэвида Хольцмана, заведующего кафедрой неврологии в Университете Вашингтона в Сент-Луисе, направленное увеличение экспрессии рЛПНП будет эффективным способом борьбы с болезнью Альцгеймера на стадии дегенерации.Источник
Shi, Y., et al. // Overexpressing low-density lipoprotein receptor reduces tau-associated neurodegeneration in relation to apoE-linked mechanisms. // Neuron 109, 1–14, published online 21 June 2021; DOI: 10.1016/j.neuron.2021.05.034








 Меню
Меню





 Все темы
Все темы





 0
0