Лекарства от рака не то, чем кажутся?
Многие современные онкопрепараты нацелены на специфические клеточные белки, которые управляют ростом опухолей. Эта стратегия продемонстрировала блестящие успехи. Но, как выяснили сотрудники лаборатории Колд-Спринг-Харбор (Нью-Йорк), если инактивировать ген предполагаемого белка-мишени с помощью CRISPR, кандидатные противоопухолевые препараты все еще убивают опухолевые клетки. Это значит, что они используют не те механизмы, которые предполагали разработчики.
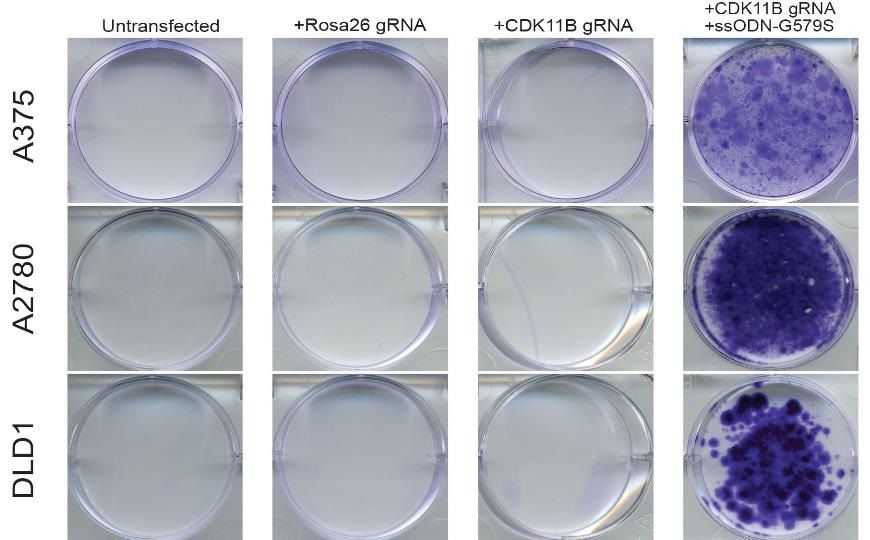
Различные линии раковых клеток подвергали CRISPR-редактированию (Rosa26 — негативный контроль, локус, не связанный с действием лекарства) и затем обрабатывали препаратом OTS964. Все клетки погибли, за исключением тех, которые несли определенную мутацию (G579S) в гене CDK11. Клетки окрашены кристаллическим фиолетовым. Credit: Пресс-релиз Колд-Спринг-Харбор
Исследование, опубликованное в журнале Science Translational Medicine, показало, что старые инструменты сайленсинга (выключения) генов не идеально подходят для подтверждения механизма действия лекарства. Хорошая новость в том, что есть и другие инструменты.
Ранее выключения гена использовали РНК-интерференцию (РНКи): в раковые клетки вводили РНК, которые взаимодействовали с матричными РНК определенных белков и запускали их разрушение. Несколько лет назад Джейсон Шелцер из Колд-Спринг-Харбор и его коллеги отключили известный фактор роста MELK в раковых клетках с помощью CRISPR, а не РНКи. (Целью работы был поиск генов, ассоциированных с низкой выживаемостью онкобольных.) Несколько компаний в то время разрабатывали противораковые лекарства, содержащие ингибиторы MELK. Однако клетки с дефицитом MELK продолжали расти, что само по себе было удивительным результатом. При этом препарат, предположительно таргетирующий MELK, по-прежнему останавливал рост клеток, невзирая на отсутствие мишени.
Заинтригованные исследователи решили проверить другие лекарства, которые были нацелены на белки, обнаруженные главным образом с помощью РНКи. В итоге выявили 10 препаратов, нацеленных на шесть белков, чья роль варьировала от стимулирования пролиферации клеток до контроля активности онкогенов. Все эти препараты в настоящее время проходят клинические или доклинические испытания.
Когда ученые использовали CRISPR для уничтожения генов предполагаемых белков-мишеней в различных линиях раковых клеток, они точно так же продолжали расти. Тем не менее, когда команда обрабатывала клетки соответствующим лекарством, они погибали, хотя в теории должны были оставаться неуязвимыми для данного препарата. «Многие из предыдущих результатов были воспроизводимы, но интерпретация была неверной», — говорит Шелцер.
Исследователи также нашли ключ к реальному механизму действия препарата OTS964 (компания OncoTherapy Science), которое сейчас находится на доклинических испытаниях. Этот препарат предположительно блокирует киназу PBK, способствующую делению клеток. Клетки подвергли действию препарата в очень высоких концентрациях, и выявили субклоны, у которых развилась резистентность к препарату. Секвенировав эти клетки на предмет мутаций устойчивости, лаборатория показала, что препарат на самом деле блокирует циклин-зависимую киназу CDK11, которая играет другую роль в пролиферации клеток: мутация в ее гене и делала клетки устойчивыми. Шелцер называет этот результат «воодушевляющим» — известно, что ингибиторы других CDK эффективны против рака молочной железы.
Некоторые из результатов можно поставить под сомнение. Еще один препарат из списка, по заявлениям разработчика, активирует белок каспазу-3, который заставляет клетки самоуничтожиться; ген этой каспазы и был отключен. Но химик Пол Хергенротер из Университета Иллинойса в Урбане отмечает, что препарат также активирует другой белок с аналогичной функцией. Поэтому группа Шелцера должна была бы отключить гены обоих белков, прежде чем говорить о возможном ином механизме. Еще одна оговорка, которую делают сами авторы: некоторые из заявленных белковых мишеней препаратов могут действовать не изнутри клетки, а извне, например, стимулируя другие клетки секретировать молекулы, которые питают растущую опухоль.
Так или иначе, исследование породило скепсис в отношении скрининга с помощью РНКи для выявления потенциальных лекарств от рака. Специалисты призывают в дальнейшем пользоваться несколькими методами, поскольку и применение CRISPR может давать нецелевые эффекты.
Источники
Ann Lin, et al. // Off-target toxicity is a common mechanism of action of cancer drugs undergoing clinical trials. // Science Translational Medicine, 2019; DOI: 10.1126/scitranslmed.aaw8412
Jocelyn Kaiser. // Some cancer drugs miss their target. CRISPR could improve their aim. // Science, 2019; DOI: 10.1126/science.aaz4690


 Меню
Меню





 Все темы
Все темы




 0
0