Накопление бета-амилоида в нейронах при болезни Альцгеймера регулируется холестерином
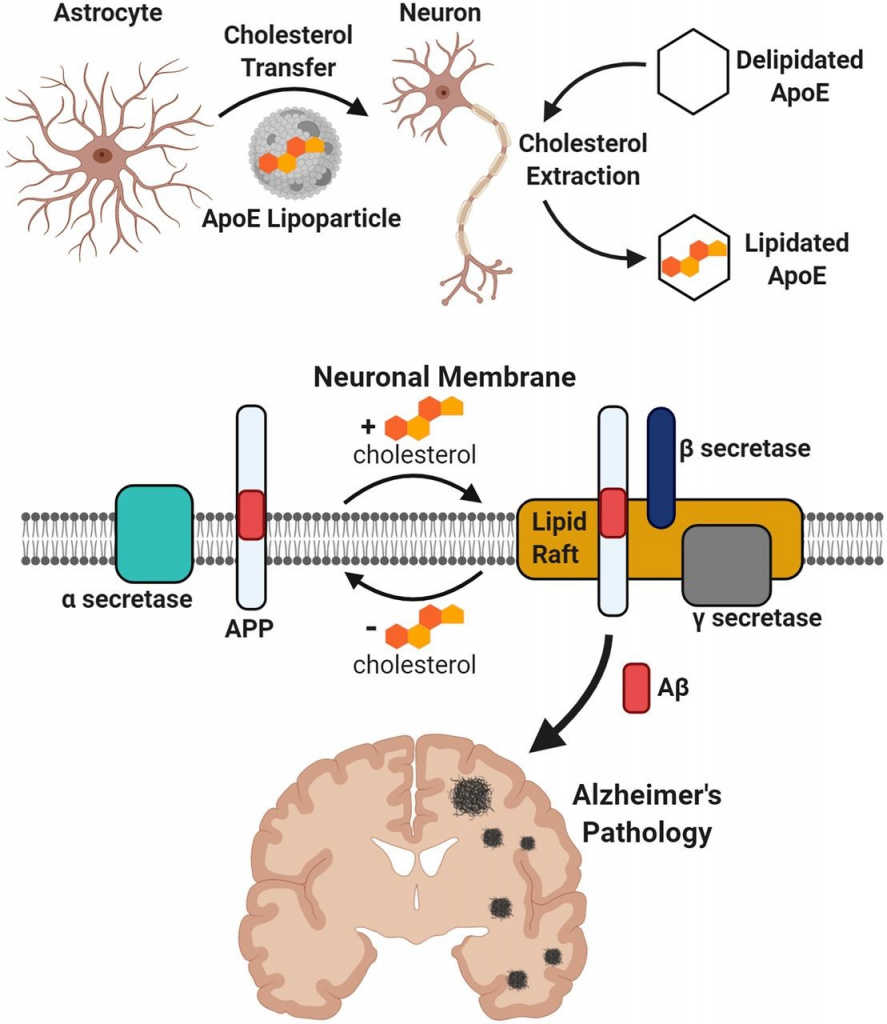
Ученые из США исследовали роль холестерина в регуляции образования амилоидных бляшек при болезни Альцгеймера. Холестерин образуется в астроцитах и транспортируется в нейроны. Там он делает белок-предшественник доступным для ферментов, которые и образуют β-амилоиды.
Credit: Scott Hansen Lab, Scripps Research, Jupiter, Florida | Пресс-релиз
Группа ученых из Scripps Research с коллегами исследовала регуляцию накопления β-амилоида в нейронах при болезни Альцгеймера. С помощью методов микроскопии с высокой степенью разрешения и экспериментов на трансгенных мышах авторы установили, что холестерин, который синтезируется в астроцитах и доставляется в нейроны аполипопротеином Е, регулирует процессинг предшественника β-амилоида (АРР) секретазами и связан с образованием липидных рафтов.
Болезнь Альцгеймера — самое распространенное нейродегенеративное заболевание — характеризуется накоплением в клетках мозга бляшек β-амилоида (Aβ) и фосфорилированного тау-белка. Aβ — это пептид, который образуется из предшественника APP, интегрального мембранного белка, с помощью специальных протеаз — β- и γ-секретаз. Эти секретазы локализованы в структурированных кластерах плазматических мембран — липидных рафтах.
Альтернативный процессинг APP осуществляет α-секретаза, конвертирующая его в растворимую молекулу sAPP-α, что предотвращает образование амилоидных бляшек. Считается, что этот процесс происходит не в липидных рафтах, а в «неорганизованной» части мембраны.
Оба этих метаболических пути регулируются холестерином, который влияет на структуру мембран. Накопление Aβ происходит в нейронах, не синтезирующих холестерин во взрослом организме. Выработку холестерина осуществляют другие клетки мозга, астроциты, из которых холестерин попадает в нейроны с помощью аполипопротеина Е (АроЕ). Одна из изоформ АроЕ (ε4) ассоциирована с повышенным риском развития болезни Альцгеймера. Таким образом, предполагается, что астроциты через выработку холестерина регулируют образование липидных рафтов, влияя на процессинг АРР и на развитие болезни Альцгеймера.
Изучение липидных кластеров до недавнего времени было затруднено из-за их небольших размеров. В новой работе ученые использовали метод визуализации со сверхвысоким разрешением dSTORM. На культурах нейронов мышей дикого типа сначала определили, что секретазы α и γ ассоциированы с липидными рафтами, в то время как секретаза α связана с другими участками мембраны. Обработка нейронов АроЕ с холестерином и без регулировала трансфер АРР из липидных рафтов в «неорганизованную» часть мембраны и обратно, в то время как секретазы оставались на месте независимо от стимуляции.
Обработка эмбриональных мышиных нейронов, очищенных от астроцитов, АроЕ без холестерина приводила к увеличению количества АРР на «неорганизованной» мембране. Та же процедура на культуре, в которой присутствовали нейроны вместе с астроцитами, приводила к обнаружению большей части АРР в липидных рафтах.
Роль астроцитов в регуляции локализации АРР была подтверждена на линии трансгенных 3xTg-AD мышей, у которых запрограммирована способность производить большое количество Aβ. У мышей провели нокаут с помощью Cre-Lox рекомбинации по гену SREBP2, контролирующему синтез холестерина в астроцитах. В срезах мозга таких мышей наблюдалось снижение количества АРР в липидных рафтах по сравнению с мышами без нокаута. Также ИФА показал существенное снижение Aβ и фосфорилированного тау-белка в мозге мышей с нокаутом до показателей, характерных для мышей дикого типа.
В настоящее время авторы исследуют влияние АроЕ-опосредованной доставки холестерина астроцитами на воспалительные процессы в мозге. Они рассчитывают, что это дополнит картину изменений, происходящих при болезни Альцгеймера и приблизит разработку терапии.
 Credit: Hao Wang, et al. DOI:
10.1073/pnas.2102191118
Credit: Hao Wang, et al. DOI:
10.1073/pnas.2102191118
Источник
Hao Wang, et al. Regulation of beta-amyloid production in neurons by astrocyte-derived cholesterol // PNAS August 17, 2021 118 (33) e2102191118; DOI: 10.1073/pnas.2102191118


 Меню
Меню





 Все темы
Все темы




 0
0







