Nested CRISPR вставил гены флуоресцирующих белков в клетки C. elegans
Редактирование генома при помощи CRISPR-Cas базируется на внесении разрывов в ДНК. В эти разрывы можно вставлять новые последовательности, что не всегда эффективно для длинных вставок. Группа исследователей из Барселоны разработала метод Nested CRISPR (дословно: Гнездовой CRISPR) для внедрения генов флуоресцирующих белков в клетки червя Caenorhabditis elegans. Статья опубликована в Genetics.
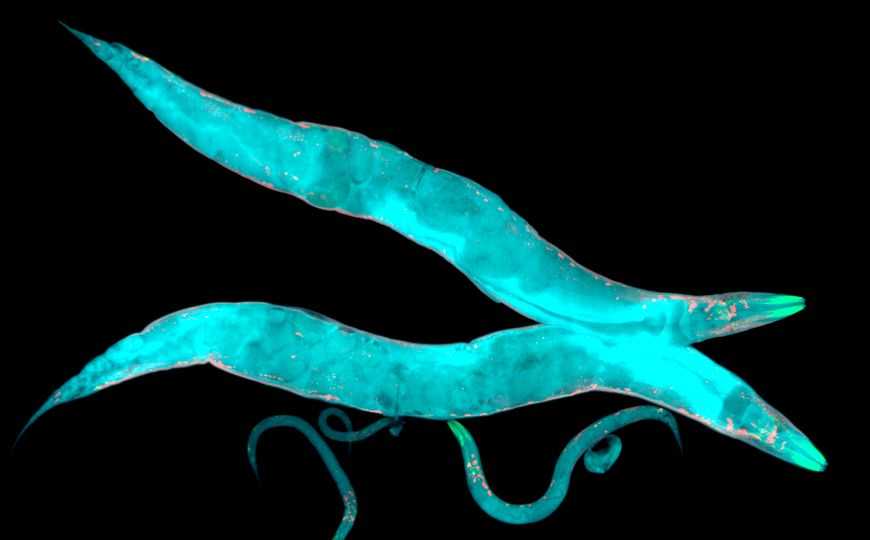
C. elegans — модельный объект, который лаборатория Хулиана Серона (Julián Cerón), главного автора исследования, использует для изучения молекулярных основ заболеваний человека. В предыдущих работах на этом черве генетические модификации вносились методом CRISPR несколькими способами. В половых клетках червя в отсутствие матрицы для восстановления разорванных участков ДНК репарацию осуществляет ДНК-полимераза тета, после чего в цепи остаются небольшие изменения — этот метод использовался для получения неспецифических мутаций. Если же в ядре находятся двух- или одноцепочечные фрагменты ДНК-матрицы, сходные с местом разрыва, репарация осуществляется на их основе. Благодаря этому можно вставить отрезки ДНК в определенные места генома. Метод хорошо работает с короткими вставками, однако до сих пор не было эффективного способа внесения длинных участков ДНК в геном.
Ученые использовали механизм репарации, описанный выше, для разработки метода Nested CRISPR, позволившего внести в геном относительно большой ген длиной 865 нуклеотидов. Удалось связать белки клеток червя с флуоресцентными репортерами. Вставку генов флуоресцентных белков в половые клетки осуществляли в два этапа. Сначала при помощи CRISPR-системы исследователи вносили разрыв рядом с нужным геном, после чего осуществлялась репарация на основе одноцепочечной ДНК, несущей концевые участки гена EGFP. На втором этапе производили разрыв между этими участками, репарация которого проходила при помощи двухцепочечной ДНК с целым геном EGFP. Таким образом, средний участок гена вставляли между двумя концевыми, внесенными на первом этапе, представляющими из себя как-бы «гнездо» для середины гена.
Метод работает и с другими флуоресцентными белками.
Также ученые продемонстрировали, что при помощи Nested CRISPR можно вырезать ген и вставить на его место ген EGFP. Стоит отметить, что два этапа введения флуоресцентного белка в клетки червя требуют манипуляций с пятью поколениями. Это может быть проблемой для животных с более длинным жизненным циклом. Исследователи попробовали сократить метод до одного этапа. Эффективность введения генов была в разы ниже, чем в случае двух стадий.
Внедрение флуоресцентных репортеров можно использовать для изучения молекулярных последствий мутаций человеческих генов на C. elegans.


 Меню
Меню





 Все темы
Все темы




 0
0








