Новая вакцина против вируса Эпштейна-Барр содержит 20 эпитопов и гликопротеин
В работе, опубликованной в журнале Nature Communications, предложена новая вакцина против вируса Эпштейна-Барр (ВЭБ). Вакцина содержит модифицированный белок, включающий 20 Т-клеточных эпитопов ВЭБ, и полноразмерный вирусный гликопротеин gp350, а также амфифильный адъювант. У мышей полученный вакцинный препарат формировал гуморальный и клеточный иммунный ответ, который сохранялся по крайней мере семь месяцев после вакцинации и защищал их от ВЭБ-ассоциированных заболеваний.
Международная группа ученых разработала вакцину, основанную на отдельных эпитопах вируса Эпштейна-Барр (ВЭБ), для стимуляции мощного и стойкого гуморального и клеточного иммунитета. В качестве адъюванта авторы использовали Amphiphile-CpG (AMP-CpG), который в разы увеличивал иммуногенность разработанной вакцины. Оценку иммунного ответа проводили на модельных мышах. У мышей сформировались нейтрализующие антитела, специфичные к ВЭБ, а также произошла активация CD4+ и CD8+ Т-клеток, специфично реагирующих на антиген.
Вирус герпеса 4 типа, известный как ВЭБ, распространен повсеместно: порядка 95% взрослого населения мира являются носителями. Как правило, этот вирус передается через слюну, у детей протекает бессимптомно или с умеренными симптомами. У некоторых людей развивается инфекционный мононуклеоз. Считается, что инфекционный мононуклеоз повышает риск развития ВЭБ-ассоциированных заболеваний, таких как рассеянный склероз и лимфома Ходжкина. ВЭБ также считают основным этиологическим агентом лимфоидного и эпителиального рака; так, ежегодно в мире насчитывается около 200 тысяч новых случаев ВЭБ-ассоциированных онкологических заболеваний.
Хотя вакцины против ВЭБ разрабатывают уже много лет, к настоящему времени нет ни одного эффективного и безопасного препарата. У лиц, инфицированных ВЭБ, сывороточные антитела к вирусному гликопротеину gp350 способны нейтрализовать вирус, предотвращая инфицирование В-клеток и эпителиальных клеток. Нейтрализующие антитела обеспечивают первую линию защиты от острой вирусной инфекции, однако долгосрочный контроль латентно-инфицированных В-клеток в большей степени зависит от Т-клеток. Поэтому формирование мощного и стойкого Т-клеточного иммунитета посредством вакцинации может предотвратить прогрессирование латентной инфекции ВЭБ и, возможно, последующее развитие ВЭБ-ассоциированных аутоиммунных заболеваний и рака.
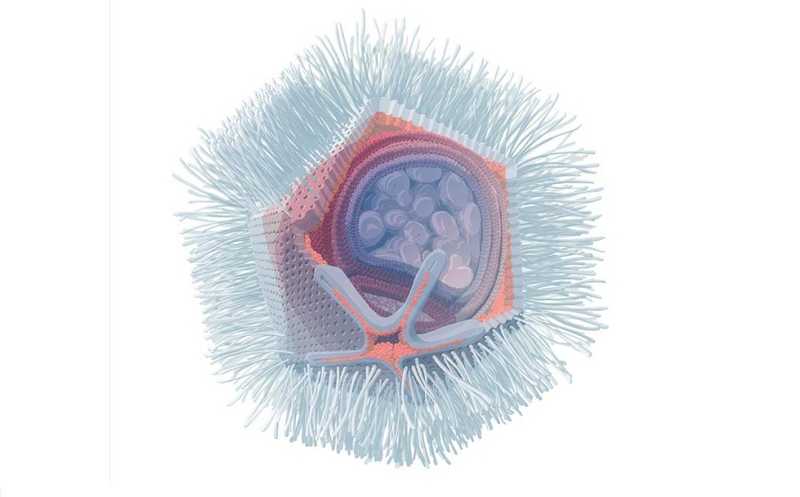
Авторы пришли к выводу, что оптимальная вакцина против ВЭБ должна стимулировать как клеточный, так и гуморальный иммунитет, которые формируют вирусные гликопротеины, литические и латентные антигены, включая ядерные антигены ВЭБ и латентные мембранные белки. Хотя использование субъединичной вакцины кажется привлекательной стратегией, полноразмерные латентные белки вируса могут запускать онкогенез, что ограничивает их использование в качестве иммуногенов. Авторы создали структуру, напоминающую «бусины на нитке», из 20 отдельных высококонсервативных CD8+ Т-клеточных эпитопов (EBVpoly), которые разделены между собой сайтами для протеолитического расщепления. К концу каждого эпитопа пришили последовательность, которая облегчает его процессинг для презентации главному комплексу гистосовместимости, тем самым повышая иммуногенность всей конструкции. Кроме того, в конструкцию добавили полноразмерный белок gp350 — основной гликопротеин вирусного капсида, который приводит к формированию гуморального ответа. Для лучшей активации лимфатической системы использовали адъювант AMP-CpG. Амфифильный компонент в составе адъюванта позволяет легко перемещаться через биологические мембраны, а CpG-олигонуклеотиды обладают иммуномодулирующими свойствами.
Гуморальный и клеточный иммунный ответ изучили на мышах. Авторы показали CD4+ и CD8+ T-клеточную иммуногенность EBVpoly, которая усиливалась в присутствии AMP-CpG. Помимо усиления клеточного иммунного ответа, адъювант AMP-CpG в 16–25 раз увеличивал титры нейтрализующих антител по сравнению с просто растворимой формой CpG. Более того, титры нейтрализующих антител у мышей, вакцинированных с AMP-CpG, в 31 раз превышали титры носителей ЭБВ.
Еще одним важным аспектом разработки вакцины против ВЭБ является долговременное сохранение иммунитета. Клеточный и гуморальный иммунный ответ, индуцированный вакциной против ВЭБ с AMP-CpG в составе, сохранялся у мышей более семи месяцев. Интересно, что титры IgG против gp350 практически не изменились в ходе периода наблюдения.
Для оценки эффективности защиты новой вакцины от ВЭБ-ассоциированной клеточной лимфомы использовали мышей линии NRG с нокаутом генов Rag1 и IL2Rγc, играющих важную роль в иммунной системе. У этих мышей развивается лимфома при воздействии ВЭБ. Животным переносили EBVpoly-стимулированные Т-клетки и gp350-специфические антитела. Авторы показали, что развитие сильного T-клеточного иммунного ответа против ВЭБ, стимулированного EBVpoly, с gp350-специфическими антителами или без них способно эффективно подавлять распространение ВЭБ-ассоциированной лимфомы in vivo.
Авторы подчеркивают, что возможность индукции клеточного иммунитета и нейтрализующих антител с помощью вакцины важно для профилактики заболеваний, связанных с первичной инфекцией (инфекционный мононуклеоз) и хронической латентной инфекцией (рассеянный склероз и злокачественные новообразования, вызванные ВЭБ).
Вирус Эпштейна–Барр может оказаться главным фактором развития рассеянного склероза
Источник:
Dasari V., et al. Lymph node targeted multi-epitope subunit vaccine promotes effective immunity to EBV in HLA-expressing mice // Nature Communications 14, 4371 (2023). DOI: 10.1038/s41467-023-39770-1








 Меню
Меню





 Все темы
Все темы





 0
0