Новый метод визуализации опухолей выявил пространственные маркеры прогрессирования заболевания
Ученые из США разработали платформу «Орион» для сборки изображений мультиплексной иммунофлуоресценции и окрашивания гематоксилином и эозином одних и тех же образцов опухолевых тканей. Метод продемонстрировал эффективность и воспроизводимость; он пригоден для диагностических целей, а также позволяет выявлять в опухолях структуры, ассоциированные с прогрессированием заболевания.
Lin J-R., et al. Nature Cancer. DOI: 10.1038/s43018-023-00576-1
Персонализированная медицина опирается на современные методы диагностики, а также на прогнозирование индивидуальных реакций на лекарственные препараты. В основе диагностики рака лежит окрашивание тканей гематоксилином и эозином (H&E). Тем не менее, новые методы визуализации тканей позволяют получать данные о единичных клетках с пространственным разрешением. Ученые из США разработали платформу «Орион», позволяющую собирать изображения H&E и мультиплексную иммунофлуоресценцию (мИФ) с одних и тех же образцов, что делает ее пригодной для диагностических целей, в частности, для поиска клинических биомаркеров.
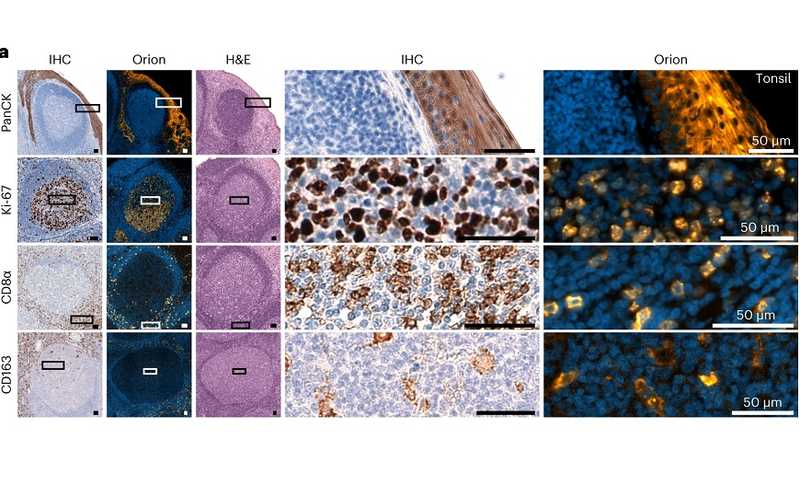
На первом этапе авторы разработали платформу «Орион» для визуализации мИФ и H&E того же участка ткани. Исследователи подчеркнули, что одновременная мультиплексная визуализация образцов тканей требует инноваций в оптической платформе, а также тщательного подбора флуорофоров, и что никто такую технологию до них не разрабатывал. Так, были использованы семь лазеров и множество оптических фильтров для получения изображения с «Ориона». Затем изображения обрабатывались для корректировки системных ошибок, таких как геометрические искажения и нелинейность камеры, после чего проводилась спектральная экстракция для устранения перекрестных помех и выделения сигналов отдельных флуорофоров (и, соответственно, антител, с которыми они были конъюгированы). Затем с помощью программного обеспечения MCMICRO были рассчитаны характеристики отдельных клеток и участков ткани. Авторы также проанализировали более 100 флуорофоров для нахождения оптимальных, эффективно работающих друг с другом. Ученые обнаружили, что окрашивание H&E можно проводить с помощью стандартных устройств для окрашивания предметных стекол после одного или небольшого количества циклов ИФ.
Для валидации подхода были собраны три типа данных: (1) цельные изображения миндалин человека — стандартной ткани для валидации антител — и рака легких человека; (2) изображения ТМА (tumor microarrays), содержащие 30 различных типов образцов неопухолевых заболеваний, а также образцы опухолей из 18 тканей; (3) 74 изображения образцов колоректального рака (КРР). Осмотр изображений легких, миндалин и КРР подтвердил безошибочную визуализацию.
Анализ воспроизводимости метода показал, что шесть пар одних и тех же образцов, визуализированных разными лабораториями, выглядели очень похоже, и когда данные о количестве клеток на всех 12 изображениях были подвергнуты неконтролируемой кластеризации, эффекта расслоения данных не наблюдалось. Кроме того, метод «Орион» воспроизводимо генерирует результаты, схожие с результатами, полученными с помощью обычной иммуногистохимии (IHC), а количественные показатели интенсивности маркеров схожи между «Орионом» и другой платформой для мультиплексной визуализации — CyCIF.
На следующем этапе авторы проанализировали различия мИФ и H&E изображений одних и тех же образцов. Так, при сравнении данных H&E и мИФ на одних и тех же клетках ученые обнаружили, что мИФ позволяет более точно идентифицировать лимфоциты, чем при просмотре изображений H&E. Например, линии CD4+ и CD8+ Т-клеток и В-клеток выглядят одинаково на H&E, но различимы при мИФ. С другой стороны, было выявлено множество типов клеток и клеточных состояний, которые легче определялись на изображениях H&E по морфологическим признакам, чем при окрашивании мИФ; к ним относятся эозинофилы и нейтрофилы с характерной морфологией при H&E, а также стадии профазы, метафазы, анафазы и телофазы митоза. Разнообразные неклеточные структуры, такие как базальные мембраны, скопления муцина, некротические домены и т.д., также легче определялись на изображениях H&E, чем мИФ.
Далее, авторы использовали платформу «Орион», чтобы идентифицировать особенности опухолей, которые могли бы предсказывать прогрессирование заболевания. Известно, что для КРР в клинической практике существует так называемая иммунная оценка (Immunoscore), которая учитывает особенности иммунного ответа опухоли для прогнозирования развития КРР по показателям выживаемости без прогрессирования (PFS) или общей выживаемости (OS). Immunoscore использует IHC для оценки количества CD3+ и CD8+ Т-клеток в опухолевом центре и инвазивном крае.
Используя данные «Ориона», авторы разработали программные сценарии для воспроизведения ключевых аспектов Immunoscore с использованием PFS в качестве исхода. Анализ изображений опухолей, демонстрирующих медленную прогрессию, выявил большое количество PD-L1+ клеток рядом с опухолевыми клетками; на основании совпадения окрашивания PD-L1, CD68 и CD45 исследователи пришли к выводу, что PD-L1+ клетки, вероятно, миелоидного происхождения. Окрашенные α-SMA стромальные клетки (скорее всего, это были фибробласты) также были инфильтрированы CD4+ Т-клетками. Напротив, в образцах пациентов с быстрой прогрессией заболевания уровень PD-L1 был ниже, а CD4+ клетки были менее многочисленны в строме. По данным H&E, в опухолях с медленным прогрессированием наблюдалось обширное лимфогистиоцитарное хроническое воспаление, включая крупные лимфоидные агрегаты и третичные лимфоидные структуры (ТЛС) тогда как в опухолях с быстрым прогрессированием было относительно мало лимфоидных агрегатов и отсутствовали ТЛС.
В конце авторы использовали платформу для нахождения новых маркеров, предсказывающих прогрессирование заболевания. Исследователи использовали пространственное латентное распределение Дирихле (Spatial-LDA) для выявления новых моделей прогрессии в раке. Они применили этот метод к данным мультиплексной визуализации тканей и обнаружили отдельные присущие опухоли особенности, связанные с плохой выживаемостью. Анализируя данные высокоплексной иммунофлуоресценции, они выявили 12 пространственных признаков (тем), которые совпадали во всем наборе данных. Примечательно, что тема 7 показала сильную отрицательную корреляцию с PFS. Анализ кривой Каплана-Мейера подтвердил связь темы 7 с плохим прогнозом.
Для улучшения интерпретации исследователи перенесли маркеры с ИФ на изображения H&E и обучили сверточную нейронную сеть (CNN) на данных H&E. Они обнаружили, что тема 7 соответствует плохо дифференцированным опухолям поздних стадий со стромальной инвазией. Эти результаты соответствовали молекулярным и морфологическим особенностям, связанным с прогрессированием КРР.
Полученные результаты свидетельствуют о том, что объединение иммунологических и присущих опухоли признаков может привести к созданию надежных прогностических моделей в онкологии. Исследование подчеркивает важность интерпретируемости для повышения доверия и облегчения клинического применения потенциальных биомаркеров.
Genomics England создает платформу для мультимодального представления онкологических данных
Источник:
Lin J-R., et al. High-plex immunofluorescence imaging and traditional histology of the same tissue section for discovering image-based biomarkers // Nature Cancer. Published online 22 June 2023, DOI: 10.1038/s43018-023-00576-1


 Меню
Меню





 Все темы
Все темы




 0
0








