Оптофлюидный чип с нанопорами избирательно ловит молекулы
Команда, возглавляемая исследователями из Калифорнийского университета в Санта-Круз и Университета Бригама Янга, разработала программируемый чип, который объединяет нанопоры, оптофлюидику и электронную схему управления, чтобы отбирать из раствора, сортировать и анализировать молекулы и частицы.
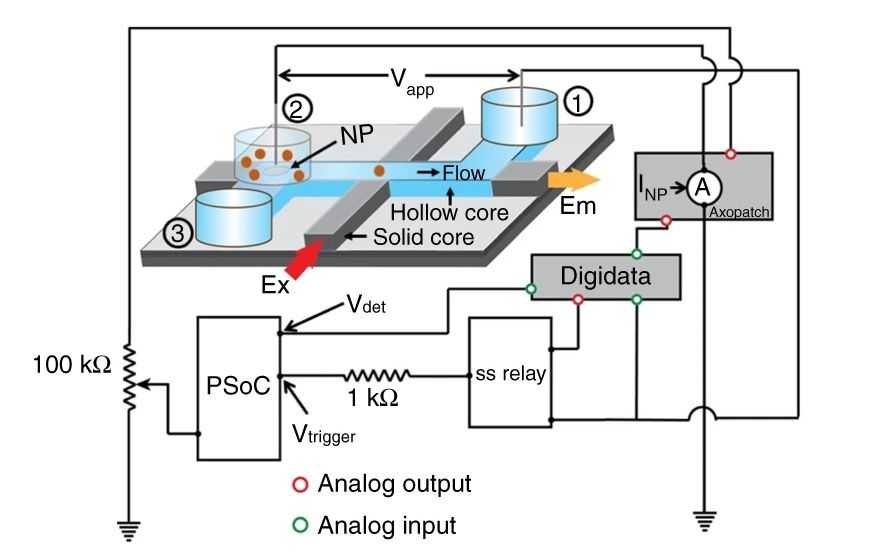
Нанопоровый оптофлюидный чип содержит волновод с жидким сердечником (он же микрофлюидный канал, показан голубым) и волновод с твердым сердечником (серый). Частицы вводятся в микрофлюидный канал за счет приложения напряжения к резервуарам 1 и 2, причем резервуар 2 расположен над нанопорой. Флуоресценция возбуждается через волновод с твердым сердечником и регистрируется через жидкий сердечник. Микросхема соединена с управляющей электронной схемой. Credit: Nature Communications, 2019, volume 10, Article number: 3712 | СС 4.0
Идея была в том, чтобы создать инструмент, который мог бы выбирать целевые молекулы и удерживать их для дальнейших экспериментов. Первая разработка была представлена в 2014 году. Теперь она дополнена новой схемой управления с обратной связью. «Интеллектуальные ворота» инструмента теперь могут доставлять в микроканал на чипе до трех различных молекул по выбору экспериментатора. В новой публикации возможности оптофлюидного устройства были испытаны на бактериальных 70S рибосомах и молекулах ДНК.
Оптофлюидный чип содержит микрофлюидный канал, который действует как оптический волновод с жидким сердечником и, соединяясь с волноводами с твердым сердечником, обеспечивает волоконно-оптический вход и выход. Исследователи могут вводить образец, прикладывая напряжение к жидкостным резервуарам в конце каждого канала. Микроконтроллер инструмента выполняет анализ тока через нанопоры в реальном времени. Когда волна тока поднимается выше порогового значения, микроконтроллер регистрирует перемещение молекулы. После того, как определенное количество частиц прошло через нанопору, исследователи могут использовать твердотельное реле для отключения напряжения возбуждения нанопоры, чтобы закрыть ворота. Обычно за один прогон через канал проходит мало жидкости, однако это количество можно увеличить до миллилитров, если необходимо собрать целевые молекулы из большого объема.
В данном исследовании размер нанопоры был таков, что через нее могла проходить только одна рибосома. Это позволяет захватить единственную целевую частицу внутри области анализа. Возможности экстракции индивидуальных биомолекул были проверены на цепях ДНК, вирусных белках, рибосомах и молекулах целлюлозы; аналогичным образом можно исследовать и бактериальные биомолекулы.
Система обратной связи нужна для быстрой доставки большого количества отдельных молекул в канал. Автоматизированный инструмент может отслеживать и доставлять отдельные молекулы со скоростью более 500 частиц/мин. «Как только молекулы проходят через нанопоры и попадают в микрофлюидные каналы, все контролируется давлением и скоростью потока в канале, — объяснил руководитель исследования Хольгер Шмидт. — Исследователь может отобрать сотни молекул и провести эксперимент на каждой из них в хорошо контролируемой среде».
Чип также может выделять целевую молекулу из гетерогенной смеси. Исследователи избирательно пропускали в ворота отдельные частицы ДНК или бактериальные 70S рибосомы, различая их по электрическим сигналам транслокации, в том числе по амплитуде и времени остановке в поре. Точность различения 70S рибосом и ДНК, проходящих через канал, составила почти 95%.
Систему можно использовать и для оптического обнаружения биомолекул. Например, исследователи вводили в чип молекулу ДНК, закрывали нанопору, отключив управляющее ей напряжение, а затем обнаруживали целевую молекулу по флуоресценции. Используя как электрические, так и оптические сигналы, они могли рассчитать скорость движения ДНК в канале. Предполагается, что использование оптического режима наряду с электрическим гарантирует надежный скрининг частиц.
У метода есть ограничения, так, на повторное открытие поры после закрытия уходит не менее 1,5 мсек, из-за чего система пропускает молекулы, которые иначе могли бы быть отсортированы. Поэтому исследователи планируют применить антиброуновскую электрокинетическую ловушку (ABEL), которая использует лазер для удержания отдельных молекул в водном растворе.
В этом исследовании целевые молекулы извлекали из буферных растворов, но в следующем проекте будут изучаться образцы крови и мочи. Команда также планирует использовать оптофлюидный чип для исследования функций рибосомы: захватить рибосому, синтезирующую белок, с помощью оптического метода, например ABEL. Но для этого метод необходимо усовершенствовать.
Исследователи также запустили в Санта-Кларе (штат Калифорния) стартап под названием Fluxus, чтобы коммерциализировать платформу для молекулярного анализа на основе своего оптофлюидного чипа.
Источники
M. Rahman, et al. // On demand delivery and analysis of single molecules on a programmable nanopore-optofluidic device // Nature Communications, 2019, 10, 3712, DOI: 10.1038/s41467-019-11723-7
Optofluidic Chip Integrates Nanopores, Electrical Feedback to Control Single-Molecule Delivery


 Меню
Меню





 Все темы
Все темы




 0
0