Перепрограммирование митохондрий раковых клеток повышает иммуногенность опухоли
Многие пациенты с онкологическими заболеваниями не отвечают на иммунотерапию, и исследователи ищут новые возможности повысить ее эффективность. Опубликованная в Science работа демонстрирует, что потеря комплекса II дыхательной цепи митохондрий снижает рост меланомы за счет активации главного комплекса гистосовместимости, которая позволяет Т-клеткам лучше распознавать опухоль.
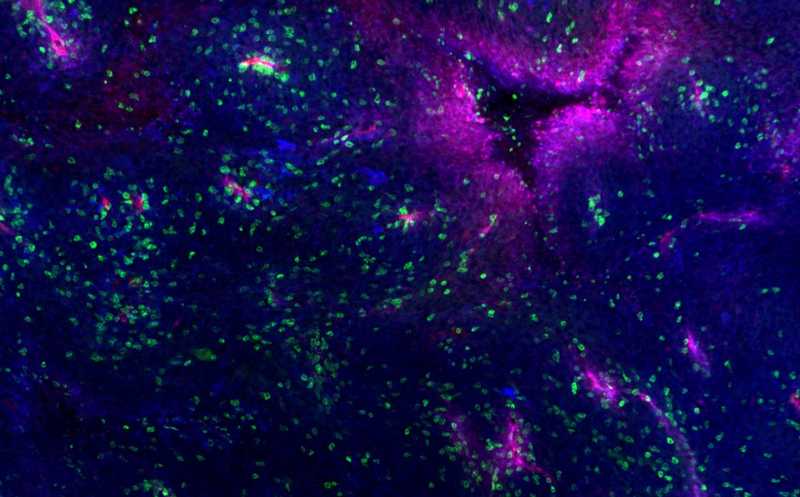
Меланома мыши, содержащая кровеносные сосуды (красный), белки MHC (синий) и инфильтрированная иммунными клетками (зеленый).
Credit:
Salk Institute |
пресс-релиз
Цикл трикарбоновых кислот и дыхательная цепь в митохондриях обеспечивают метаболическую пластичность, необходимую для прогрессии раковой опухоли. Дыхательная цепь состоит из 4 комплексов. Комплекс I (NADH-дегидрогеназа) и комплекс II (сукцинатдегидрогеназа) передают электроны от NADH и FADH2 на убихинон для доставки на комплекс III, и, наконец, на кислород через комплекс IV. Известно, что раковые клетки способны выживать с мутациями в комплексах I и II. Авторы недавней публикации в Science изучили, какой вклад эти комплексы вносят в прогрессию и иммуногенность опухоли.
Исследователи получили мышиные клеточные линии YUMM1.7 (меланома мыши) с нокаутом комплекса I или II и подсадили эти клетки мышам. Потеря каждого из этих комплексов снижала потребление кислорода и пролиферативную активность клеток. Клетки с нокаутом комплекса I при этом показывали более низкие показатели клеточного дыхания и пролиферации, чем с нокаутом комплекса II. По-видимому, комплекс I служит основным источником электронов для дыхательной цепи в клетках YUMM1.7. Нокаут первого комплекса приводил к повышению уровня NADH, а нокаут второго комплекса — к повышению уровня сукцината.
Затем авторы привили нокаутные клетки сингенным мышам дикого типа C57BL/6. Опухоли, нокаутные по комплексу I, не имели дефектов пролиферации. Однако рост опухолей с нокаутом комплекса II оказался замедлен. Анализ опухолевых образцов, нокаутных по комплексу II, на проточном цитометре показал повышенную инфильтрацию иммунными клетками, в особенности CD8+ Т-лимфоцитами. При этом изменений в количестве CD4+ Т-лимфоцитов выявлено не было. CD8+ Т-клетки из нокаутных по комплексу II опухолей продуцировали больше IFN-γ и гранзима B. Это позволяет предположить, что за наблюдаемое подавление роста опухоли ответственна эффекторная функция Т-клеток.
Так как презентация антигена в комплексе с MHC I класса служит определяющим фактором в активации Т-клеток, авторы работы решили исследовать экспрессию MHC I класса на клетках опухолей с нокаутами комплексов I и II. Они обнаружили, что клетки с нокаутом комплекса II экспрессируют повышенный уровень MHC I класса. Дальнейший анализ раковых датасетов выявил отрицательную корреляцию между экспрессией генов комплекса II и цитотоксической сигнатурой Т-клеток в 33 опухолях из 36. Низкая экспрессия одного из генов комплекса II — SDHC — в клетках рака молочной железы и рака кожи была ассоциирована с повышенной экспрессией маркеров цитотоксических Т-клеток (CD8A, CD8B, GZMA, GZMB, IFNG, и PFR1). По этим данным авторы предположили, что потеря комплекса II стимулирует противораковую активность Т-лимфоцитов через повышение презентации опухолевых антигенов.
Далее исследователи решили выяснить природу сигналинга, отвечающего за повышение презентации опухолевых антигенов в ответ на потерю комплекса II. На нескольких мышиных клеточных линиях они показали, что ингибирование комплекса II с помощью 3-нитропропионовой кислоты (3-NPA) приводит к повышенной экспрессии молекул MHC I класса. Эта связь подтвердилась и на транскриптомном уровне. В клетках YUMM1.7, экспрессирующих овальбумин в качестве модельного антигена, ингибирование комплекса II повышало презентацию пептида в комплексе с MHC I класса.
После этого ученые провели профилирование экспрессии генов на клетках YUMM1.7, обработанных ингибиторами комплексов I и II. В клетках с ингибированным комплексом II был обогащен сигнальный путь интерферона, в том числе гены, ассоциированные с процессингом и презентацией антигена. Нокаут Ifngr1 или Stat1, входящих в этот сигнальный путь, приводил к элиминированию зависимой от IFN-γ экспрессии MHC I класса, но ингибирование комплекса II в таких клетках все равно повышало экспрессию генов, участвующих в антигенпрезентации (MHC-APP). Это демонстрирует, что сигналинг интерферона не является обязательным для активации генов MHC-APP в ответ на ингибирование второго комплекса. Выяснилось также, что активация этих генов частично зависела от NLRC5 — рецептора, участвующего в регуляции врожденного иммунитета.
Очень важным показателем ферментативной активности 2-оксоглутарат-зависимых диоксигеназ является соотношение альфа-кетоглутарата и сукцината. Исследователи изучили роль комплекса II в его регуляции. Они показали, что ингибирование комплекса II или добавление сукцината к клеткам снижало соотношение альфа-кетоглутарата и сукцината. Также это приводило к повышенному триметилированию некоторых лизиновых остатков гистона H3 — эти эпигенетические изменения связаны с регуляцией транскрипции. Состояние метилирования гистонов определялось по активности гистоновых метилтрансфераз и лизин-специфичных деметилаз. Ингибирование последних с помощью сукцината приводило к повышенному метилированию гистонов. Также в ходе этих опытов авторы установили, что ингибирование H3K4me3 деметилаз увеличивало экспрессию MHC I класса.
Чтобы установить влияние ингибирования комплекса II на эпигенетическое репрограммирование, ученые оценили уровень меток H3K4me3 и H3K36me3 методом ChIP-секвенирования. Это исследование они проводили на клетках YUMM1.7, обработанных 3-NPA, 3-NPA и альфа-кетоглутаратом, либо DMSO в качестве контроля. Анализ показал усиление сигналов H3K4me3 и H3K36me3 после ингибирования комплекса II, которое снижалось после добавления альфа-кетоглутарата. Обогащение данными эпигенетическими метками чаще наблюдалось в генах, связанных с процессингом и презентацией антигенов. Например, уровень H3K4me3 повышался в промоторных регионах генов Nlrc5, Psmb9, Tap1 и Psmb8.
Авторы работы предположили, что накопление сукцината после ингибирования комплекса II изменяет эпигенетический ландшафт генов, ассоциированных с процессингом и презентацией антигенов, путем подавления активности гистоновых деметилаз KDM4 и KDM5 и повышения уровня NLRC5, что индуцирует транскрипцию генов MHC-APP.
Раковые клетки способны понижать экспрессию генов MHC-APP, тем самым избегая иммунной системы. В некоторых случаях они становятся нечувствительны к IFN-γ, который способен активировать MHC-APP. Результаты данной работы показывают, что ингибирование комплекса II дыхательной цепи в митохондриях может повышать экспрессию генов MHC-APP через накопление сукцината и независимым от IFN-γ путем. Этот подход может служить основой для разработки нового терапевтического подхода в борьбе с раком. «Мы считаем, что нашли новый механизм, с помощью которого регулируется презентация антигенов в опухолевых клетках, — говорит Картик Варанаси, один из соавторов исследования. — Эти результаты меняют наши представления о будущих стратегиях лечения».
Цитата по пресс-релизу
Источник
Mangalhara KC, et al. Manipulating mitochondrial electron flow enhances tumor immunogenicity // Science, 2023. DOI: 10.1126/science.abq1053


 Меню
Меню





 Все темы
Все темы




 0
0








