Противораковый препарат замедлил развитие поликистоза почек у мышей
Аутосомно-доминантная поликистозная болезнь почек (АДПБП) — это неизлечимое заболевание, однако исследование, опубликованное в PNAS, показало, что его развитие можно замедлить. Ученые вводили мышам с АДПБП противораковый препарат 11β-дихлор. Препарат вызывал окислительный стресс избирательно в клетках кист и индуцировал апоптоз, что приводило к уменьшению кист, снижению воспаления и фиброза. Аналог этого соединения, 11β-дипропил, оказался еще более эффективным и безопасным, поскольку не вызывал алкилирования ДНК и проявлял терапевтический эффект в меньшей дозировке.
Credit:
123rf.com
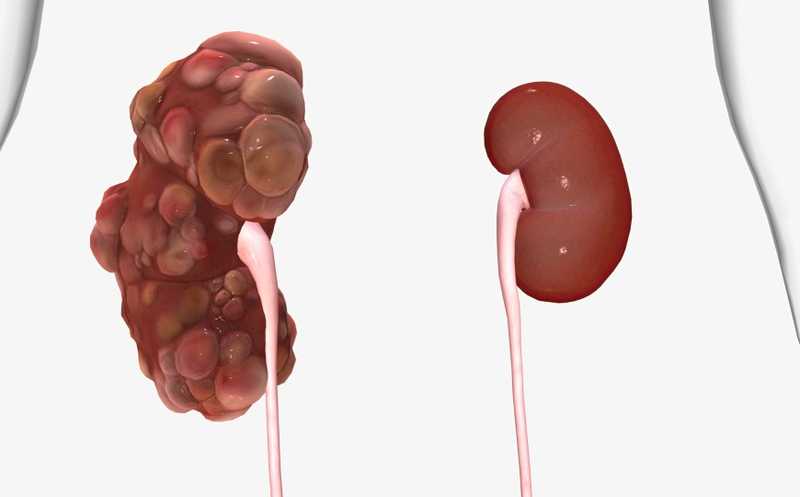
Более 12 миллионов человек во всем мире страдают от аутосомно-доминантной поликистозной болезни почек (АДПБП). Это неизлечимое заболевание, которое в 50% случаев приводит к терминальной стадии почечной недостаточности к 60 годам. Ученые из разных стран провели исследование на базе Массачусетского технологического института и Медицинской школы Йельского университета и обнаружили, что противораковый препарат 11β-дихлор вызывает окислительный стресс и, как следствие, запускает апоптоз в клетках кист в почках мышей. Применение этого препарата на мышиных моделях АДПБП способствовало уменьшению кист, а также связанных с ними воспаления и фиброза, не нарушая при этом функции почек.
Известно, что АДПБП развивается при наличии мутаций в генах PKD1 и PKD2, кодирующих полицистин-1 и полицистин-2. Потеря функции этих белков вызывает множество изменений в клетках почек, в том числе нарушения клеточного дыхания и энергетического обмена, а также дисфункцию митохондрий. Такие изменения схожи с теми, что возникают в раковых клетках. Авторы исследования использовали эти нарушения как мишень для терапии и воздействовали на них соединением, вызывающим окислительный стресс и применяемым в терапии рака — 11β-дихлором, а также его производным, не повреждающим ДНК.
Исследование проводили на мышиной модели АДПБП. Для этого к седьмому дню постнатального развития у мышей избирательно инактивировали Pkd1 в собирательных трубочках почек. С 10 по 23 день постнатального развития животным внутрибрюшинно вводили 11β-дихлор в дозировке 10 мг/кг — треть дозы, успешно применяемой для лечения мышей с ксенотрансплантатами опухолей. Гистологический анализ показал, что препарат снижал рост кист по сравнению с контролем. Более низкое содержание азота в моче мышей, получавших препарат, свидетельствовало об улучшении функции почек.
Ученые также обнаружили, что эффективность 11β-дихлора зависит от генотипа клеток. Модельные животные в данном исследовании имели генотип Pkd1+/-, то есть были гетерозиготны по гену Pkd1. При этом в собирательных трубочках почек этот ген инактивировался, и клетки приобретали генотип Pkd1-/-. Вводимый препарат индуцировал апоптоз в Pkd1-/- клетках кисты, в то время как в гетерозиготных клетках канальцев Pkd1+/- такого эффекта не наблюдалось.
Еще одну модель поликистозной болезни почек, более близкая к медленному прогрессированию заболевания у людей, авторы работы получили с помощью доксициклин-индуцируемой Cre-рекомбиназы. Чтобы инактивировать с ее помощью Pkd1, мышам добавляли доксициклин в питьевую воду в период с 28 по 42 день постнатального развития. Затем в течение 12 недель животные получали 11β-дихлор, после чего проводился гистологический анализ. Как и в предыдущей модели, скорость апоптоза в клетках кист у мышей, получавших препарат, была выше, чем у контрольных животных. Кроме того, окрашивание на Ki67, маркер пролиферации, показало, что 11β-дихлор не влиял на пролиферацию клеток в тканях почек.
При АДПБП в почках повышается уровень провоспалительных цитокинов TNF-α, IL-1β и IL-18, а также активированной каспазы-1. Воспаление приводит к фиброзу и рубцеванию в тканях почек, что выражается в виде гиперактивации миофибробластов. Авторы исследования показали, что лечение 11β-дихлором снижало уровни TNF-α, IL-1β и активированной каспазы-1 до нормальных значений. Кроме того, препарат нормализовал уровень маркеров активации миофибробластов и, следовательно, препятствовал фиброзу.
С помощью антител к 4-гидроксиноненалю (4-HNE), маркеру перекисного окисления липидов, авторы показали скопление этого соединения в клетках кист. Это говорит о протекании перекисного окисления в клетках почек при поликистозной болезни. Лечение мышей 11β-дихлором увеличивало содержание 4-HNE, а также повышало экспрессию генов, связанных с окислительным стрессом. Таким образом, 11β-дихлор усиливал окислительный стресс в клетках кист.
Кроме того, исследование демонстрирует, что окислительный стресс — это неотъемлемый компонент механизма действия 11β-дихлора. Одновременный прием витамина Е (антиоксидант) с исследуемым препаратом приводил к потере терапевтического эффекта. Количество апоптотических клеток при этом не увеличивалось, а маркер окислительного стресса 4-HNE не детектировался.
Несмотря на свой терапевтический эффект, 11β-дихлор способен алкилировать ДНК. Поэтому авторы протестировали аналог этого соединения, 11β-дипропил, который лишен такого эффекта. Оказалось, что 11β-дипропил так же замедляет прогрессирование поликистозной болезни почек, как и 11β-дихлор, и даже в более низкой дозировке — 5 мг/кг, и при этом обладает низкой системной токсичностью.
Исследование показало, что противораковый препарат 11β-дихлор, а также его производное 11β-дипропил замедляют прогрессирование поликистозной болезни почек в мышиных моделях. Кроме того, 11β-дипропил оказался более безопасным, поскольку он не алкилирует ДНК, а также продемонстрировал эффективность в более низкой дозировке, чем 11β-дихлор.
Источник
Bogdan I. Fedeles et al. A synthetic agent ameliorates polycystic kidney disease by promoting apoptosis of cystic cells through increased oxidative stress // PNAS, 121 (4), January 19, 2024. DOI: 10.1073/pnas.2317344121








 Меню
Меню





 Все темы
Все темы





 0
0