Рак поджелудочной железы чувствителен к ингибитору IDH1 при дефиците магния
Клетки рака поджелудочной железы способны адаптироваться к пониженному уровню питательных веществ благодаря метаболическому ферменту изоцитратдегидрогеназе 1 (IDH1). Ингибиторы мутантной формы IDH1 используют для терапии некоторых форм рака. В норме эти препараты не действует на фермент дикого типа, но ученые из США показали, что они могут ингибировать его при низкой концентрации магния. Авторы успешно применили ингибитор ивосидениб для терапии рака поджелудочной железы у мышей и готовятся к началу клинических испытаний.
Credit:
University Hospitals | Пресс-релиз
В микроокружении опухоли развиваются особые условия с пониженным уровнем питательных веществ и кислорода. Механизмы защиты опухоли от метаболического стресса способствуют развитию резистентности к химиотерапии, поэтому являются потенциальной терапевтической мишенью. Ученые из США обнаружили, что выжить в стрессовых условиях раковым клеткам помогает фермент изоцитрадегидрогеназа 1 (IDH1). Они предполагают, что это молекула может стать новой терапевтической мишенью в лечении рака поджелудочной железы.
Сначала ученые культивировали клетки аденокарциномы протоков поджелудочной железы (PDAC) в условиях низкой концентрации глюкозы. Это приводило к повышенному содержанию АФК в среде. Чтобы понять, как клетка справляется с окислительным стрессом, ученые провели скрининг 13 NADH-вырабатывающих ферментов с помощью интерферирующих РНК. Только сайленсинг IDH1 снижал способность опухолевых клеток противостоять стрессу. Более того, ксентрансплантанты с нокаутным геном IDH1 хуже профилировали в мышах. В отличие от клеток PDAC, нераковые клеточные линии не демонстрировали активации IDH1 в ответ на стрессовые условия. Следовательно, этот фермент особенно важен именно для опухолевых клеток.
При метаболическом стрессе IDH1 поддерживает функции митохондрий. В условиях низкой концентрации глюкозы у нокаутной линии раковых клеток наблюдались более низкий уровень потребления кислорода и нарушение поляризации митохондриальной мембраны. Также в нокаутной линии был понижен уровень метаболитов цикла трикарбоновой кислоты. Экзогенный α-кетоглутарат (продукт IDH1) восстанавливал уровни метаболитов. Напротив, изоцитрат (субстрат IDH1) не влиял на метаболизм нокаутных клеток.
Исследователи предложили использовать аллостерические ингибиторы мутантной формы IDH1 (mIDH1) для воздействия на раковые клетки. В норме такие ингибиторы не действуют на дикий тип фермента (wtIDH1), так как им мешает крепко связанный ион магния в сайте взаимодействия с ингибитором. Однако в микроокружении опухоли концентрация этого иона часто понижена и обе формы фермента одинаково реагируют на ингибиторы.
В качестве терапевтического соединения исследователи использовали ивосидениб, поскольку этот препарат показал хорошие результаты по сравнению с другими и уже одобрен FDA для лечения резистентного острого миелоидного лейкоза и холангиокарциномы с мутацией IDH1. Чтобы подтвердить взаимодействие ингибитора с wtIDH1, ученые создали флуоресцентный зонд, связывающийся с wtIDH1. Эксперименты показали, что ивосидениб успешно замещал этот зонд в условиях пониженной концентрации Mg2+. Обработка опухолевых клеток ивосиденибом приводила к образованию внутриклеточных АФК, а окислительный стресс детектировали даже в ядрах клеток.
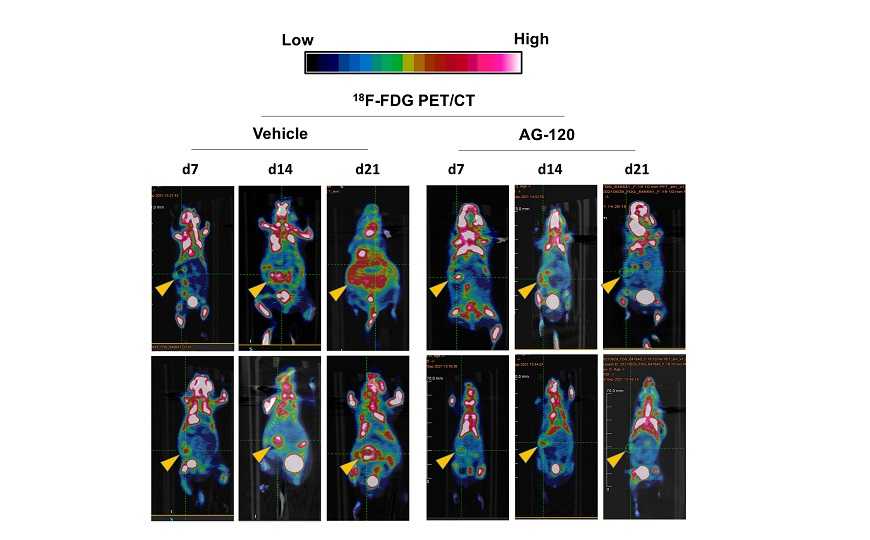
Ученые также проверили ивосидениб in vivo на мышах. Препарат уменьшил размер бокового ксенотрансплантата из двух разных клеточных линий PDAC, а также ксенотрансплантата, полученного от пациента. Также ивосидениб уменьшал рост подкожно имплантированных мышиных аллотрансплантатов. У 35% мышей, получавших лечение, не было клинических признаков прогрессирования рака в течение трех месяцев, в то время как контрольная группа умирала довольно быстро. Ивосидениб не демонстрировал системной токсичности.
Ученые полагают, что иводесениб может стать новой терапией рака поджелудочной железы. Аминокислотная последовательность IDH1 консервативна у человека и мыши, а аллостерический карман почти идентичен. Авторы планируют клиническое испытание ивосидениба в сочетании с химиотерапией для лечения PDAC с IDH1 дикого типа.
Источник
Vaziri-Gohar A., et al. Limited nutrient availability in the tumor microenvironment renders pancreatic tumors sensitive to allosteric IDH1 inhibitors. // Nature Cancer (2022) DOI: 10.1038/s43018-022-00393-y


 Меню
Меню





 Все темы
Все темы




 0
0








